Hallo zusammen
Da ich kürzlich die
Prüfung zum Pilzkontrolleur in der Schweiz absolviert habe und alles noch ganz frisch ist, dachte ich mir, schreibe ich mal einen
Erfahrungsbericht, wie das in der Schweiz so abläuft. Es gibt hier
im Forum ja schon Erfahrungsberichte zur PSV-Prüfung in Deutschland,
zur Schweiz habe ich nichts gefunden. Da hier auch einige Schweizer
unterwegs sind, ist es für die eventuell von Interesse oder
vielleicht interessiert sich ja auch der ein oder andere Kollege aus
Deutschland oder Österreich mal für den Ablauf in der Schweiz.
Gleichzeitig möchte ich diesen Beitrag auch gleich nutzen, um mich
für die ganze Hilfe, die ich hier im Forum erhalten habe, zu
bedanken. Ohne euch wäre das alles für mich nicht möglich gewesen.
Normalerweise wird
ein Jahr vor der Prüfung ein sechstägiger Vorkurs absolviert und
dann im Jahr darauf die Prüfung.
Ablauf
Der Kurs mit Prüfung
geht, wie der Vorbereitungskurs 6 Tage. Der Kurs fängt am Samstag
Mittag an und geht bis Freitag Vormittag. Die Prüfung besteht aus
drei theoretischen und zwei praktischen Prüfungen. Diese finden dann
am Sonntag (schriftliche Giftpilzprüfung und schriftliche Prüfung
zur Toxikologie und Ökologie), am Dienstag (schriftliche Prüfung
zur Lebensmittelgesetzgebung) und am Donnerstag (Korbkontrolle und
Pilzartenerkennung) statt.
Theoretische
Prüfungen
Die theoretischen
Prüfungen sind Multiple-Choice-Verfahren. Mit Ausnahme der
Giftpilzprüfung können auch mehrere Antworten pro Frage richtig
sein. Es gibt keine halben Punkte und nur komplett richtig
beantwortete Fragen geben einen Punkt.
Die schriftliche
Giftpilzprüfung
Für diese Prüfung
muss man zu 21 giftigen Pilzarten die Merkmale (Hutform, Hutfarbe,
Hutoberfläche, Fleisch, Lamellenfarbe, Lamellenhaltung, Sporenfarbe,
Stiel- und Stielmerkmale, Geruch, Geschmack) genau wie in den
Unterlagen lernen (am besten mehr oder weniger auswendig). Am Abend
vor der Prüfung erhält man dann eine Liste mit zehn Pilzen, die
dran kommen könnten und an der Prüfung werden dann 6 Pilze
detailliert abgefragt. Pro Pilzart gibt es 10 Fragen und man kann 5
Punkte holen. Das heisst insgesamt gibt es 60 Fragen mit 30 Punkten
und man hat 30 Minuten Zeit. Man muss mindestens 25 Punkte holen,
damit diese Prüfung bestanden wird. Besteht man diese Prüfung
nicht, darf man an den weiteren Prüfungen nicht mehr teilnehmen und
die gesamte Prüfung gilt bereits als nicht bestanden.
Die schriftliche
Prüfung zur Toxikologie und Ökologie
Bei dieser Prüfung
werden 20 Fragen gestellt. Die Fragen beinhalten:
- die Toxikologie
der Pilze und der verschiedenen Krankheitsbilder (Syndrome), die sie
auslösen können
- das Verhalten bei Vergiftungsfällen
- die Mykologie wie die Klassifikation, die Gattungslehre, die Ökologie, usw.
Auch für diese
Prüfung hat man 30 Minuten Zeit. Man muss hier mindestens eine 4
erreichen (Schweizer Notensystem 1 (= sehr schlecht, Kenntnisse nicht
vorhanden) bis 6 (= sehr gute Kenntnisse)), damit man diesen Teil
besteht und es wieder eine Runde weitergeht.
Die schriftliche
Prüfung zur Lebensmittelgesetzgebung
Hier werden 20
Fragen zur Kenntnis der relevanten Vorschriften der
Lebensmittelgesetzgebung abgefragt, ansonsten ist der Ablauf genau
gleich, wie in der vorherigen Prüfung.
Wenn man sich gut
vorbereitet sind die theoretischen Prüfungen wirklich gut zu
meistern. Zeit hat man eigentlich auch mehr als genug.
Praktische Prüfungen
Korbkontrolle
Hier wird eine
Korbkontrolle simuliert und bewertet. Die Bewertung erfolgt wieder
nach Schweizer Notensystem.
Soweit ich noch
weiss befanden sich im Korb ein Lachsreizker – Lactarius
salmonicolor, zwei Maronenröhrlinge – Imleria badia, zwei
Starkriechende Pfifferlinge – Craterellus lutescens, drei
Trompetenpfifferlinge - Cantharellus tubaeformis, drei Habichtspilze
- Sarcodon imbricatus, drei Bärtige Ritterlinge – Tricholoma
vaccinum, ein einzelner Weisser Büschelrasling – Leucocybe connata
und ein Kegelhütiger Knollenblätterpilz – Amanita virosa.
Während man die
Kontrolle durchführt versucht einem der Experte durch irgendwelche
Fragen etwas aus der Ruhe zu bringen, man weist ihn dann einfach
darauf hin, dass man sich jetzt konzentrieren muss und allfällige
Fragen gerne am Schluss beantwortet werden. Dann nimmt man die Pilze
aus dem Korb und sortiert diese nach Speisepilze, ungeniessbare Pilze
und Giftpilze auf dem Tisch. Den leeren Korb dreht man kurz um und
gibt ihm einen kleinen Klaps auf den Boden, damit er komplett leer
ist.
Dann trägt man den
ersten Speisepilz auf dem Kontrollschein ein und legt diesen in den
Korb. Falls es beim Pilz etwas spezielles zu beachten gilt, erwähnt
man das und markiert auch die entsprechende Stelle auf dem
Kontrollschein. Das wäre z.B., dass der Lachsreizker ein Bratpilz
ist oder der Habichtspilz ein Würzpilz. So fährt man fort, bis man
alle Speisepilze im Korb hat.
Dann werden die
ungeniessbaren Pilze mit Namen genannt und deren Stückzahl unter
«ungeniessbare Pilze» auf dem Kontrollschein erfasst. Das wäre
hier 4 (drei Bärtige Ritterlinge, ein weisser Büschelrasling).
Zum Schluss werden
noch die tödlich giftigen Pilzarten mit Namen genannt und auf dem
Kontrollschein erfasst. Das war hier der der Kegelhütige
Knollenblätterpilz. Die tödlich giftigen Pilzarten sind auf dem
Kontrollschein mit Artnamen aufgeführt und müssen an der
entsprechenden Stelle erfasst werden. Falls es noch giftige Pilze,
die nicht auf dem Kontrollschein aufgeführt sind, im Korb hat, muss
man diese selbst unter «Giftige Pilzarten» dazuschreiben. Das war
hier aber nicht der Fall.
Ich habe mir den
Kegelhütigen Knollenblätterpilz auch noch genau angesehen und dazu
gesagt, dass ich die restlichen Pilze freigeben kann, da der
Fruchtkörper noch völlig intakt ist und nichts abgesplittert ist,
wäre dem nicht so, hätte ich den ganzen Korb nicht freigegeben.
Zudem habe ich noch darauf hingewiesen, dass man künftig unbekannte
Pilze lieber in ein separates Gefäss legen sollte.
Es ist übrigens
auch möglich, dass man bei der Korbkontrolle z.B. einen Grünen
Knollenblätterpilz ohne Hut oder nur einen Hut oder ähnliches im
Korb hat. Auch angeschimmelte oder nicht mehr frische Pilze können
im Korb sein. Wird einer der eliminatorischen Pilze nicht mit Artname
erkannt gilt die ganze Prüfung als nicht bestanden.
Pilzartenerkennung
Bei diesem Teil der
Prüfung werden 70 verschiedene Pilzarten aufgelegt. Diese müssen
dann mit dem Artnamen (deutsch oder wissenschaftlich) und dem
Speisewert (Speisepilz, kein Speisepilz, Giftpilz) benannt werden.
Jede richtige Antwort (Artname plus Speisewert) gibt einen Punkt.
Halbe Punkte werden nicht vergeben.
Es gibt 15
eliminatorische Pilze (plus drei eliminatorische Gruppen: kleine
weisse Trichterlinge, Inocybe spp., Lepiota spp.) die falls sie
aufliegen, erkannt werden müssen, ansonsten gilt die ganze Prüfung
als nicht bestanden. Des Weiteren gibt es 18 Pilze (plus drei
Gruppen: Agaricus Sect. Xanthodermatei, Dermocybe spp. alle
Cortinarien mit gelbem, orangem, rotem od. grünem Fleisch), die bei
Nichterkennen 5 Punkte Abzug geben.
Man darf dem
Experten gewisse Fragen stellen, die mit Ja oder Nein beantwortet
werden können. Man erhält aber nicht auf jede Frage eine Antwort.
Es geht dabei hauptsächlich um Fragen, die man selbst schnell und
einfach überprüfen könnte, wenn man den Pilz in der Hand hätte,
z.B. ob der Pilz milcht, mild oder scharf ist, wie die Konsistenz
ist, ob die Lamellen einfach abschiebar sind, usw. Fragen zum Geruch
werden nicht beantwortet, allerdings wird einem der Pilz, wenn
gewünscht an die Nase gehalten, damit man selbst riechen kann.
Um diesen Teil zu
bestehen müssen mindestens 50 Punkte erreicht werden.
Mit diesem Teil der
Prüfung geht es direkt nach der Korbkontrolle weiter. Die 70
Pilzarten sind auf drei Räume (23+23+24=70) verteilt. Für jeden
Raum hat man etwas mehr als 8 Minuten Zeit (pro Pilz etwas mehr als
21 Sekunden). Im Raum ist einer der Experten, sowie ein Schreiber,
welcher die Antwort mit dem Pilz auf der Liste vergleicht. Man geht
von Pilz zu Pilz und wenn man mal keine Antwort parat hat, kann man
einen Jeton legen lassen und sich den Pilz am Schluss nochmal
anschauen. Man muss hier aufpassen, denn, spätestens wenn man beim nächsten
Pilz ist, kann man eine gemachte Antwort nicht mehr korrigieren. Ich
kann mich natürlich nicht mehr an jeden Pilz erinnern, auch durch
die ganze Aufregung. Aber von den eliminatorischen Pilzen war auf
jeden Fall der Tigerritterling – T. pardinum, der Kegelhütige
Knollenblätterpilz – A. virosa, der Grüne Knollenblätterpilz –
A. phalloides, der Spitzgebuckelte Raukopf – C. rubellus und der
Pantherpilz – A. pantherina dabei. Von den Pilzen, die 5 Punkte
Abzug geben, war, soweit ich noch weiss, der Kahle Krempling – P.
involutus, der Grünblättrige Schwefelkopf – H. fasciculare, der
Spitzschuppige Stachelschirmling – E. asperum, der Rettichhelmling
– M. pura, der Anisklumpfuss – C. odorifer und der Blutrote
Hautkopf – C. sanguineus dabei.
Zuerst dachte ich
immer, dass man in diesem Teil mit 21 Sekunden pro Pilz wenig Zeit
hat. Im Nachhinein muss ich sagen, dass man sich darüber eigentlich
ziemlich wenig Sorgen machen muss. Ich denke die meisten hatten
wirklich genug Zeit. Ich weiss noch, im ersten Raum, liess ich bei
einem Täubling einen Jeton setzen und als ich mir diesem am Schluss
nochmal angeschaut hatte, sagte mir die Expertin: "So, jetzt hast du
für diesen Pilz noch über 5 Minuten Zeit." Das heisst ich hatte
für die anderen Pilze im Schnitt nur etwas über 8 Sekunden pro Pilz
gebraucht. Aufpassen muss man bei den eliminatorischen Pilze, da dort
ein falscher Artname das Ende der gesamten Prüfung bedeuten kann.
Auch die Pilze mit einem 5-Punkte-Abzug sollte man gut kennen, denn
es ist schade, wenn man wegen einem solchen 5 Punkte verliert. Wenn
man nicht ganz sicher ist, geht man in Gedanken also lieber nochmal
genau alle diese Pilze durch, um diese auszuschliessen.
Wird eine der
Teilprüfungen nicht bestanden, gilt die ganze Prüfung als nicht
bestanden und bei einer Wiederholung im darauffolgenden Jahr müssen
alle Prüfungen (theoretische und praktische) erneut gemacht werden.
Da ich oben immer
wieder von eliminatorischen Pilzen und Pilzen mit 5-Punkte-Abzug
schreibe, möchte ich diese hier noch auflisten.
Die eliminatorischen
Pilze sind:
Amanita muscaria,
Amanita pantherina, Amanita phalloides, Amanita verna, Amanita
virosa, Cortinarius orellanus, Cortinarius rubellus, Entoloma
sinuatum, Galerina marginata, Inocybe erubescens, Inocybe fibrosa,
Rubroboletus satanas, Tricholoma equestre, Tricholoma filamentosum,
Tricholoma pardinum, sowie die Gruppe der kleinen, weissen
Trichterlinge, Inocybe spp., Lepiota spp.
Pilze mit
5-Punkte-Abzug sind:
Agaricus
xanthodermus, Amanita gemmata, Caloboletus radicans, Chlorophyllum
brunneum, Coprinopsis atramentaria, Echinoderma asperum, Entoloma
rhodopolium (+ Entoloma forma nidorosum), Gyromitra esculenta /
gigas, Gyromitra infula, Hypholoma fasciculare, Imperator torosus,
Mycena pelianthina, Mycena pura, Mycena rosea, Omphalotus illudens,
Paralepistopsis amoenolens, Paxillus involutus, Psilocybe
semilanceata, sowie die Gruppe Agaricus Sect. xanthodermatei,
Dermocybe spp., alle Cortinarien. mit gelbem, orangem, rotem od.
grünem Fleisch.
Tätigkeiten während der
prüfungsfreien Zeit
Wenn ihr bis hier
durchgehalten habt, interessiert es euch vielleicht auch noch, was
man sonst während der prüfungsfreien Zeit macht. Kurz gesagt, man
hat Unterricht, lernt nochmal etwas die Theorie, geht an Vorträge,
geht in den Wald Bestimmungsmaterial sammeln und geht in den
Pilzkeller zum Üben.
Während man im
Unterricht im Vorkurs noch relativ viel geschlüsselt hat, geht es
jetzt vor allem um Artenerkennung. Man bekommt wirklich sehr viele
Pilze zu Gesicht und merkt schnell, in welchen Gattungen man noch
Schwierigkeiten hat. Ein Teil des Unterrichts ist auch immer, dass
man von Fruchtkörpern z.B. nur den Stiel oder nur den Hut hat und
diese der richtigen Art zuordnen können soll.
Viele fragen sich
vielleicht noch, was der Pilzkeller ist. Dort landen die bestimmten
Pilze aller Kurse und sind mit dem Artnamen und dem Speisewert
angeschrieben. Hier geht man in den Pausen oder vor oder nach dem
Unterricht (am Morgen, Mittag oder am Abend) zum Üben. Es empfiehlt
sich, dass man sich einen sogenannten Paten sucht. Das ist eine
Person, welche bereits Pilzkontrolleur ist und bereit ist, mit zum
Lernen/Abfragen in den Pilzkeller zu gehen. Falls keiner am Kurs
teilnimmt, den man kennt, kann man sich bei der Leitung melden und
diese suchen dann einen Paten. Ich hatte das Glück, dass jemand, den
ihr hier auch kennt, auch einen Kurs besucht hat und zugesagt hat,
mein Pate zu sein, nämlich CH-Andy . Das war wirklich toll und wir
hatten viel Spass zusammen (vor allem am Anfang mit den Täublingen). 
Leider kann man
während den Prüfungen keine Fotos machen. Man muss auch immer das
Smartphone abgeben und hat somit gar nichts zum Fotografieren. Ein
paar Eindrücke aus dem Unterricht und dem Pilzkeller findet ihr
nachfolgend aber noch:
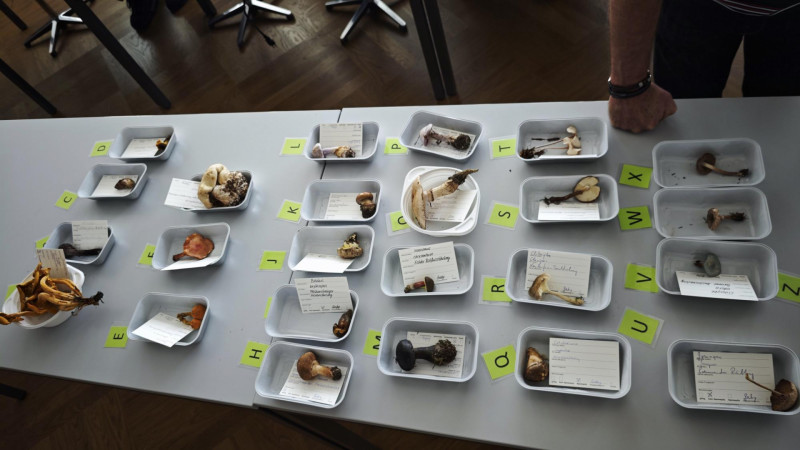
Eine Auswahl Pilze im Unterricht.

Hüte und Stielbasen verschiedener Pilze.

Sortieren und Besprechen der Funde nach dem Sammeln im Wald.

Eine Auswahl wichtiger Giftpilze.

Inocybe fibrosa

Cystoderma terrei

Hier sieht man einen Tisch im Pilzkeller. Ich glaube es stehen etwa 5 solcher Tische mit Pilzen dort.








Mein Weg und vielen
Dank
Richtig angefangen
mit den Pilzen habe ich eigentlich am 31.08.20 mit dem Registrieren
im 123 Pilzforum. Da der nächste Verein von mir über 2 Stunden und
der nächste Kontrolleur etwa 1.5 Stunden mit dem Auto von mir
entfernt wohnt, musste ich mir vieles mit Büchern und dem Internet
autodidaktisch beibringen. Deshalb war ich wirklich sehr auf die
Hilfe aus den Foren angewiesen. Zuerst war ich im 123 Pilzforum
unterwegs, allerdings habe ich parallel nach einer Weile auch schon
hier im Forum mitgelesen. Anfangs habe ich noch etwas gezögert mich
auch hier anzumelden, da ich es irgendwie etwas als Verrat am anderen
Forum angesehen hatte, was im Nachhinein vielleicht etwas kindisch
wirkt. Aber da das Niveau hier einfach viel höher ist, habe ich mich
schliesslich dann auch hier angemeldet und ich bereute es keine
Sekunde. Hier ist wirklich ein unglaubliches Wissen mit sehr
freundlichen Leuten unterwegs und ich möchte mich bei jedem
einzelnen bedanken, der mir schon mal weitergeholfen hat oder durch
seine wunderbaren Pilzbeiträge mir sonst irgendwie Wissen vermittelt hat.
Bei ein paar
Benutzern hier aus dem Forum möchte ich mich noch speziell bedanken:
Beorn , Clavaria , Cortinarius , Hannes2 , Oehrling , Schupfnudel ,
Steigerwaldpilzchen und Werner Edelmann (ich hoffe ich habe niemanden
vergessen). Ich denke, ihr habt mir auf meinem Weg zum
Pilzkontrolleur hier (und teilweise auch schon im anderen Forum) am
meisten geholfen und daher danke ich euch vielmals.  Natürlich möchte
ich aber auch alle anderen einschliessen, die mich unterstützt haben
und ich hier jetzt nicht direkt aufgeführt habe. Auch bei der lieben
Corinne , möchte ich mich für die netten Gespräche, das schöne
Treffen, Ihre Tipps zu den Täublingen und auch den ganzen sonstigen
Austausch bedanken.
Natürlich möchte
ich aber auch alle anderen einschliessen, die mich unterstützt haben
und ich hier jetzt nicht direkt aufgeführt habe. Auch bei der lieben
Corinne , möchte ich mich für die netten Gespräche, das schöne
Treffen, Ihre Tipps zu den Täublingen und auch den ganzen sonstigen
Austausch bedanken.
Besonders bedanken
möchte ich mich aber natürlich auch noch bei CH-Andy (nein, ich
habe dich nicht vergessen  ), nicht nur für die ganze Hilfe in den
Foren, sondern natürlich auch besonders, dass du in Landquart mein
Pate warst und mit mir gelernt hast. Andy ist wirklich ein toller
Mensch, mit dem man super lernen kann, aber bei dem auch immer mal
ein Spässchen drinnen liegt, da hat die Chemie wirklich super
gepasst, vielen Dank.
), nicht nur für die ganze Hilfe in den
Foren, sondern natürlich auch besonders, dass du in Landquart mein
Pate warst und mit mir gelernt hast. Andy ist wirklich ein toller
Mensch, mit dem man super lernen kann, aber bei dem auch immer mal
ein Spässchen drinnen liegt, da hat die Chemie wirklich super
gepasst, vielen Dank. 
Des Weiteren möchte
ich mich auch noch bei allen Lehrpersonen in Landquart ganz herzlich
bedanken. Der Unterricht hat wirklich Spass gemacht, ich konnte
einiges mitnehmen und wir wurden sehr gut auf die Prüfung
vorbereitet. Auch bei allen weiteren Beteiligten in Landquart, die
alles so gut organisiert haben, möchte ich mich noch bedanken.
Das war jetzt
ziemlich ausführlich und ich weiss nicht, ob jemand bis hierher
durchgehalten hat. Ich hoffe ich habe euch mit dem Bericht nicht zu
sehr gelangweilt. Falls jemand noch Fragen hat, darf er mir diese
natürlich sehr gerne stellen. Falls jemand Fehler findet, darf er mir die natürlich auch gerne mitteilen. Durch die ganze Aufregung gebe ich keine Gewähr auf Richtigkeit. 
Vielen Dank nochmal
an alle und LG
Benjamin
![]()


