Hallo zusammen,
am Montag ging es wieder in die Kalklaubwälder und auch Kalknadelwälder der Eifel, es gab aufgrund der zurückliegenden Trockenheit keine Unmengen an Pilzen, dafür aber viel Interessantes und aufregend Neues für mich.
Im Nadelwald ein großer Teppich
01 Aleuria aurantia - der Orangebecherling (hier mal ein "Ausschnitt")



Dort im Nadelwald auch Rauköpfe, welche alle Neufunde für mich darstellen:
02 Cortinarius venetus – grüner Raukopf


Sehr gefreut habe ich mich über
03 Cortinarius melanotus – braunnetziger Raukopf
den konnte ich im Feld nicht ansprechen, fand aber schon die Schuppung und Stielzeichnung interessant. Schnell stieß ich dann auf C. melanotus mit der Beschreibung Geruch intensiv nach Petersilie. Was soll ich sagen, wirklich wirklich intensiver Petersiliengeruch nach zerreiben der Lamellen. Wirklich eindrücklich. Sporen passen auch.

Stiel braunnetzig, daher sein Name ... (Petersilienraukopf hätte ich auch passend gefunden).
"Geruch, Hutschuppen und Velumfarbe machen die Art unverwechselbar" heißt es bei Gminder & Karasch (2023).

Sporen subglobos: 6,8-8,1 µm (av. 7,2 µm, SD 0,4 µm) x 5,4-6,7 µm (av. 5,9 µm, SD 0,4 µm); Q = 1,2-1,3 (av. 1,2, SD 0,0)(n = 6)

04 Cortinarius varius – semmelgelber Schleimkopf (sehr quick und sehr dirty aus der Hüfte im vorbeigehen), ein häufiger Fichtenbegleiter in der Kalkeifel:




Auch noch dort im Nadelwald ein weiterer Erstfund für mich
05 Pluteus roseipes - der rosastielige Dachpilz (vermeintlich am Boden, vermutlich auf vergrabenem Fichtenholz)

Stiel in allen Teilen rosa, wirkt auf den Bildern etwas blasser als im Original.


Einen weiteren Erstfund und in großen Mengen:
06 Boletopsis leucomelaena - der schwarzweiße Rußporling
ein Fichtenbegleiter in basenreichen Bergnadelwäldern; schwarzbraun, an Verletzungsstellen rosa (der seltene B. grisea wäre heller und ist ein Kiefernbegleiter).






Weiterhin
07 Calonarius meinhardii – der messinggelbe Fichtenklumpfuss (bekannt von der Stelle, nicht weiter untersucht):

Dann ging es im Kalklaubwald weiter.
Öfter zu finden und mit Scheunengeruch:
08 Cortinarius cliduchus (Syn. C. olidus) – der "gelbgegürtelte Schleimkopf" (Gminder & Karasch) oder der "körnighütige Schleimkopf" (Ludwig). Beides passend.




Ebenfalls ein Erstfund, den ich aufgrund des Vorkommens in großen Mengen auf basischen Böden bei Buchen und Eichen für
09 Lactarius luridus - den fahlen Milchling halte (nach C. Hahn sei die Art "relativ häufig in basenreichen Buchenwäldern", was ich bestätigen kann, kam gefühlt aller fünfzig Meter wieder)




Spannend dann eine Gruppe aus der Gattung Phlegmacium und der Sektion Phlegmacioides (eindeutige KOH-Reaktion).
Ich komme nach Schlüsseln/Bestimmen mit Saar et al (2022). JEC n. 24 zu:
10 Phlegmacium pseudodaulnoyae - (einen deutschen Namen habe ich nicht gefunden, ich schlage mal in Anlehnung an eine lateinische Bezeichnung der Art bei Kibby - siehe unten - den Namen "schuppenhäuptiger Schleimkopf" vor - wobei ich nicht weiß, wie stabil einerseits und spezifisch andererseits dieses Merkmal ist).
Zur Bestimmung muss ich sagen, dass meine Sporen dezent großer ausfallen und ich weniger über den Schlüssel als mehr über die hervorragend gestaltete Matrix "Ökologie, Mykorrhiza und Geruch" sowie die Detailbeschreibung bei der Art gelandet bin. Ich denke trotz der etwas größeren Sporen liege ich dennoch richtig, denn alles andere passt und es gibt einige ganz typische Merkmale. Zu diesen zählen:
- inbesondere die riesigen Schnallen der Epikutis, teils um 10µm (was ein gutes Merkmal ist).
- die Schuppen auf dem Hut (?), gut zu sehen auf den Bildern. Zumindest habe ich das ebend aus der Namensgebung bei Kibby geschlussfolgert - "Kibby (2019) als C.squamosocephalus" (Saar et al., 2022)
- der stark bräunenden Stielbasis
- dem teils "büscheligen" Wuchs
- beim Geruch bin ich etwas unsicher, mit "rote Beete" beschrieben, riecht jedenfalls kräftig (undefinierbar) bzw. könnte schon in diese Richtung gehen nach Reiben der Lamellen
- alles andere passt sowieso, inklusive Sporenform und Ornament

KOH-Reaktion (20%)



Hier schön die Schuppen auf dem Hut und die Lamellen des jungen FK zu sehen:


KOH nach einer Minute mit gelbem Rand nach einer Minute

mit typischer Entfärbung nach rosabraun nach 30 Minuten:

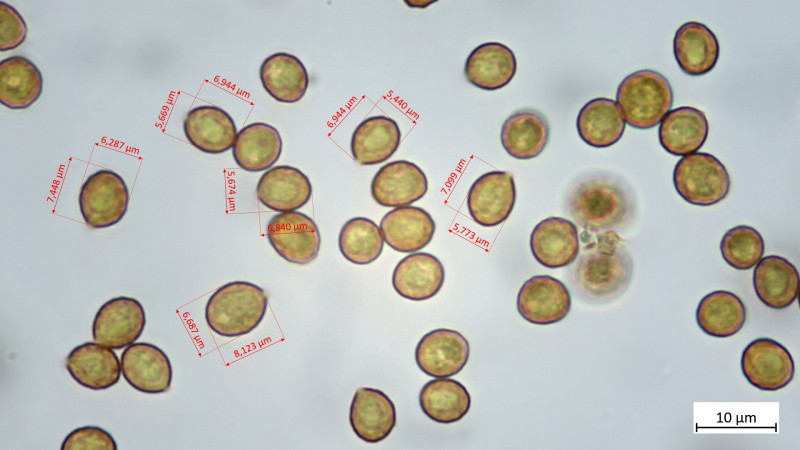
Sporen: 11,7-13,8 µm (av. 12,4 µm, SD 0,6 µm) x 5,8-6,7 µm (av. 6,1 µm, SD 0,3 µm); Q = 1,9-2,1 (av. 2,0, SD 0,1)(n = 12)


Riesige Schnallen der Epikutis, wie für die Art beschrieben:


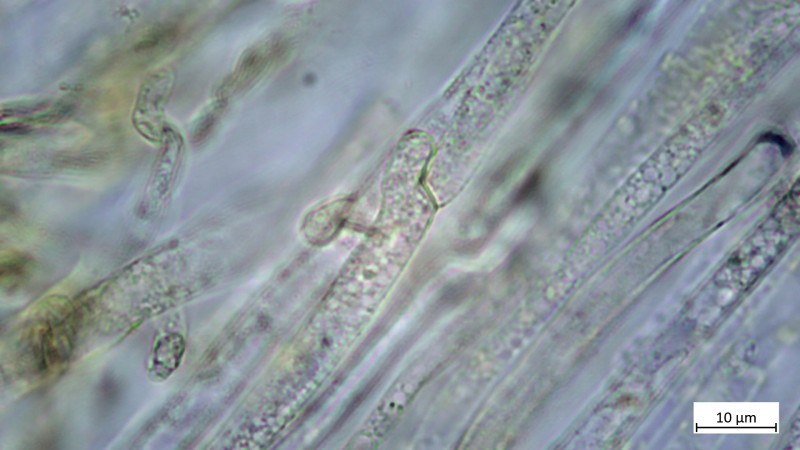
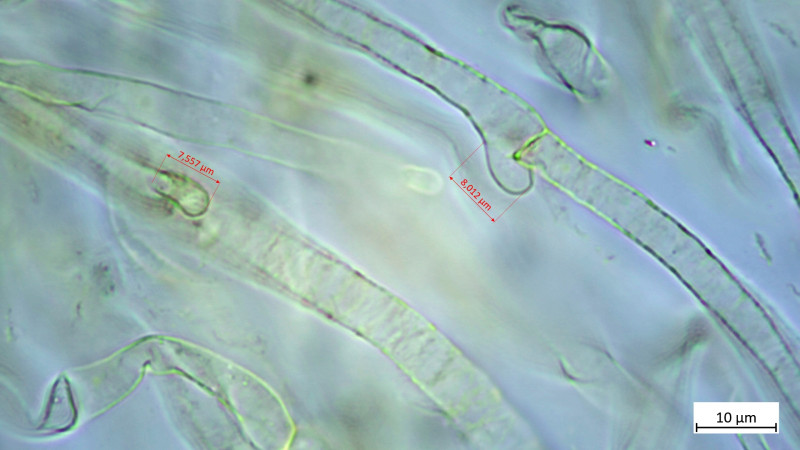
Dann für mich ein absolutes Highlight (ich lese hier öfter mal "steht auf meiner Wunschliste", wenn etwas auf meiner Wunschliste stand, dann dieser:
11 Cortinarius nymphaecolor cf. - der bleiche Amethystklumpfuss
(eine Unsicherheit bleibt, daher cf., da es wohl eine sehr ähnliche Art zu geben scheint, zu der ich aber nicht viel gefunden habe: C. molochinus. Wisst ihr mehr dazu? Zudem deutet Ludwig an, dass es sich um einen Artkomplex handeln könnte)
Jedenfalls hat der wunderschöne Farben, die sich in Ihrer Zartheit kaum im Bild einfangen lassen. Der Name Nymphaecolor geht nach Ludwig auf die Farbe der Seerosen zurück, welche der Gattung Nymphaea angehören. Die Bezeichnung "nymphicolor" sei hingegen eine grundlose Korrektur nach Ludwig.

Rasche Rotfärbung mit KOH 20%

Ebenso an Basalfilz und Myzelfäden


Die wunderschönen zarten Farben auch in den Lamellen, leider kommt das hier nicht wirklich zur Geltung (im Ansatz am Lamellenansatz):

Das Velum war sehr dicht und hat Fuss und Knolle regelrecht "wattig eingepackt":

Fleisch KOH-negativ

Sporen: 9,7-10,8 µm (av. 10,3 µm, SD 0,3 µm) x 5,6-6,0 µm (av. 5,7 µm, SD 0,2 µm); Q = 1,6-1,9 (av. 1,8, SD 0,1)(n = 10)


12 Calonarius citrinus – Grünlings-Klumpfuss


Typische Farben am Stiel, im Stielfleich der Knolle dezent ins weißliche gehend, typisch auch die Farben des Myzels

Eine weitere Überraschung bot folgender Schleierling. Mit dickem Fragezeichen:
Cortinarius chailluzii cf.
In FN landet man bei Key C. Subgenus Phlegmacium und dort im Grunde bei C.cisticola. Ein wesentliches Merkmal ist nämlich, dass sich ausschließlich (!) die Knolle mit KOH (20%) rosa färbt. Alle anderen Teile zeigen keine (!) Reaktion (Fleisch, Hut, Velum auf dem Hut).
Insgesamt landet man wegen der Färbereaktion auf "bulbipellis" in FN bei calcicola. Der kann es aber nicht sein, denn der hätte wohl violette Lamellen (konnte ich nicht feststellen, wobei ich auch kein ganz jungen Fruchtkörper im Babystadium hatte) und einheitliche Farben auf dem Hut. Und zudem hätte der auch eine Reaktion auf dem Hut (rotbraun), die es hier nicht gibt. Im Aufsatz von Oertel, Stohn & Saar (2009). "Laugenreaktionen am Stielbasisfilz bei Fruchtkörpern von Cortinarius, Subgen. Phlegmacium" stößt man auf eine Auflistung weiterer Arten (teilweise nicht in FN drin), die eine solche Reaktionen zeigen, unter anderem auf C.chailluzii, der mir noch am besten zu passen scheint, nach einer ausführlichen Beschreibung von Froslev et al (2006)
Für diesen spricht die Ökologie (spannend auch die Beschreibung typischer Begleitpilze: "At the type locality we also found C. nymphicolor, [...] C. citrinus", fällt euch was auf?).
Weiter die dunklere Hutmitte gegenüber dem Rand (Unterscheidungskriterium zu cisticola im Schlüssel bei Froslev). Hier passt (fast) alles von der Detailbeschreibung, allerdings scheint auch der am Hut zu reagieren auf KOH, was mein Fund nicht tut. Es bleibt also fraglich. Alle anderen bei Froslev beschriebenen Arten kann man getrost ausschließen. Bleibt wohl ein Fall für die Sequenzierung, oder habt ihr noch eine Idee?)




KOH-Reaktion nur auf Knolle (Fleisch und Hut wie man sieht völlig reaktionslos!)

Sporenbilder Ergänzt!!! (Vor lauter lauter ist mir das gestern untergegangen):
Sporen: 9,7-10,2 µm (av. 10,0 µm, SD 0,2 µm) x 5,6-6,4 µm (av. 6,1 µm, SD 0,3 µm); Q = 1,5-1,8 (av. 1,6, SD 0,1)(n = 7)


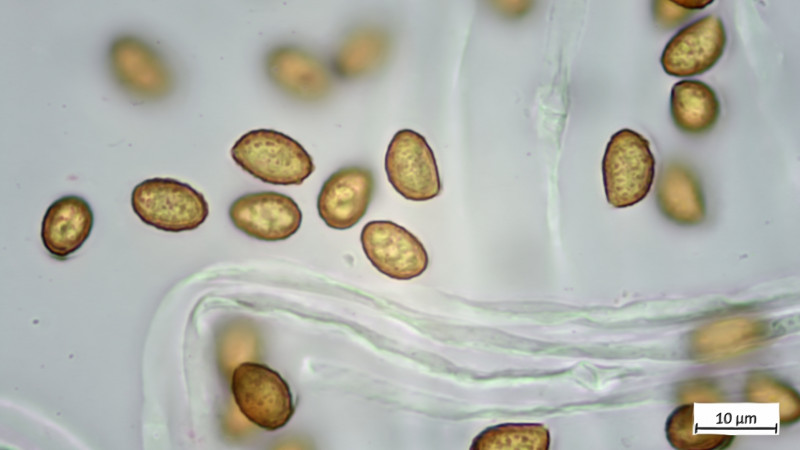
Vielleicht weiß noch jemand etwas?
Zeitlich nicht mehr geschafft habe ich bis jetzt die Auseinandersetzung mit den Schleierlingen, die wohl alle in die Sektion Vibratiles zugeordnet werden müssen.
(Dazu gibt es wohl eine Arbeit - s. Link, die ich mir erst noch zu Gemüte führen muss). Mal sehen, ob ich die Zeit finde.
14 Cortinarius vibratilis s.l. – Galliger Schleimfuss gehören (sämtliche Arten mit schwer bitterem Hut, daran Lecken war völlig ausreichend)
14a


14b (ebenfalls unfassbar bitter bei anlecken)



Es gab noch weitere Funde aus anderen Gattungen:
Erstfund für mich und aufgrund der Ökologie und der nahezu genattert wirkenden schwarzgrauen Faserschüppchen bestimmt als:
15 Tricholoma bresadolanum - der bittere Buchenritterling

16 Hygrophorus nemoreus - der Waldschneckling (mit kräftigem Mehlgeschmack):


17 Craterellus melanoxerus - der schwärzende Pfifferling

Es gab auch noch Röhrlinge, hier mal zwei noch frischere Arten, die einfach wunderschön daherkamen:
18 Leccinum quercinum, die man wohl jetzt Leccinum aurantiacum nennen muss - Laubwaldrotkappe

19 Lecinellum crocipodium - der gelbe Raufuß

So, nun soll es aber auch genügen. Ich habe wieder viel entdecken und lernen können. Freue mich über eure ggf. weiterführenden Hinweise. Gerne auch von den Cortinariusspezialisten. Mykollege_Günter Cortinarius ... Würde mich sehr freuen
LG Sebastian


