Ihr Lieben,
ich habe vor ein paar Tagen in einer Art Heidelandschaft mit frei laufenden Pferden und Rindern Pilze gefunden, die ich mir vorgenommen habe zu bestimmen. Die Bestimmung fiel mir aber recht schwer. Am Ende habe ich 6 verschiedene Bücher verwendet, bin aber immer wieder zum selben Ergebnis gekommen. Schonmal vorab: Keine Angst, ich möchte sie nicht konsumieren, sondern mich nur in der Bestimmung von LBMs üben 😄
Makroskopisch (leider nur Handy)





Sie waren sowohl am Hut als auch am Stiel recht klebrig. Die Huthaut ließ sich vollständig abziehen. Sie hatten eine ähnliche gummiartige Konsistenz wie beim dehnbaren Helmling. Geruch unbedeutend. Am Stiel waren sie teils weißlich überfasert. Ich meine an manchen Stellen minimal eine Blaufärbung zu erkennen.
Mikro:
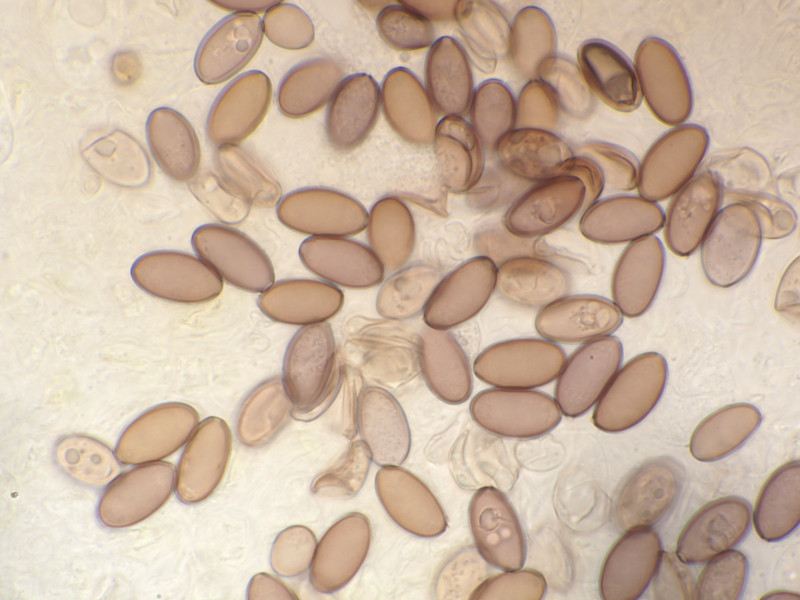
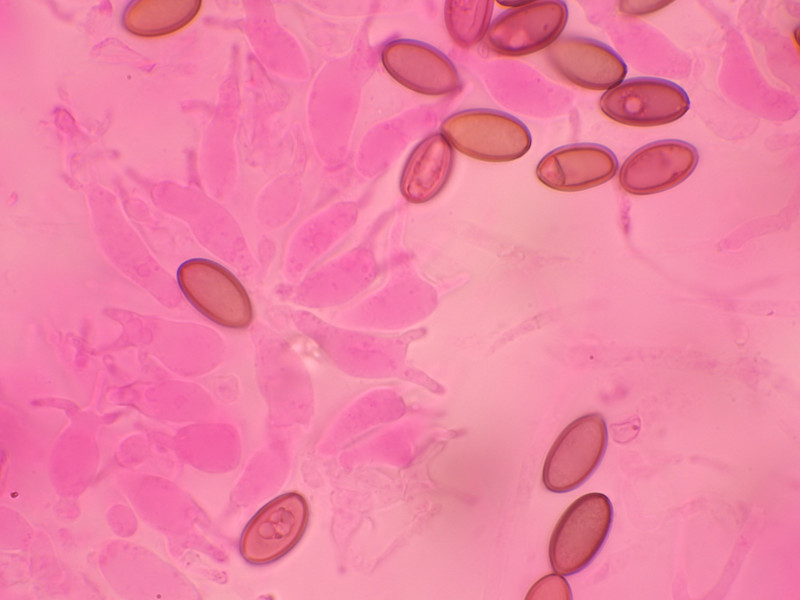
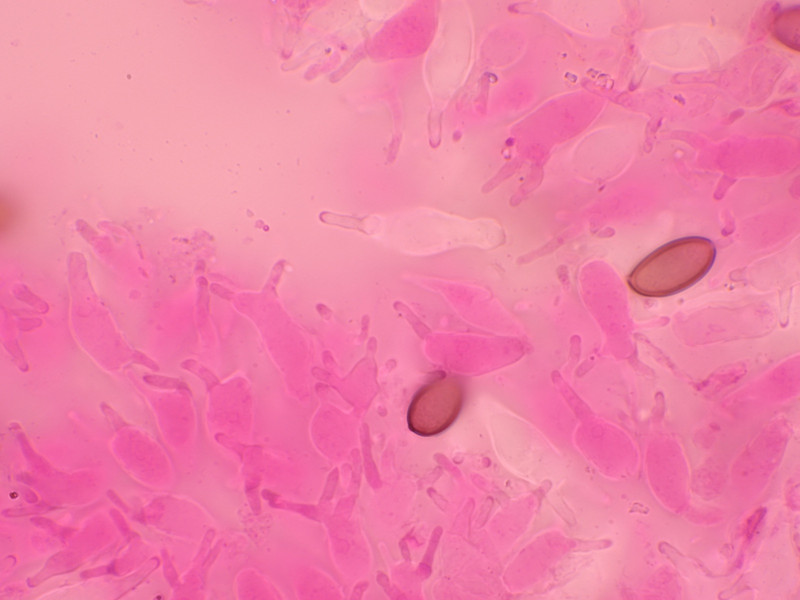
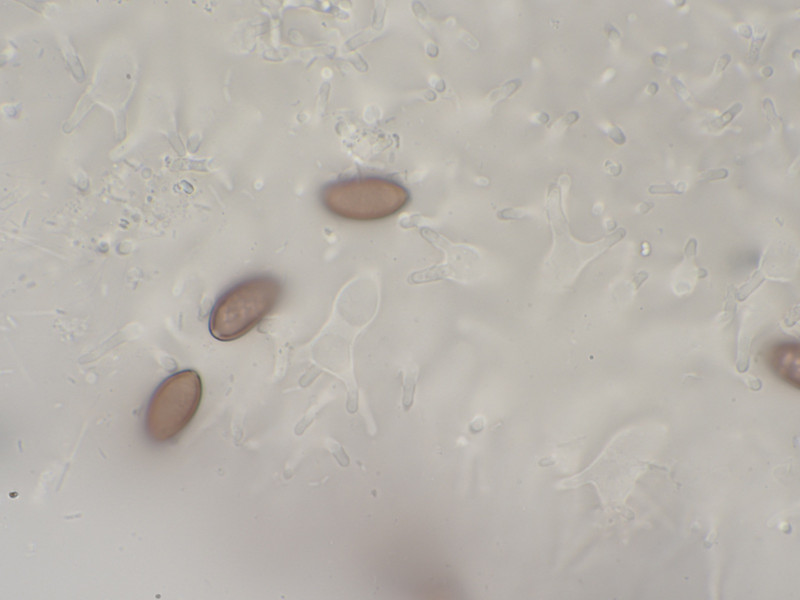
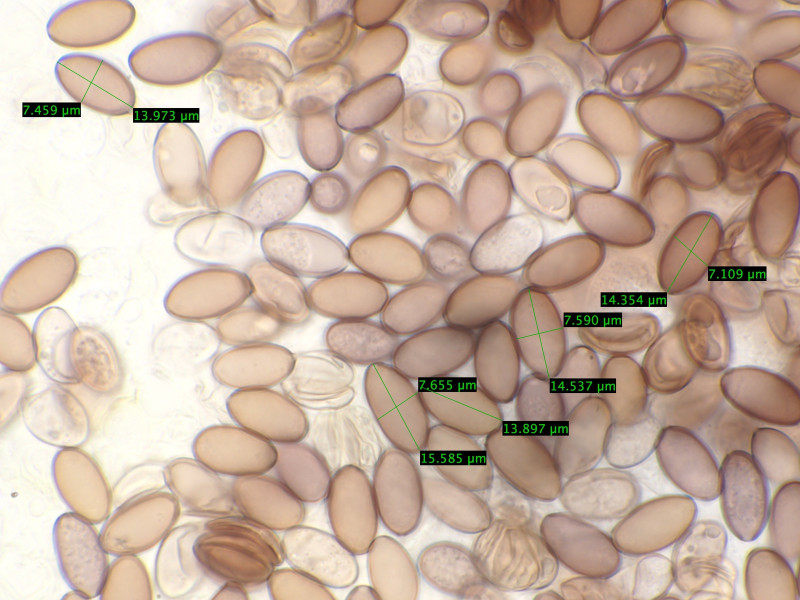
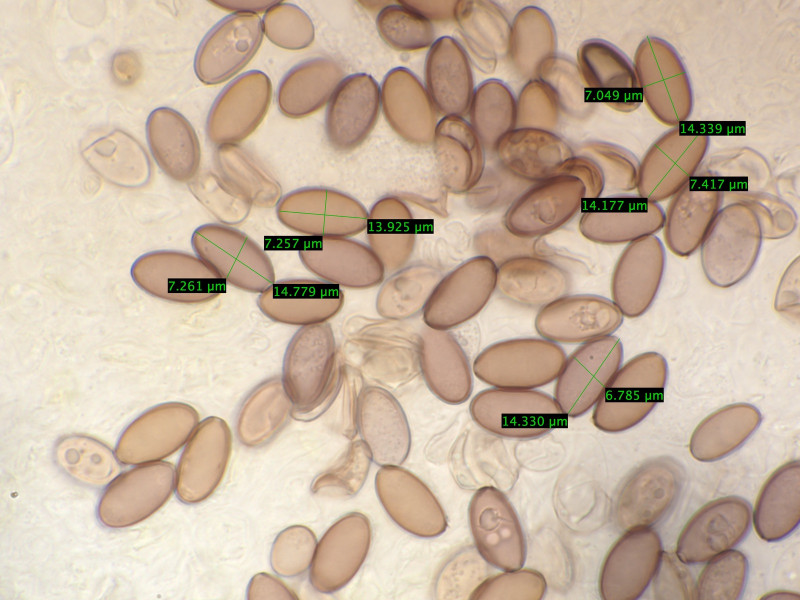
Sporen 13,9 - 15,5 Mikrometer lang und 6,9-7,4 breit.
Cheilozystiden mehrheitlich gegabelt. Keine Pleurozystiden vorhanden.
Der mistliebende Kahlkopf (Deconica coprophila) kann es nicht sein, weil er eckige Sporen und nicht gegabelte Cheilozystiden hätte. Siehe Bild aus Ludwig Band 1:
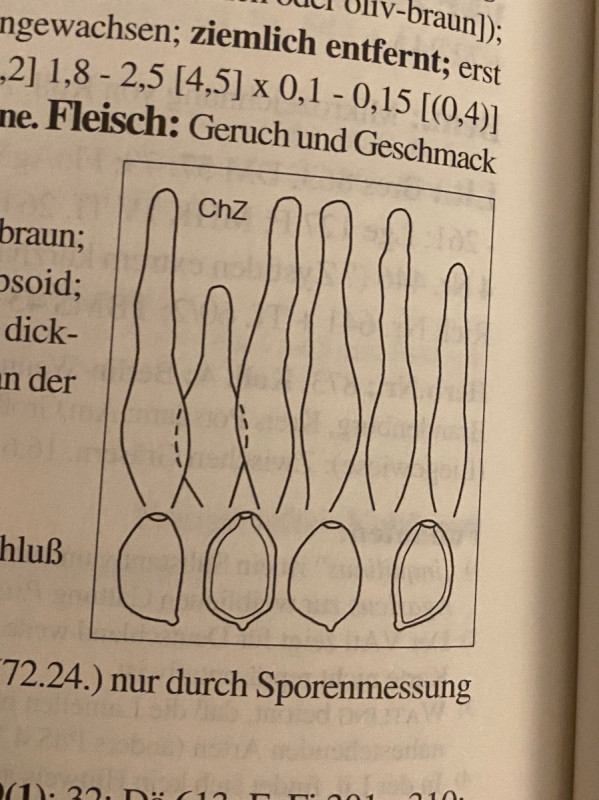
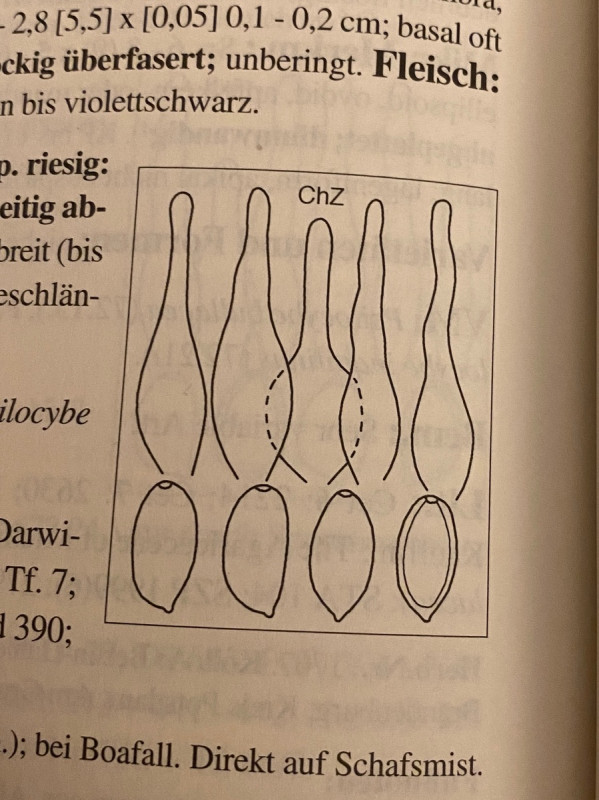
Deconica subcoprophila passt nicht, weil die Cheilozystiden auch nicht gegabelt sind und weil die Sporen bis zu 20 (22) Mikrometer lang sein sollen. Ich habe sehr viele Sporen gemessen und alle waren um 14 Mikrometer.
Hier auch ein Bild aus dem Ludwig:
Nachdem ich 6 verschiedene Bücher durchgeschaut habe, kann es eigentlich nur Psilocybe semilanceata (spitzkegeliger Kahlkopf) sein. Der scheint mir der einzige mit derlei Zystiden zu sein und die Sporenmaße passen auch. Wieder Ludwig:
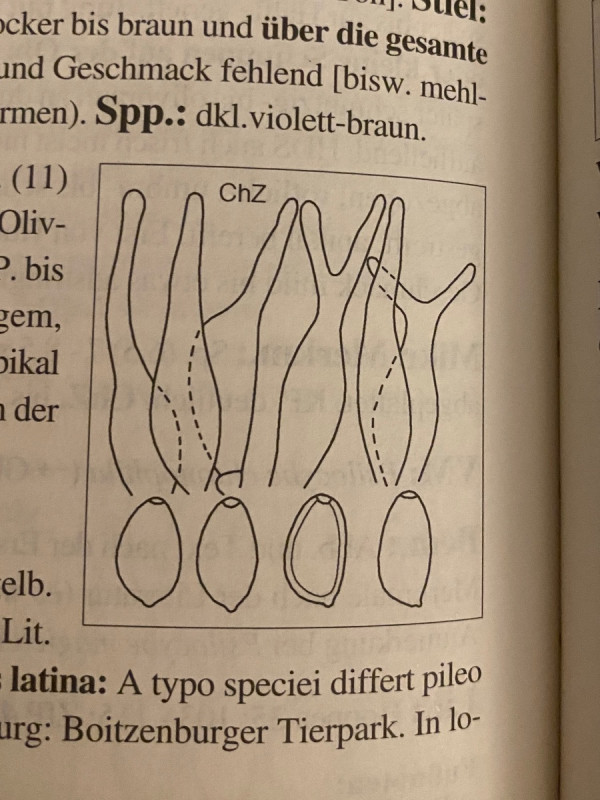
Was aber überhaupt nicht passt ist die Hutform, die ja überhaupt nicht spitzkegelig/glockig ist und direkt auf Dung soll er ja eigentlich auch nicht wachsen, wohl aber auf Viehweiden.
Laut Ludwig kann er selten auch mal ungebuckelt sein.
Was meint ihr?
Lg
Sandra


