Hallo zusammen
Es ist ein perfekter Pilzherbst, man kommt kaum nach. Aber schaut selber.
Zunächst ein paar Sachen aus dem Wald, Pinus silvestris, mit eingestreuten Fichten und Birken.
1:

Calocybe obscurissima, die ich im ersten Moment für eine Melanoleuca hielt.
2:

Kleine, hygrophane Trichterlinge ohne speziellen Geruch sind kaum bestimmbar. Hier kam ich ohne Gewähr auf Clitocybe metachroides.
Auf der Seite von Matthias ist eine ganz ähnliche Kollektion abgebildet.
Sporen wenig aussagekräftig.
HDS eine Ixokutis mit deutlichen Inkrustationen.
3:

Nichts besonderes, aber sieht schön aus: Cortinarius atrovirens.
4:

Hygrophorus discoideus
5:

Lentinellus flabelliformis an einem liegenden Baumstamm.
6:

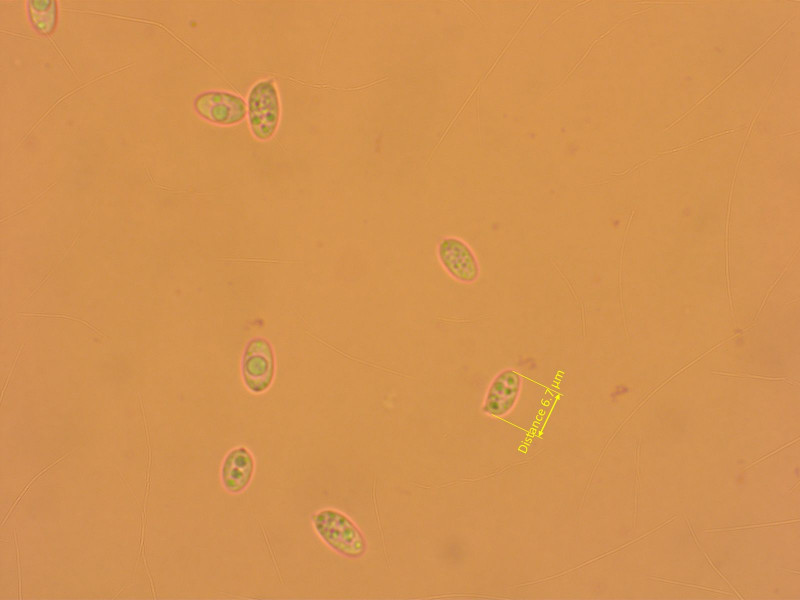
Galerina graminea erkennt man mikroskopisch gut an den überall vorhandenen, kopfigen Zystiden, und den nicht dextrinoiden Sporen.
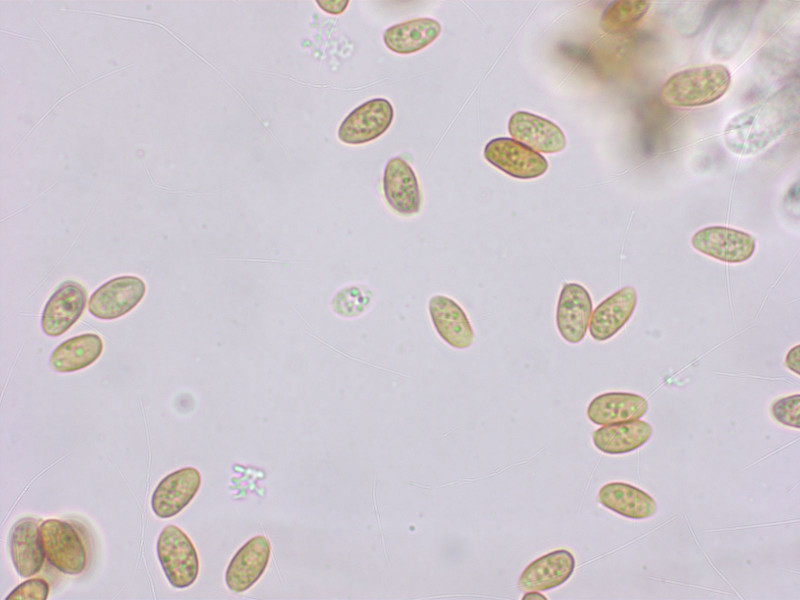
Sporen fast glatt.
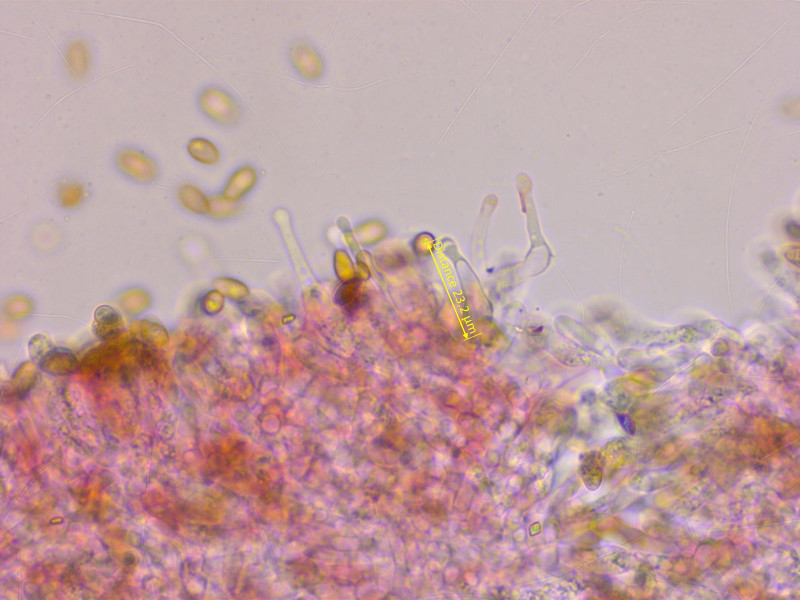
Cheilozystiden kopfig

Pileozystiden genauso

Und die Kaulozystiden auch.
7:

Tephrocybe rancida erkennt man schon im Feld an den grauen Farben und dem Geruch.
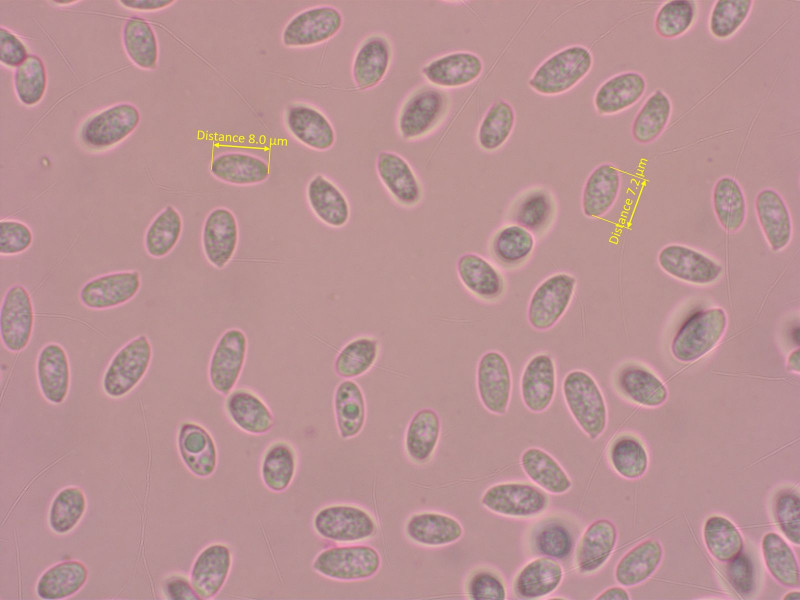
Sporen subzylindrisch
Und hier mal eine richtig starke siderophile Granulation.
8:

Tricholomopsis sulfureoides von einem bereits bekannten Standort.
9:

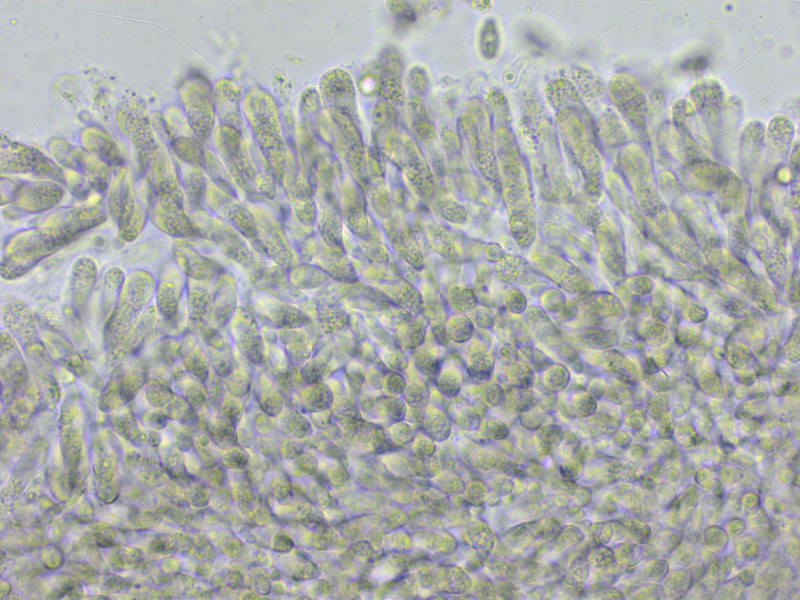
Eine kleine Tephrocybe, die gattungstypisch zu nichts passen will. Einzig die aus Italien beschriebene Tephrocybe substriipilea stimmt gut überein.
Ich lasse sie mal sequenzieren, bringt aber vermutlich nicht viel.
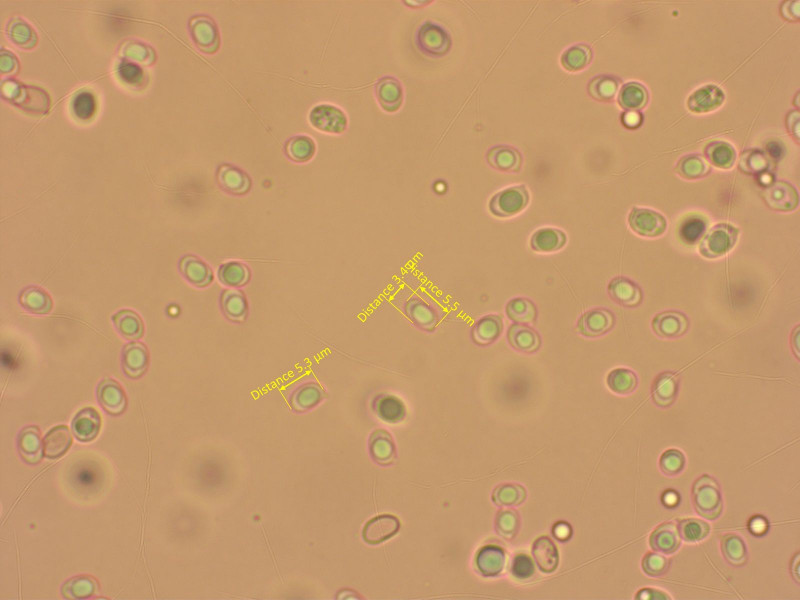
Sporen recht klein für die Gattung.
HDS eine dicke Ixokutis.
10: Ein Risspilz für Ditte

Die wuchsen in einem reinen Kiefernbestand auf Kalk - allerdings gab es in etwa 15 Meter Entfernung auch Birken.
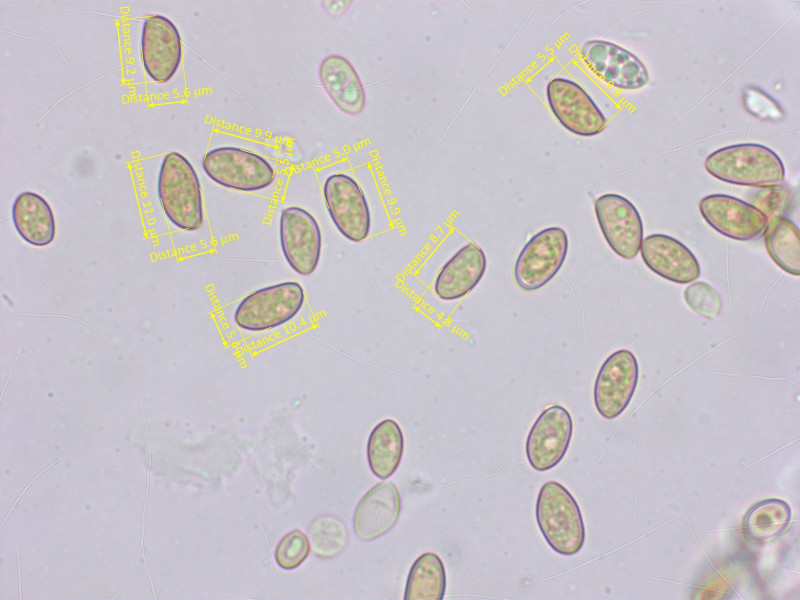
Sporen: 8.5-9.7-11.0 x 4.6-5.4-6.0 µm, Q = 1.64-1.81-1.98 (n=20)

Cheilo- und Pleurozystiden: 43-55-66 x 12-14-18 µm (n=10)

Kaulozystiden nur oben, dort sehr zahlreich.
Mit den verfügbaren Schlüsseln lande ich immer irgendwie bei Inocybe auricoma, die aber ein nomen dubium ist wenn ich das richtig im Kopf habe.
Dann noch ein paar Sachen aus dem Offenland (Magerwiese und Trockenrasen):
11:

Entoloma incanum (Sporen gemessen, es ist nicht E. verae)
12:

Lepiota farinolens hatte ich vor zwei Jahren am gleichen Standort (mit Sequenz bestätigt). Hier ist aber den Ring schon abgefallen.
Typisch ist der feinschuppige Hut und die für Lepiota auffallend breiten, bauchigen Lamellen. Der namensgebende Mehlgeruch ist nur undeutlich.
Mikrobilder hier: Pfynwald im Spätherbst
13:

Rhodocybe/Clitocella/Lulesia fallax scheint recht selten zu sein, hat mir auf jeden Fall grosse Freude gemacht.
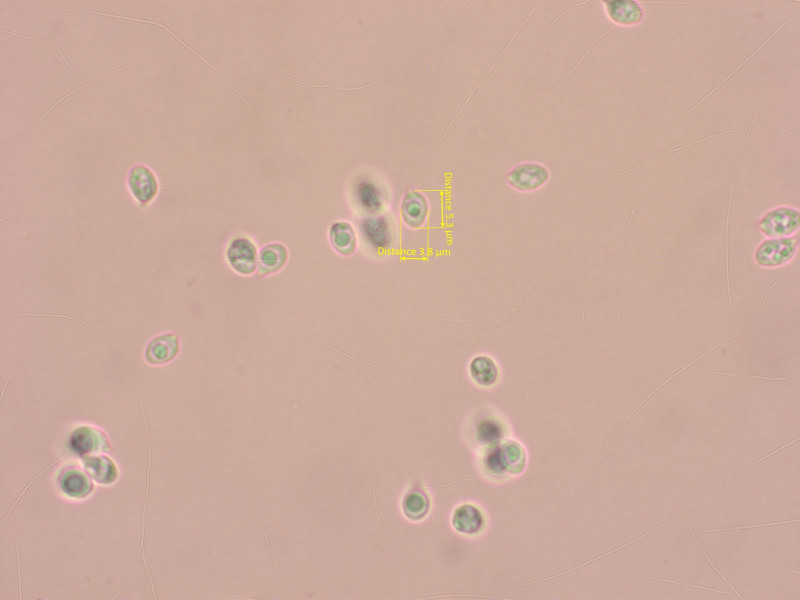
Die Sporen sind nur angedeutet eckig oder haben vereinzelte Pusteln.
14:

Rhodocybe/Clitocella/Lulesia popinalis
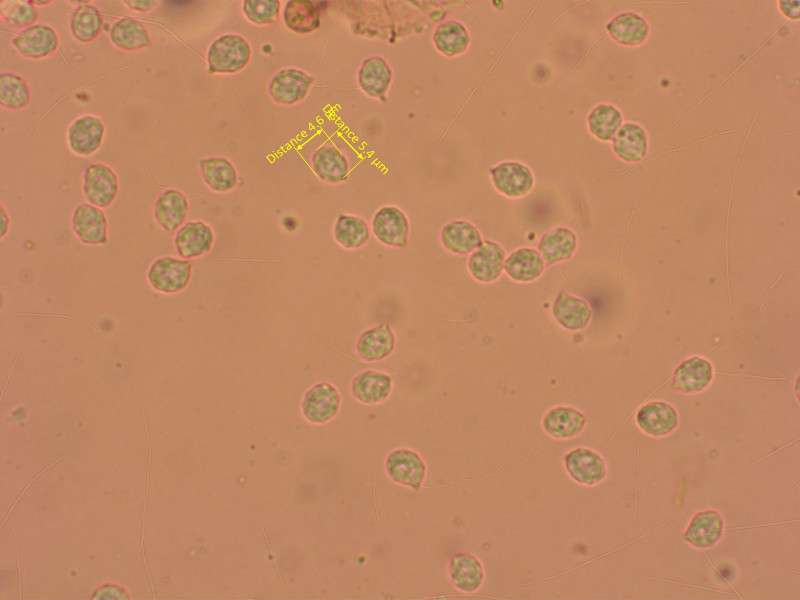
Hier sind die Sporen sehr deutlich höckerig, womit man ihn klar von mundula unterscheiden kann.
15:

Psathyrella magnispora. Auch hier der gleiche Standort, von dem ich schon eine sequenzierte Kollektion habe.
Hier mit Mikrobildern: Pfynwald im Spätherbst
16:

Ein unbestimmbarer Rätselpilz aus der Gattung Rhodophana.
Makroskopisch würde gut "Rhodocybe" cuprea passen, aber diese hier riechen stark nach Mehl und haben viel kleinere Sporen.
Rh. nitellina und Rh. melleopallens können auch recht dunkel sein, aber haben viel grössere, gestrecktere Sporen.
Es gibt noch eine kürzlich beschriebene Rhodophana corylina mit so kleinen Sporen, die hat aber völlig andere Farben.
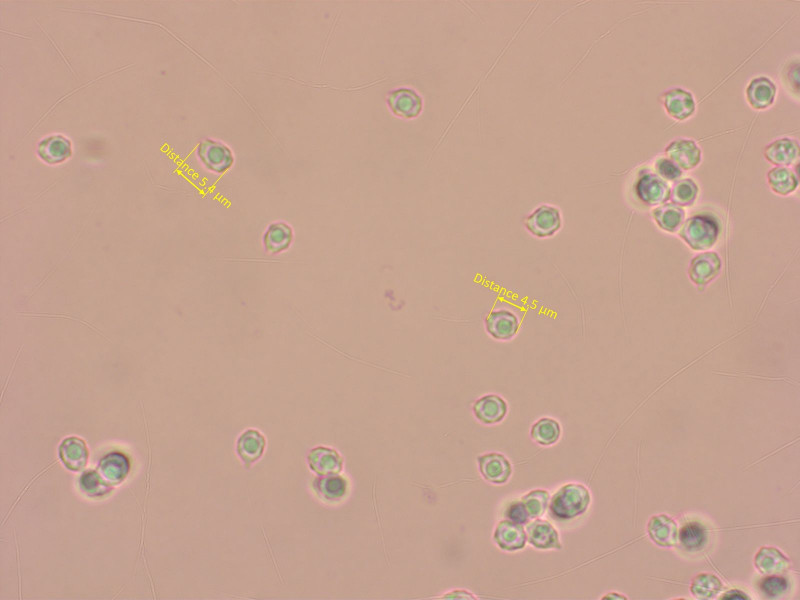
Sporen stark höckerig, breit elliptisch und nur bis 5.5 µm lang. Schnallen vorhanden, keine Cheilozystiden.
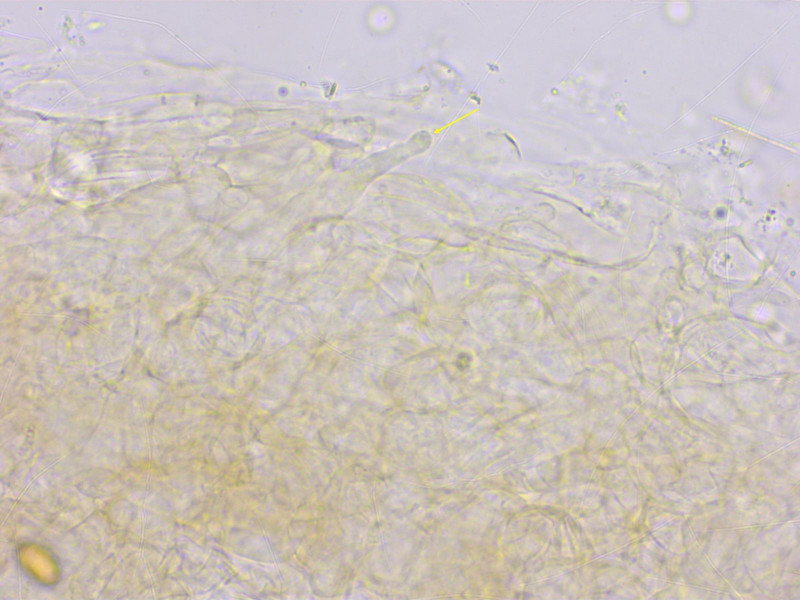
HDS eine ziemlich wirre Kutis, eigenartigerweise mit kopfigen, zystidoiden Elementen (in mehreren Präparaten zuverlässig zu finden).
Ich habe ja eigentlich die Original-Beschreibung aller europäischen Rhodocybe Arten (s.l.), aber keine davon passt.
Vielleicht hat jemand eine Idee?
LG Raphael


