Hallo zusammen
Hier nun der Rest, nachdem ich gestern bei einigen sehr netten Mykologen an der JEC-Tagung hängenblieb.
Ditte, Hias, Günter, Uwe und all die anderen, es war eine Freude euch zu treffen!
Aber zurück zum Thema:
Einen Tag sind wir schnell über die Grenze ins Elsass gefahren, mit erstaunlichem Erfolg.
Wir waren am Bollenberg, ein Trockenrasen der für seine Pilzflora bekannt ist.
5:

Entoloma chalybaeum, von dem ich euch jetzt die Mikros erspare.
6:

Hier, naja, am ehesten passt Entoloma majusculum. Aber daran glaube ich selber nicht wirklich.
Nach FE5a wäre es wohl E. longistriatum var. microsporum gewesen, der Name wird im neuen Buch gar nicht erwähnt.
Vielleicht hat jemand einen besseren Vorschlag?
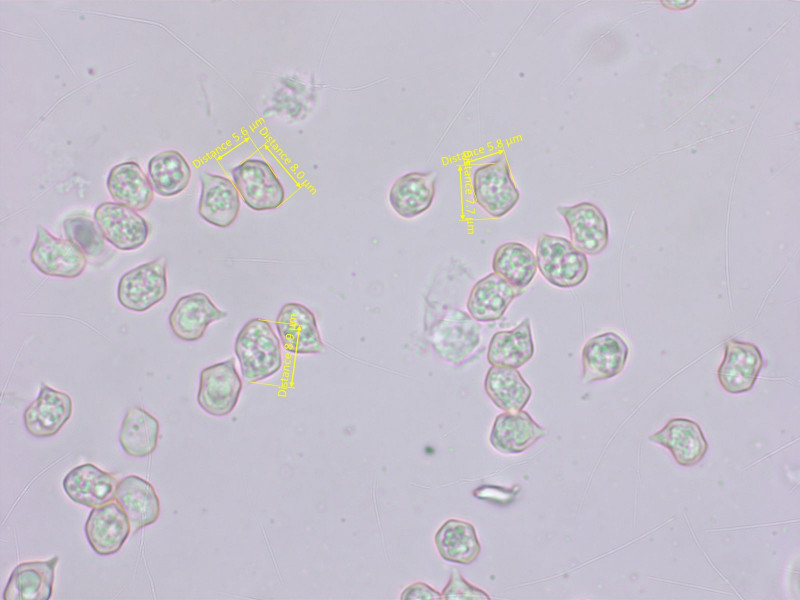
Die Sporen sind eigentlich zu klein für E. majusculum.
Die Lamellenschneide ist heterogen mit keuligen Zystiden.
7:

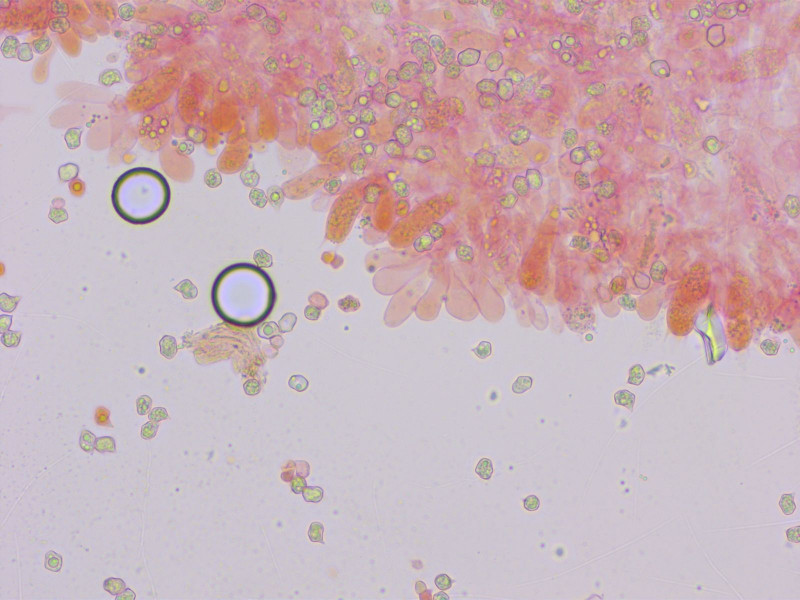
Entoloma undatum
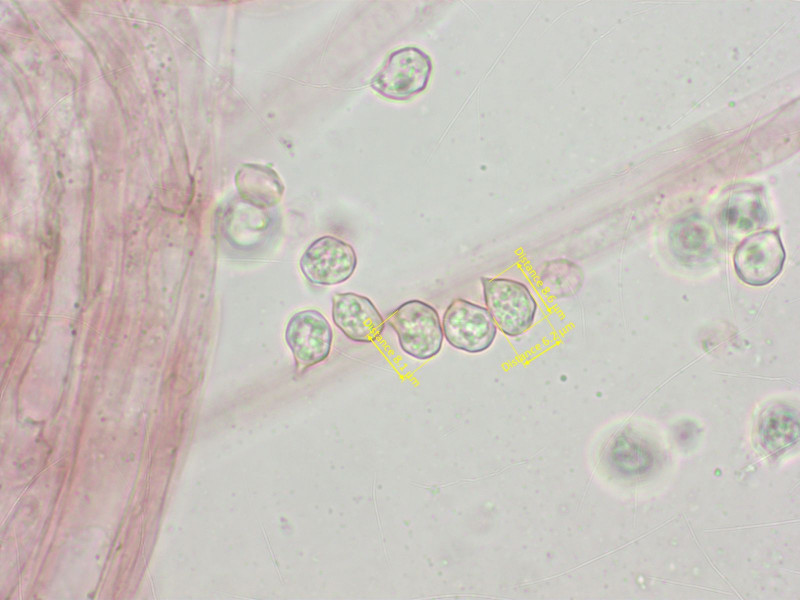
Sporen klein, wenig eckig, subisodiametrisch. Keine Zystiden, Schnallen vorhanden.
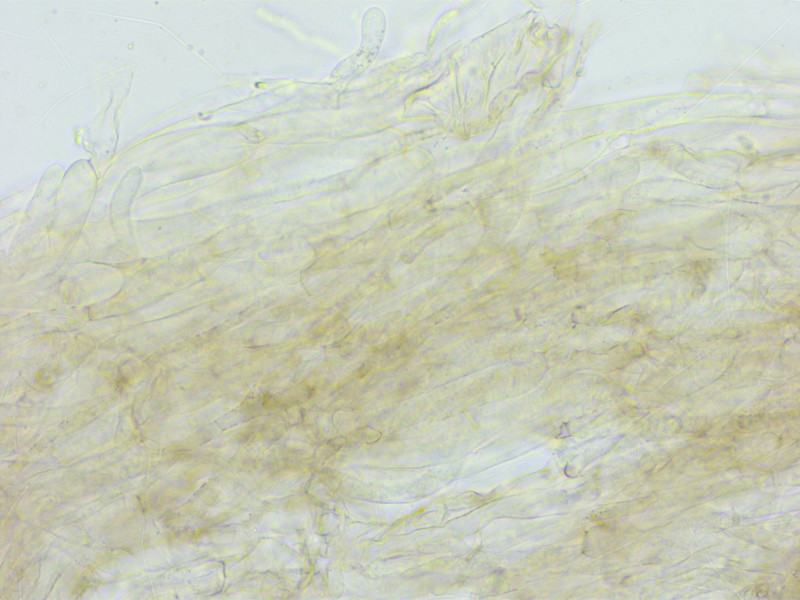
HDS aus recht breiten Hyphen, stellenweise inkrustiert.
8:

Ein Rübling mit Kohlgestank. Ich nahm ihn mit, weil mich die Farben irgendwie stutzig machten.
Nach der Monographie komme ich auf Gymnopus graveolens.
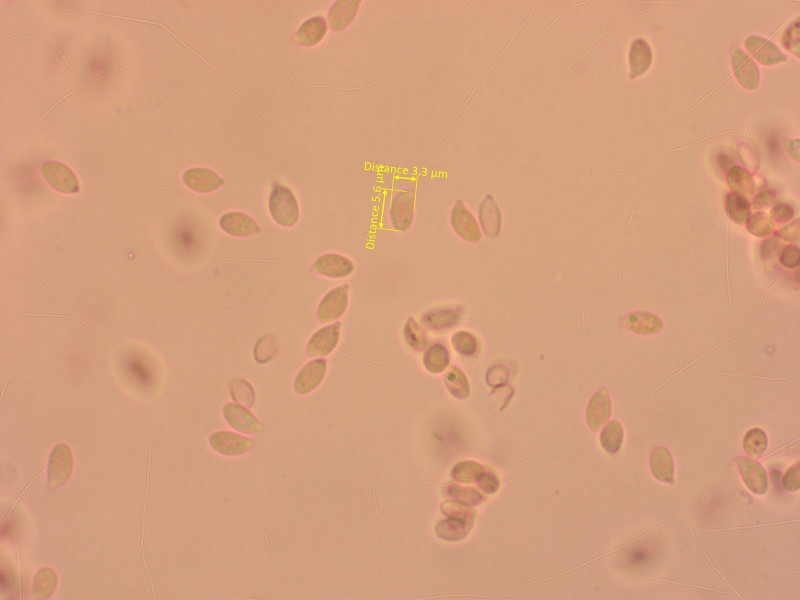
Sporen wie bei den meisten Rüblingen nichtssagend.
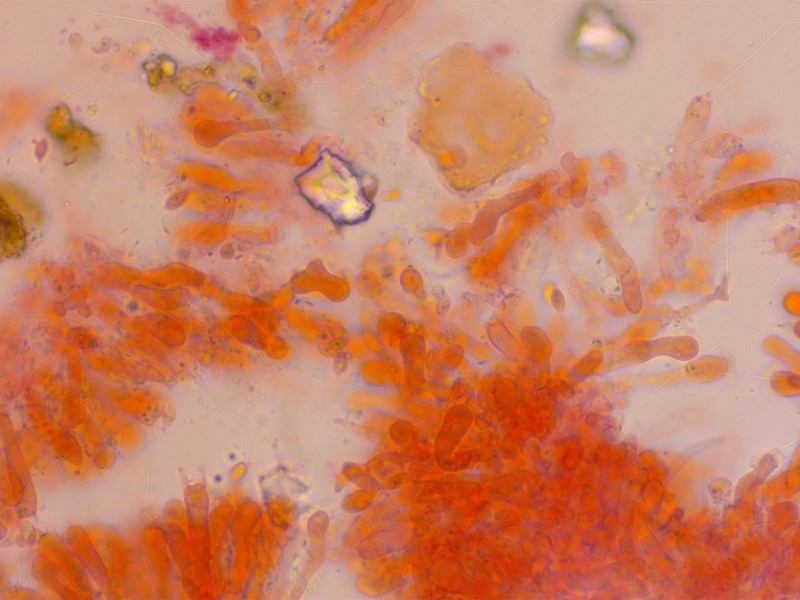
Zystiden spärlich, etwas unförmig
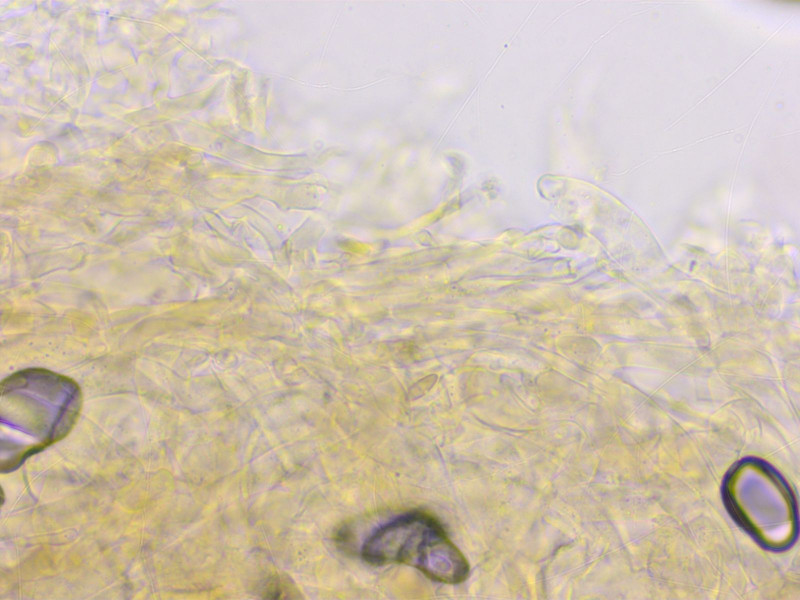
HDS verworren, stellenweise etwas inkrustiert.
9:

Lepiota oreadiformis gab es zu Hunderten.
10:

Eine kleine Psathyrella, die mich viel Zeit gekostet hat. Schlussendlich halte ich es für Psathyrella calcarea.
Vielleicht hat Matthias eine Meinung dazu?
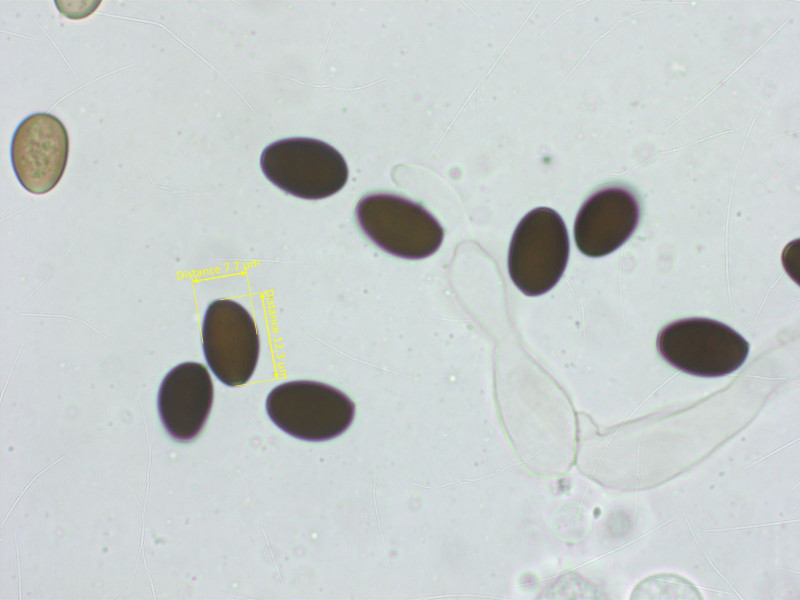
Sporen recht gross und breit für eine Psathyrella.
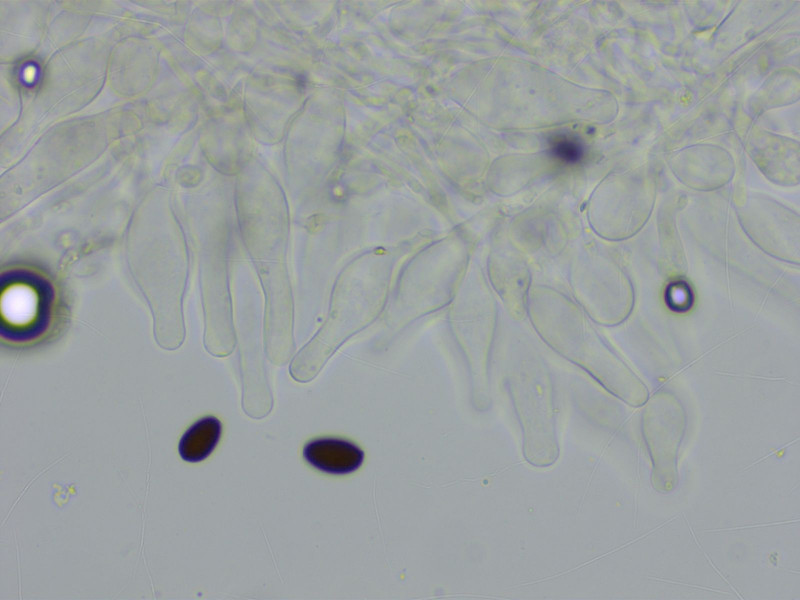
Cheilozystiden meist lageniform.
Pleurozystiden spärlich, ebenso.
11:

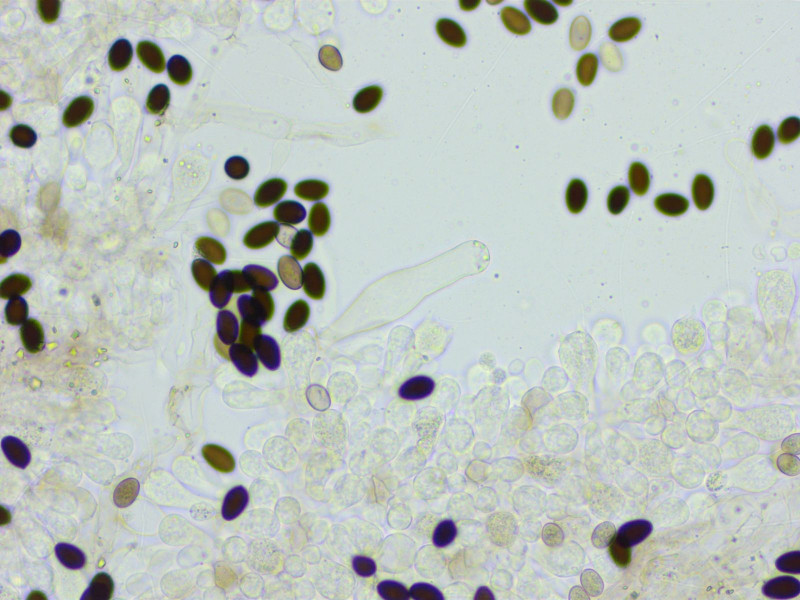
Spodocybe herbarum wuchs in Unmengen überall.
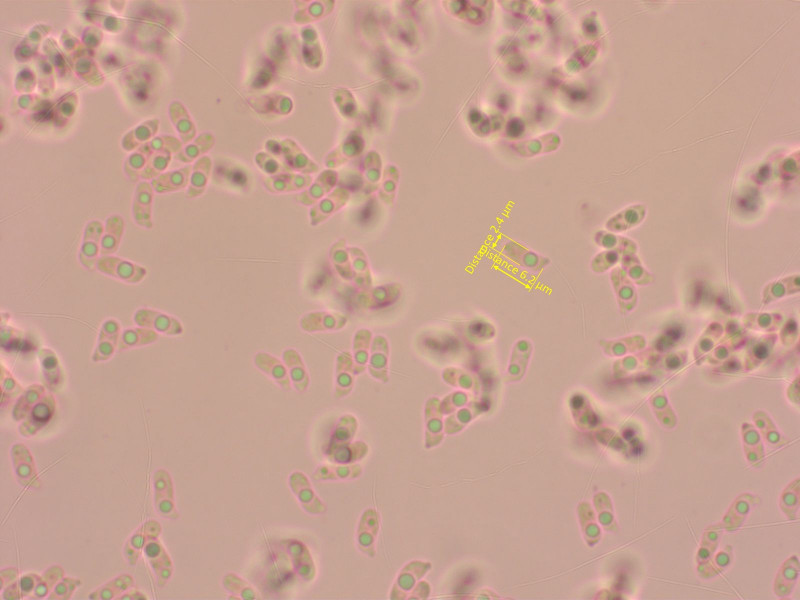
Diese Art zeichnet sich durch sehr schlanke, zylindrische Sporen aus.
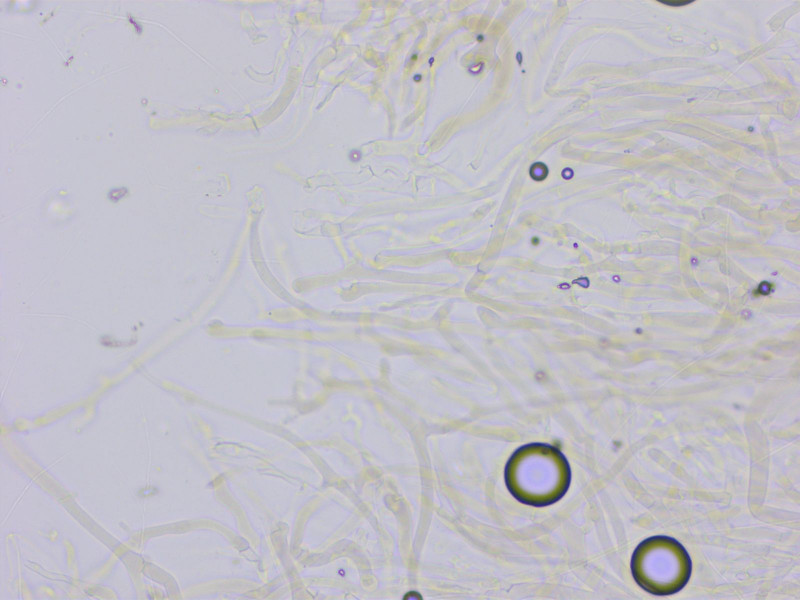
Die HDS ist eine locker verwobene Schicht aus bräunlichen Hyphen.
12:

Das ist jetzt richtig knifflig und wird wohl nur einen provisorischen Namen bekommen.
Es gehört natürlich auch zu diesen grauen Trockenrasen-Trichterlingen.
Aber da wurden in der Literatur mindestens zwei Arten vermischt. Das hier würde zu Clitocybe senilis ss. Angeli (2008) passen.
Der Geruch schwankte zwischen stark mehlig und blausäureartig, schwer definierbar.
Damit würde man an Spodocybe cyanolens denken, aber die hat eine andere HDS-Struktur.
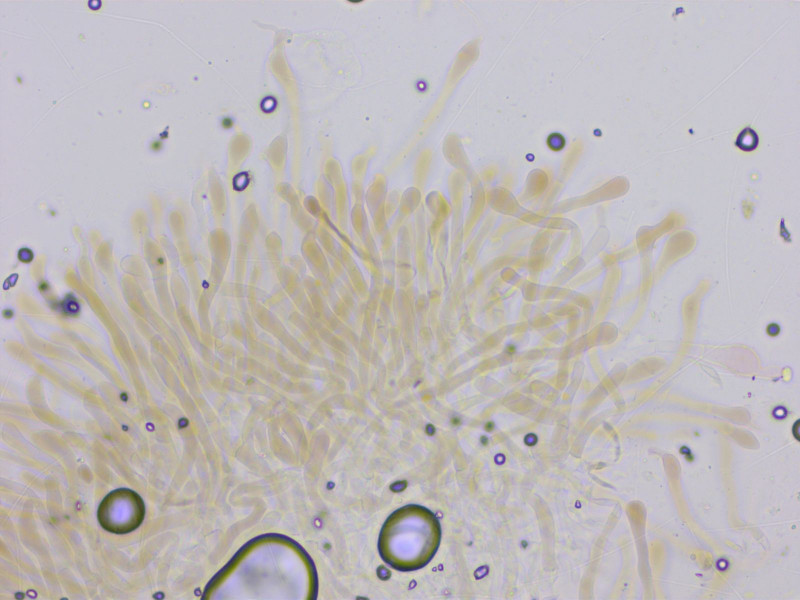
Die HDS ist trichodermal aus keuligen Zellen, eigentlich sehr ungewöhnlich für einen Trichterling.
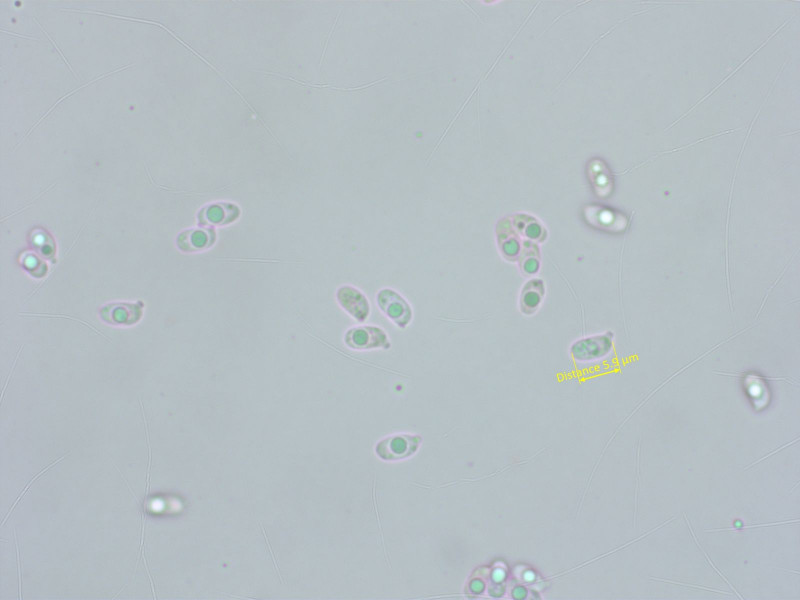
Die Sporen sind wenig auffällig.
So, genug vom Bollenberg. Ein paar Sachen aus einem Eichenhain:
13:

Clavuliopsis trigonospora gab es in grossen Mengen.
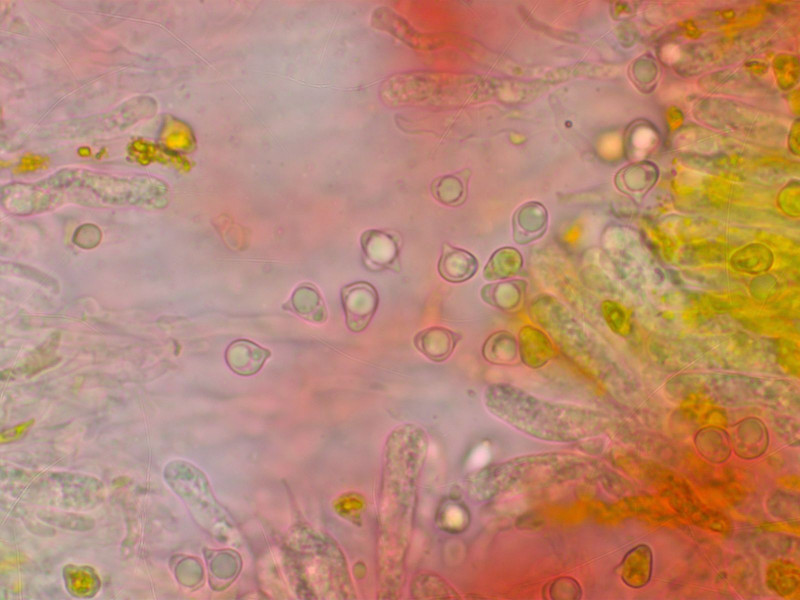
Viele Sporen sind richtig dreieckig, daher der Name.
14:

Inosperma bongardii
15:

Pholiotina brunnea
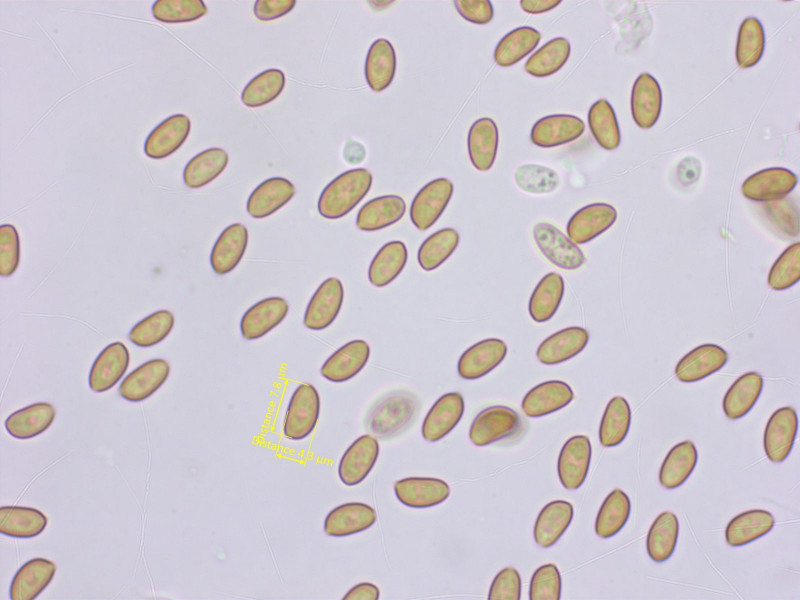
Sporen recht klein
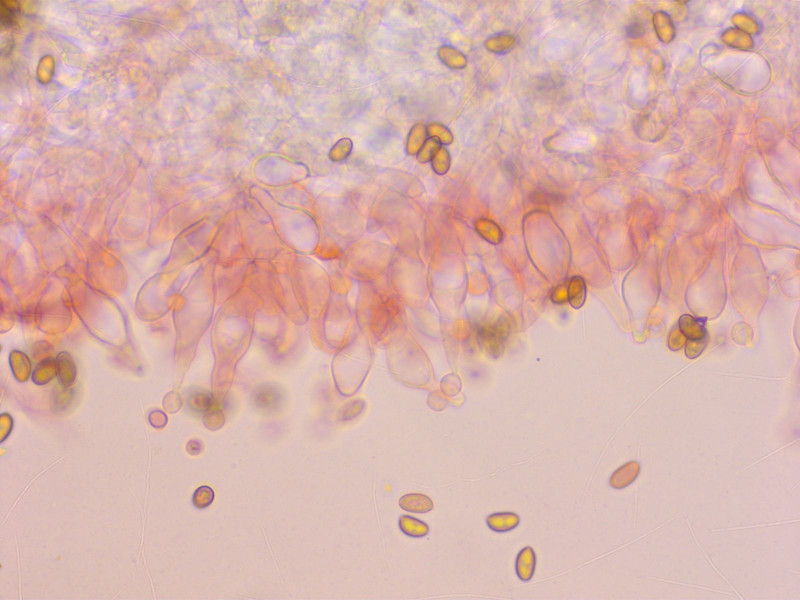
Zystiden arttypisch lecythiform. Aber grösser als bei jeder Conocybe die ich kenne.
Ph. brunnea ist die einzige Pholiotina mit solchen Zystiden.
16:

Endlich mal eine schöne Gruppe Dachpilz, oft findet man nur einen oder zwei. Das ist ist Pluteus nanus.
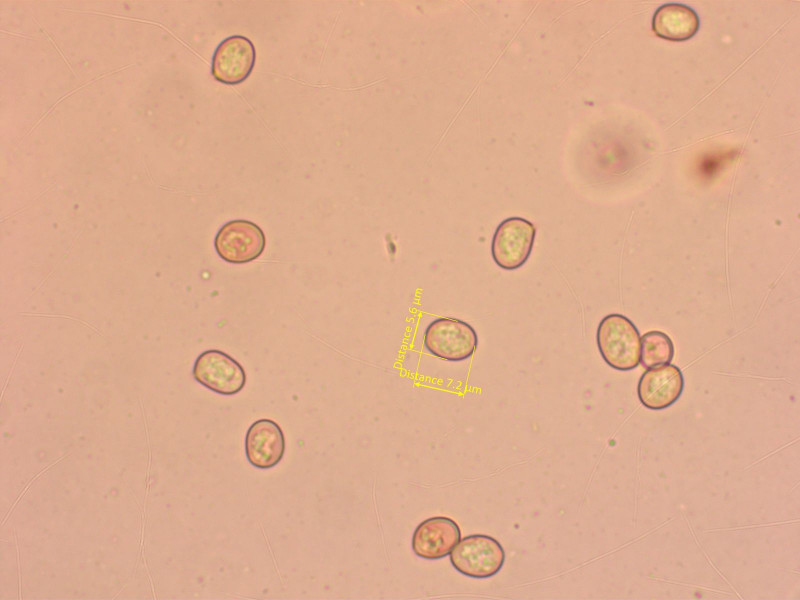
Sporen so wie sie halt bei Dachpilzen sind.
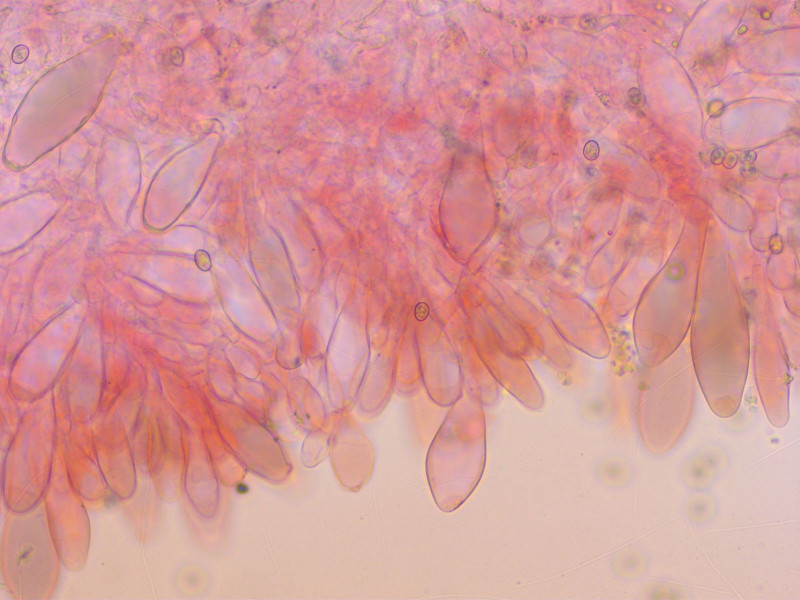
Cheilozystiden
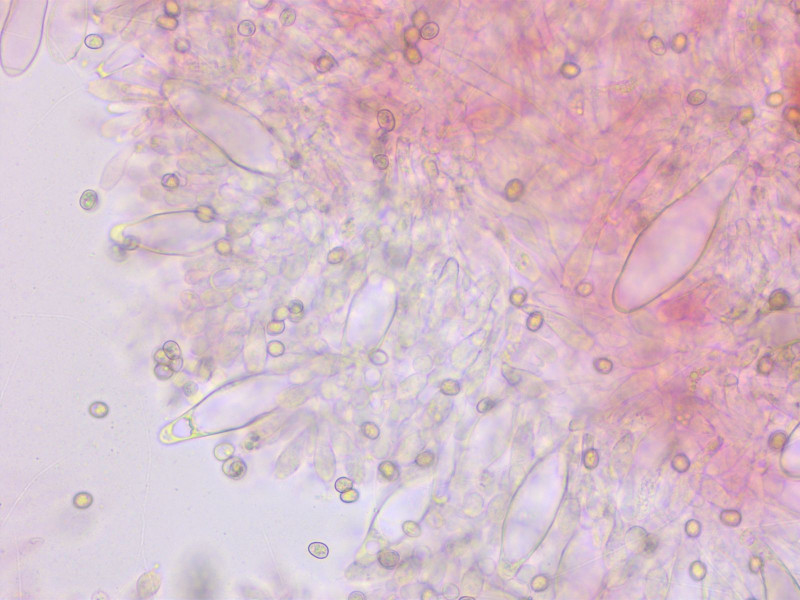
Pleurozystiden
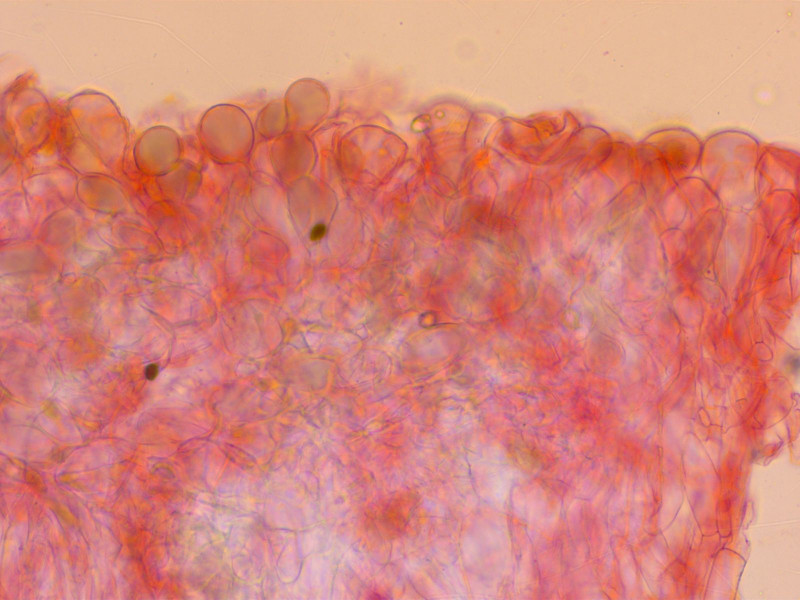
HDS recht locker hymeniform, weshalb der Hut glänzt wenn man darüber streicht.
Zurück in der Heimat, ging es am Sonntag in den Pfynwald.
Dort wurde ich regelrecht von einer Pilzfülle erschlagen, ich konnte längst nicht alles anschauen.
17:

Cortinarius depressus, zumindest nach Funga Nordica.
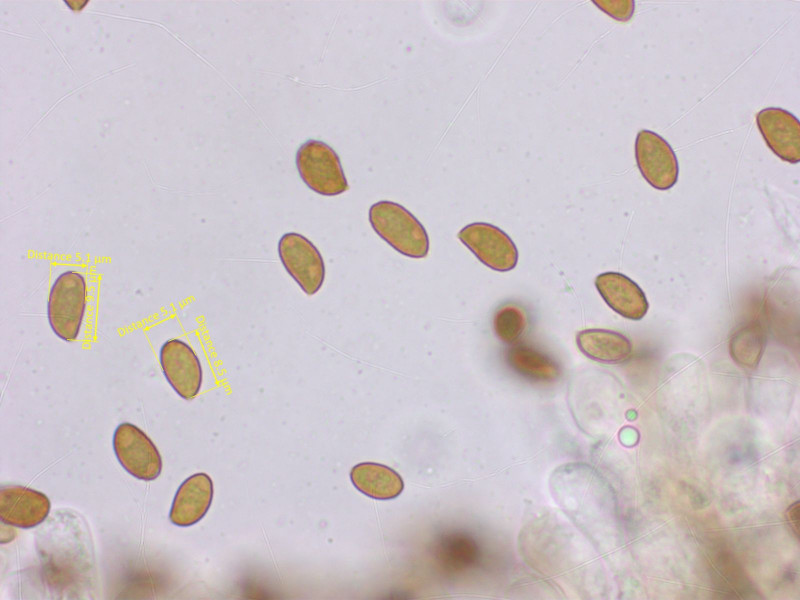
Sporen moderat warzig
18:

Entoloma leptopus hatte ich vor zwei Jahren schon einmal am gleichen Standort.
19:

Ich habe noch nie so viele kleine Schirmlinge gefunden wie dieses Jahr. Hier kam ich auf Lepiota echinella.
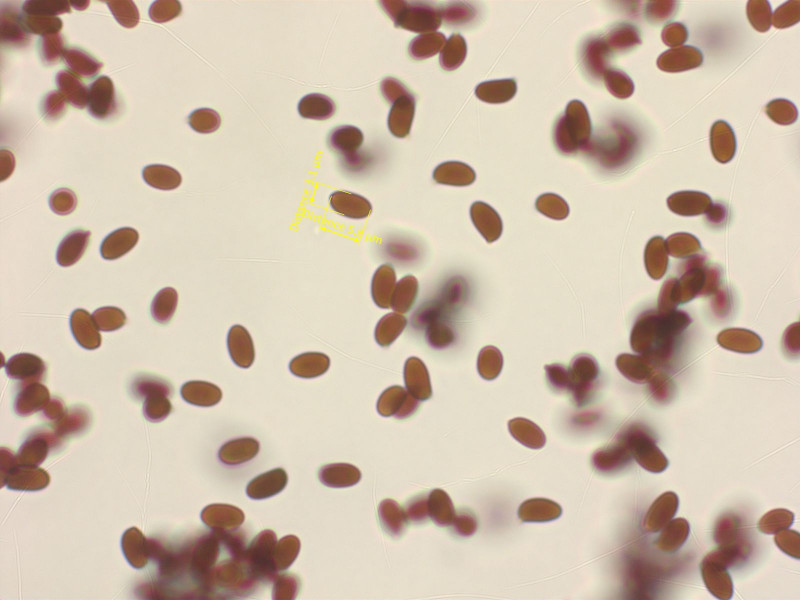
Sporen winzig, elliptisch
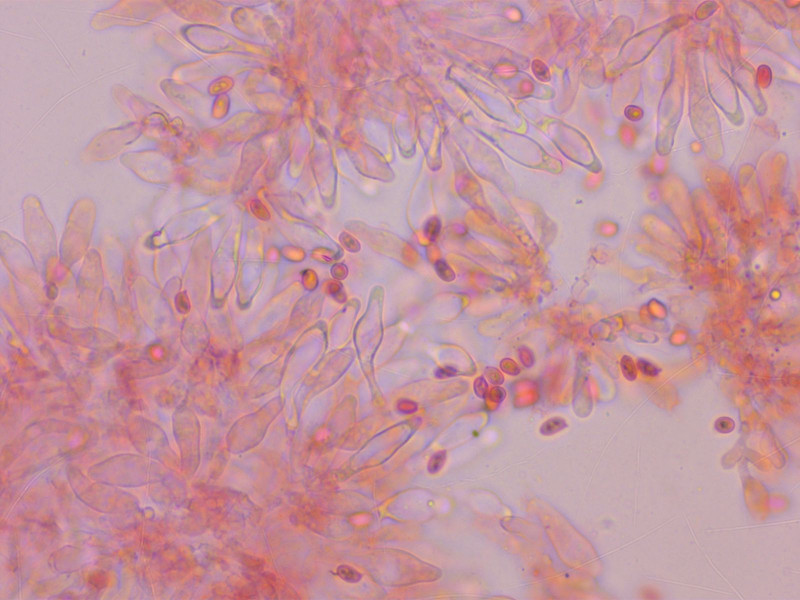
Zystiden fusiform
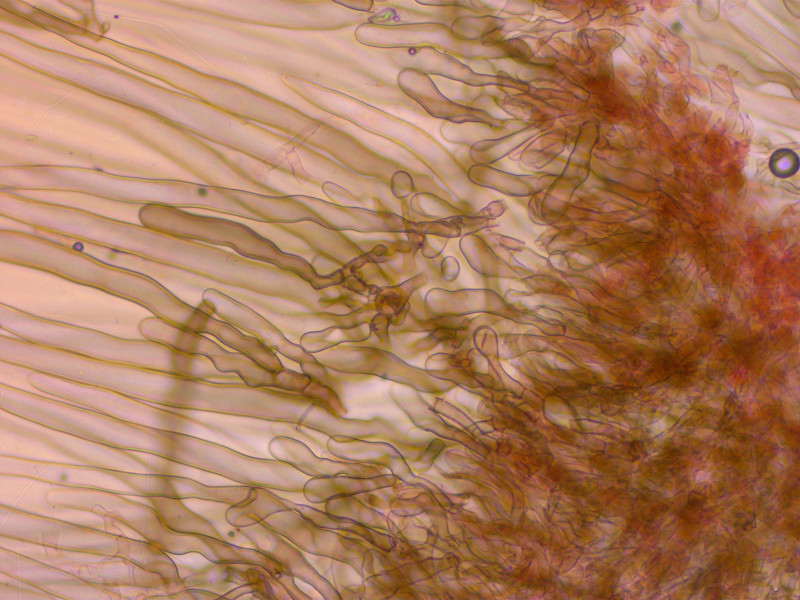
HDS mit sehr langen Haaren und hymeniformer Unterschicht.
20:

Die hier erkennt man an dem braun gesäumten Ring, Lepiota pseudolilacea.
21:

Mallocybe fuscomarginata - denke ich zumindest.
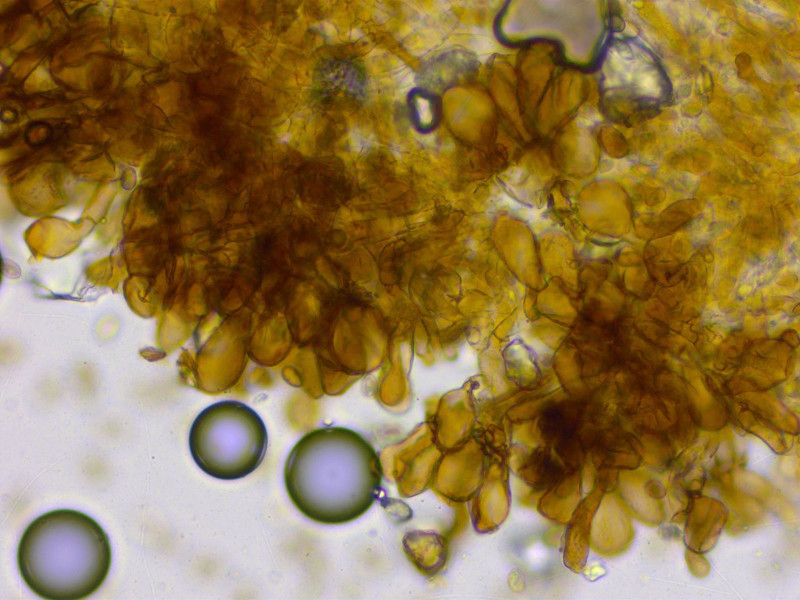
Typisch sind diese braunen Zystiden.
Ich bin noch nicht dazu gekommen, die Sporen richtig zu messen.
22:

Ein hübscher Weichritterling, den ich als Melanoleuca brachyspora bestimmt habe.

Eminent wichtig: Das Fleisch ist nur in der Basis braun.
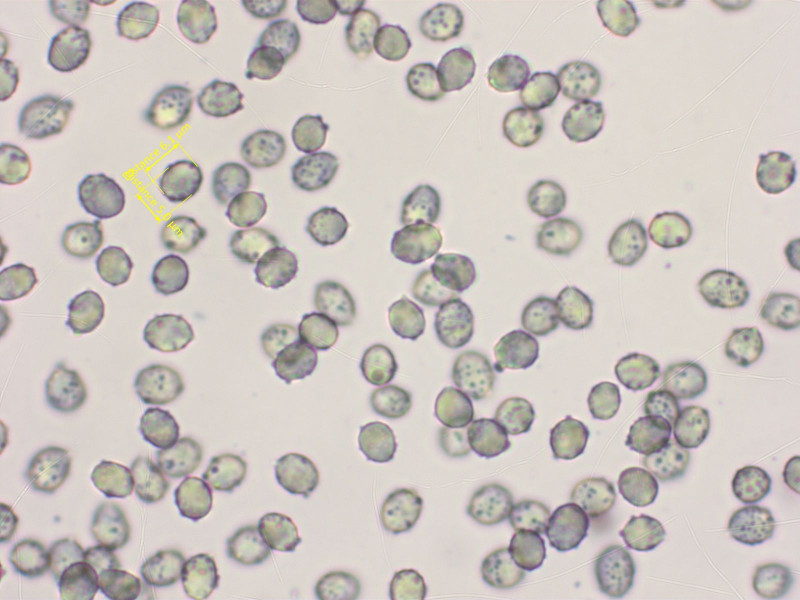
Sporen klein für die Gattung, keine Zystiden, am Stiel nur keulige Elemente.
23:

Paralepistopsis amoenolens, mindestens 50 Stück beim Picknickplatz wo sie jedes Jahr wachsen.
24:

Pholiotina filipes, die man im Feld oft kaum dieser Gattung zuordnen würde.
Aber wenn man die Art mal auf dem Radar hat, ist sie einfach zu bestimmen.
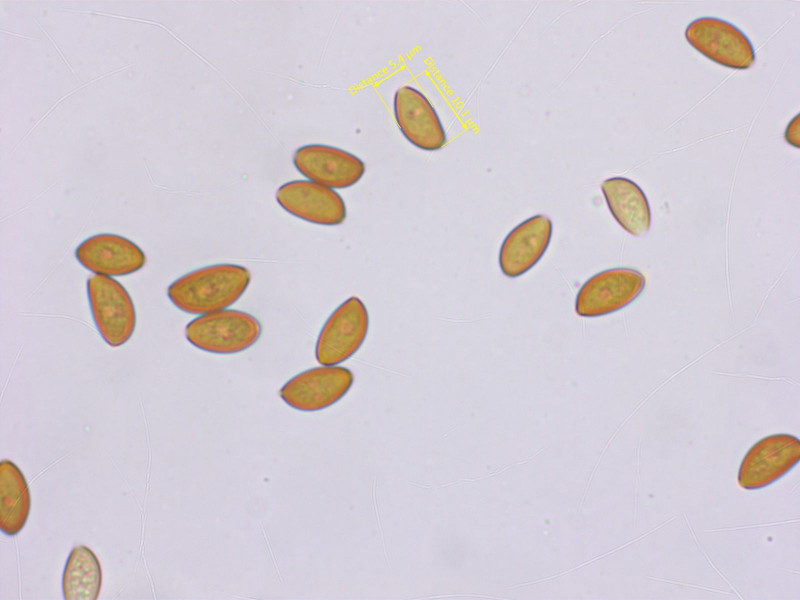
Sporen kaum abgeplattet
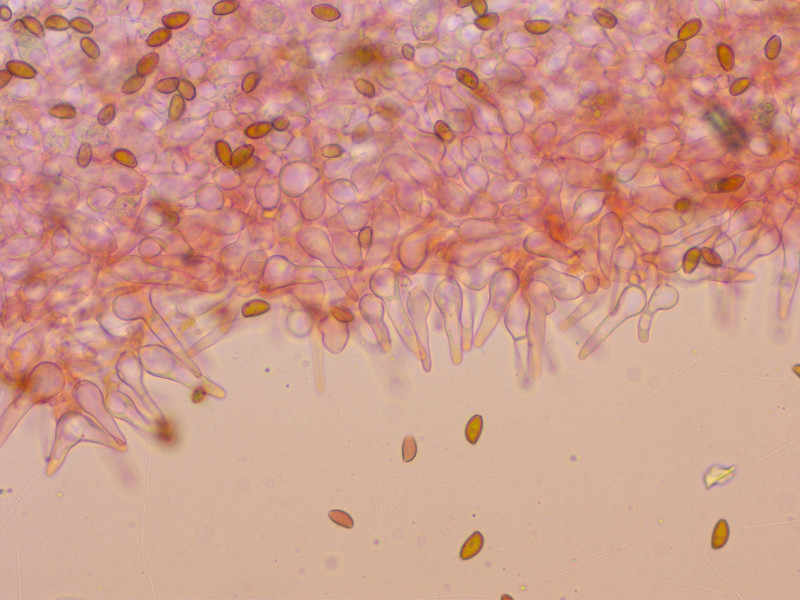
Cheilozystiden mit einer ganz typisch Form, bauchig mit spitzem Apex.
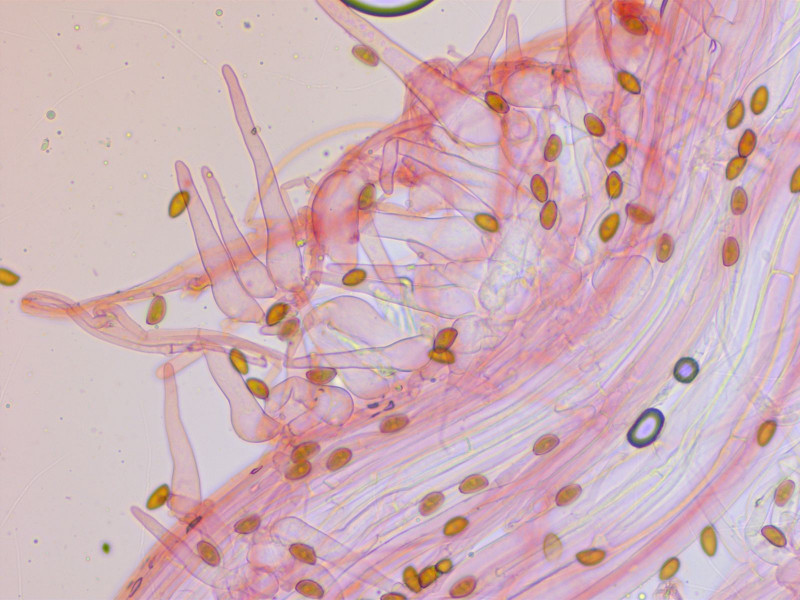
Kaulozystiden ebenso.
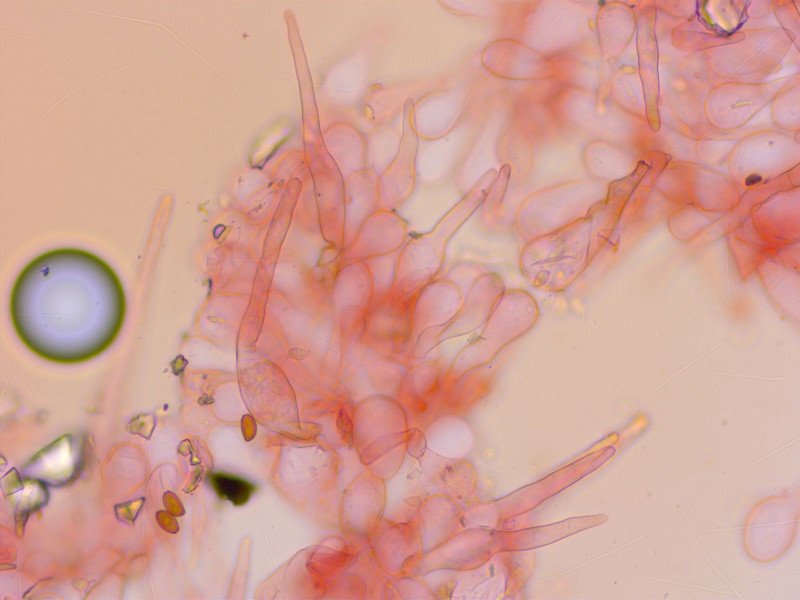
Und auf dem Hut gibt es auch solche Pileozystiden.
25:

Zum Abschluss noch ein Fund auf dem Weg zur JEC-Tagung: Hohenbuehelia auriscalpium.
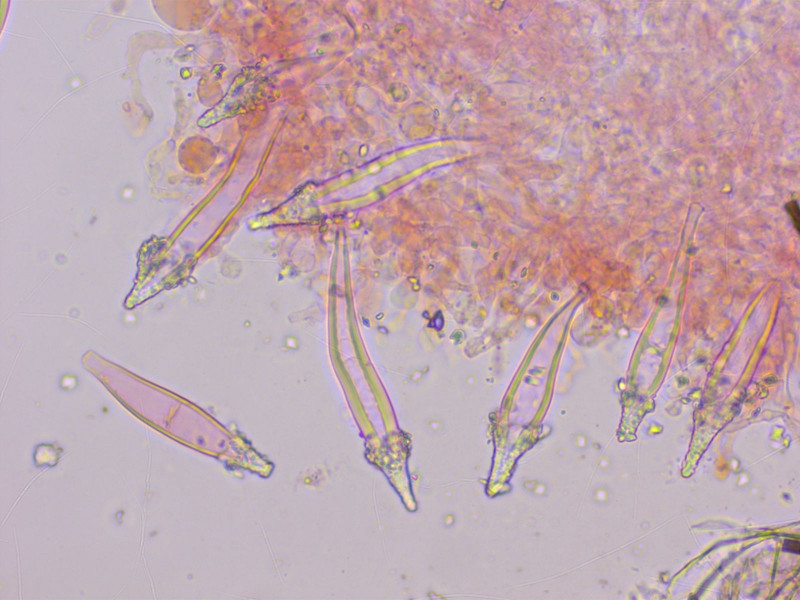
Die haben so prächtige Pleurozystiden.
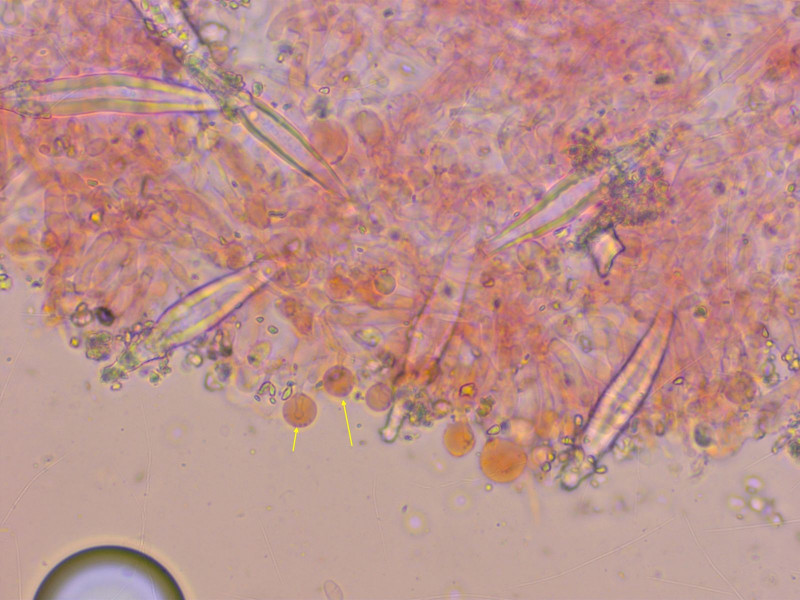
Die Cheilozystiden sind viel unauffälliger, klein und kopfig, oft mit so einem grossen Tropfen.
So, ich glaube das reicht erstmal.
Bitte korrigiert mich, wenn etwas falsch ist.
LG Raphael


