Hallo zusammen,
am letzten Samstag hatte Karl W in sein Wohnzimmer eingeladen und so ging es dann gemeinsam mit JanMen und coprinusspezi ins Depot. Wie nicht anders zu erwarten, war es wieder mal eine großartige Tour bei der es Pilze in Hülle und Fülle gab. Inbesondere die Erdzungen liefen zur Hochform auf, so daß sie hier im ersten Teil des Berichts gar keinen Platz finden und ihren eigenen Beitrag bekommen werden.
1. Direkt am Parkplatz ging es schon los: Tricholoma cingulatum

2. Lactarius controversus


3. Lepiota echinella

3. Neottiella rutilans

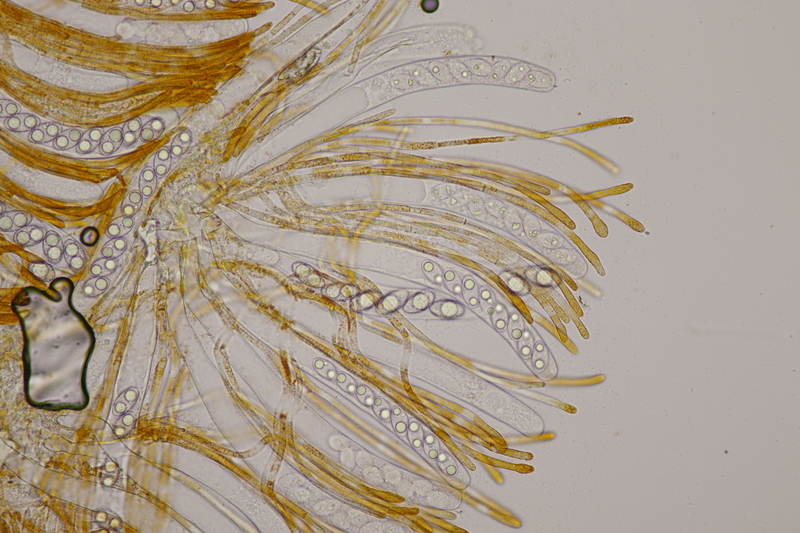
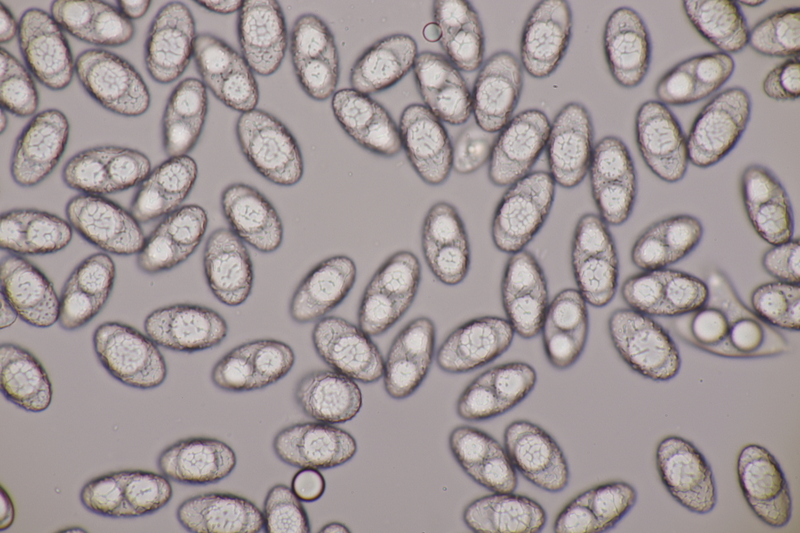
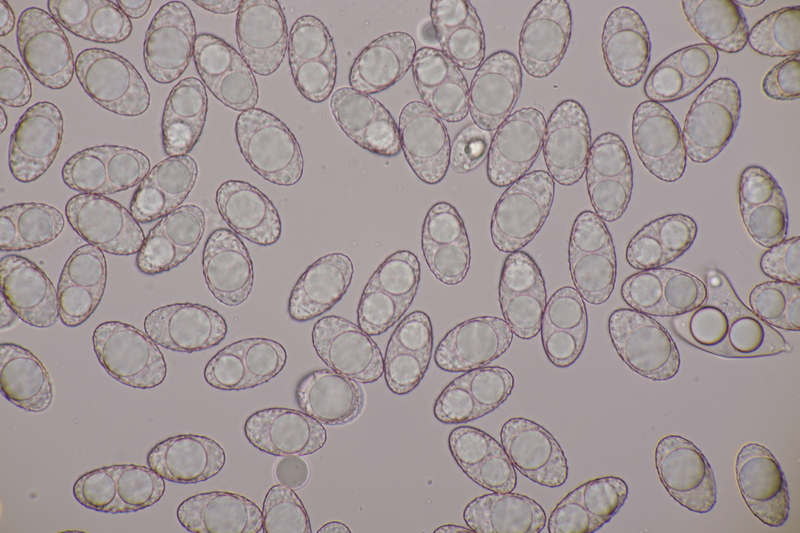
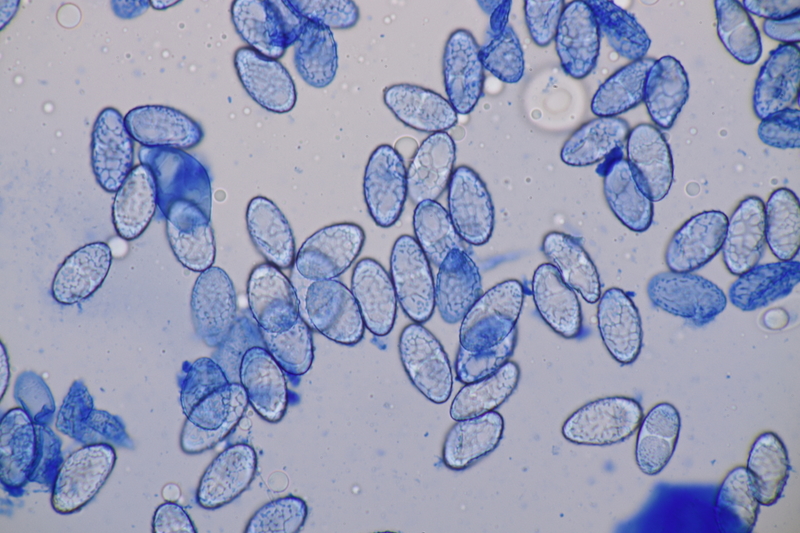
4. Clavaria greletii


5. Ein namenloses Keulchen mit langem, dünnen Stiel

6. Ascocoryne albida

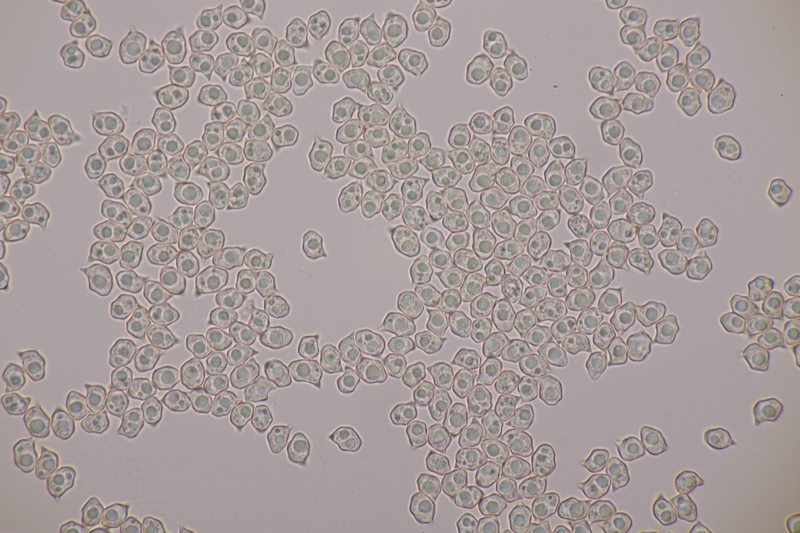
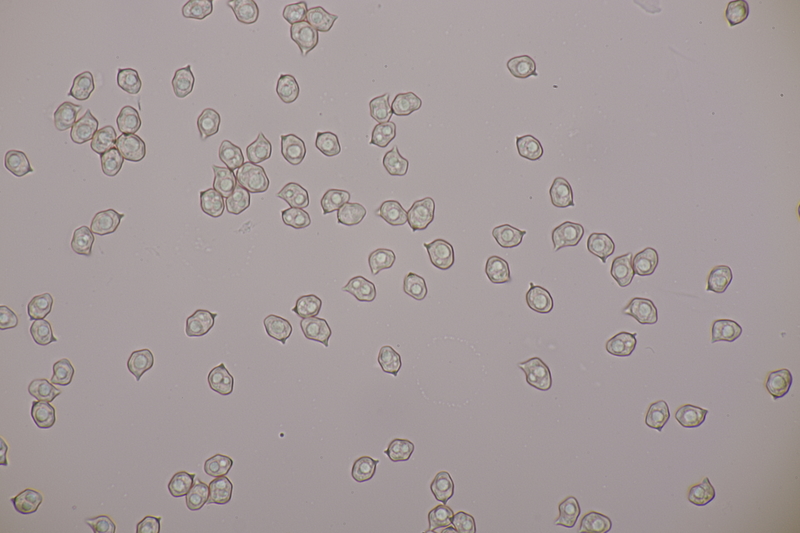
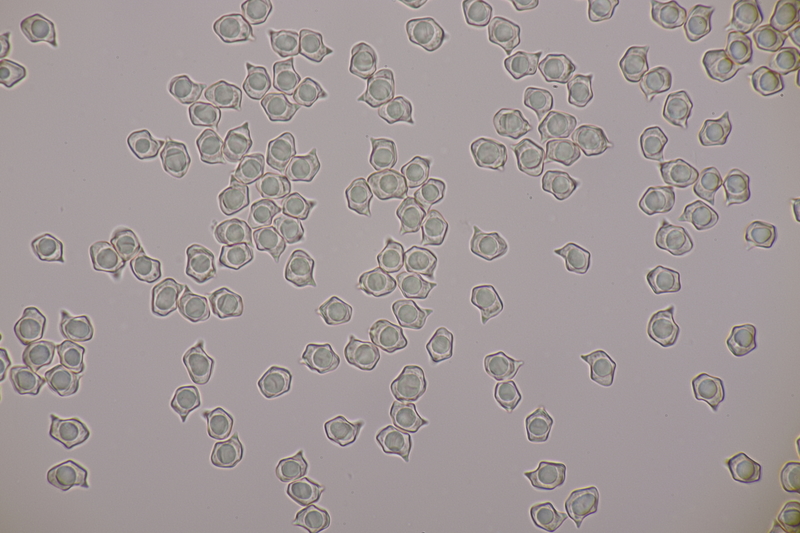
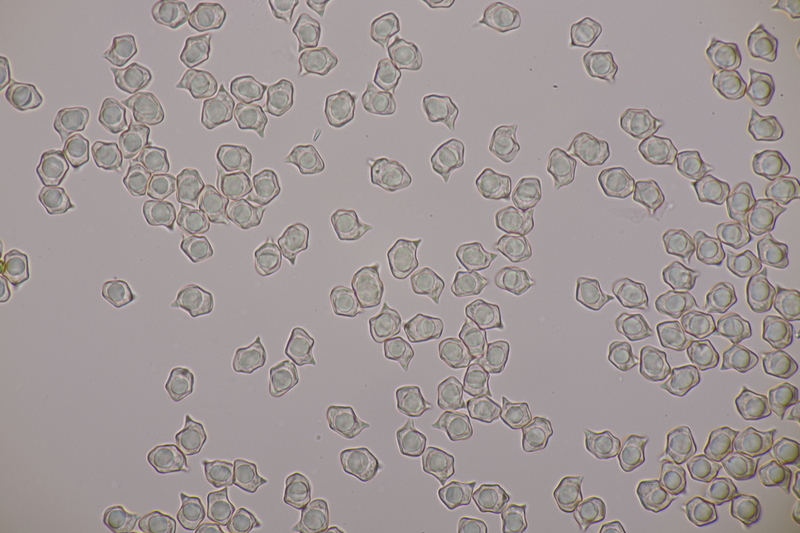
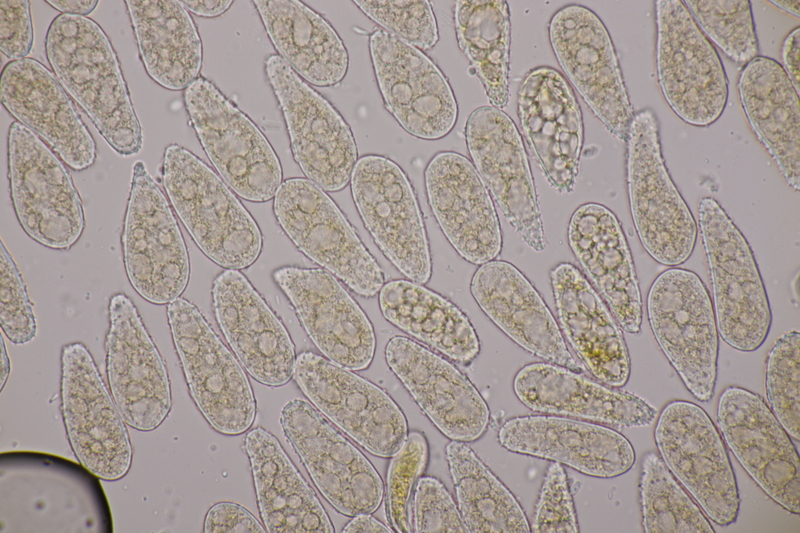
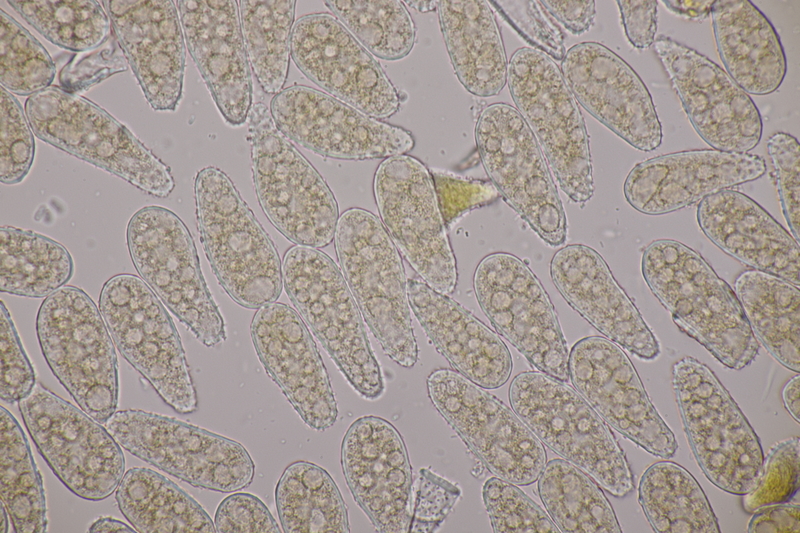
7. Entoloma infula. Sporen messen 8.0+-0.8 x 5.8+-0.4, Q=1.4+-0.1, 6.7-9.4 x 5.4-6.6, Q=1.2-1.6, Basidien 4-sporig mit Basalschnalle


IMG_0001.JPG
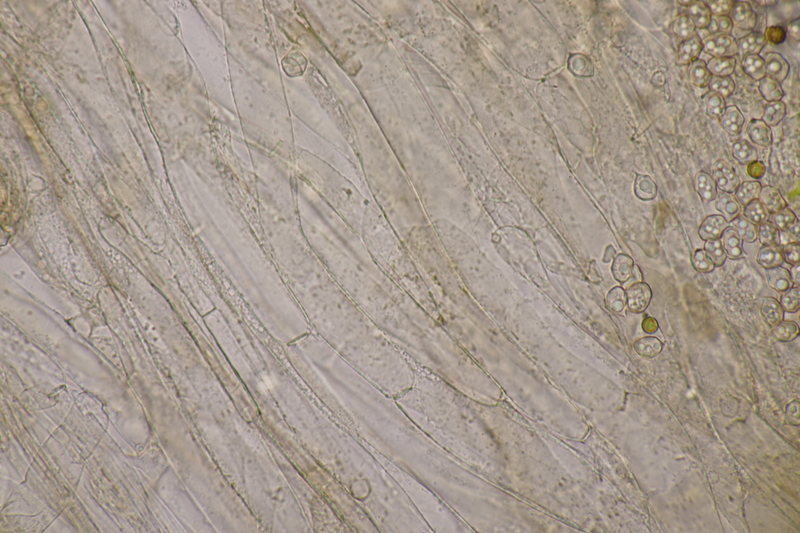
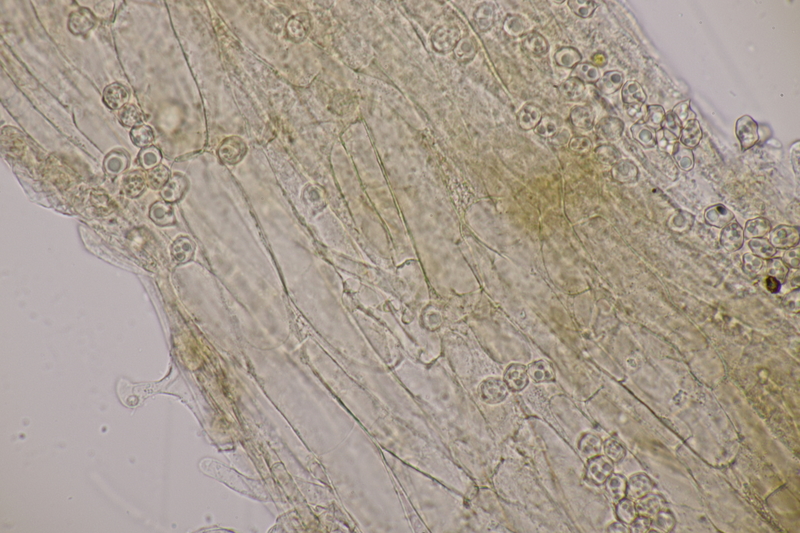
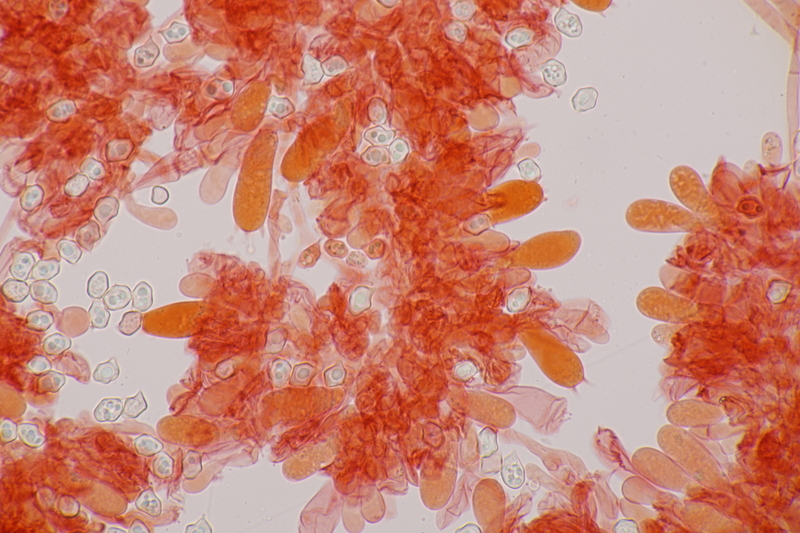
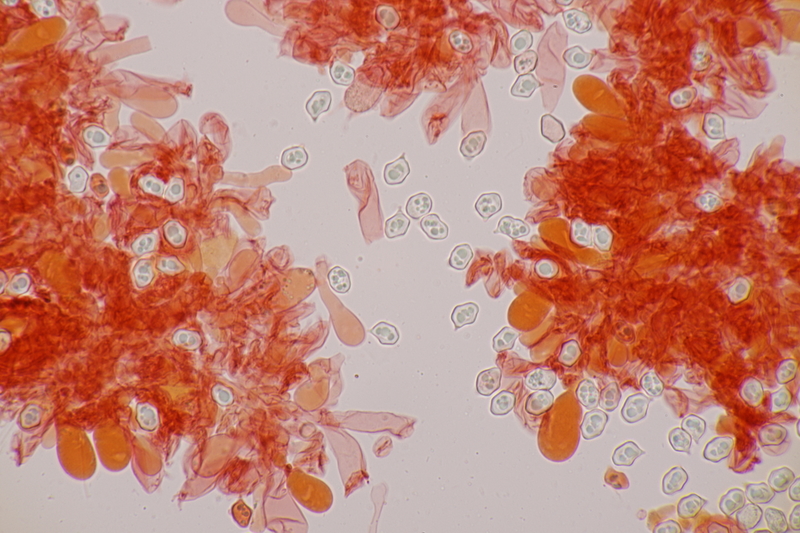
8. Clavaria krieglsteineri


9. Pseudaleuria fibrillosa





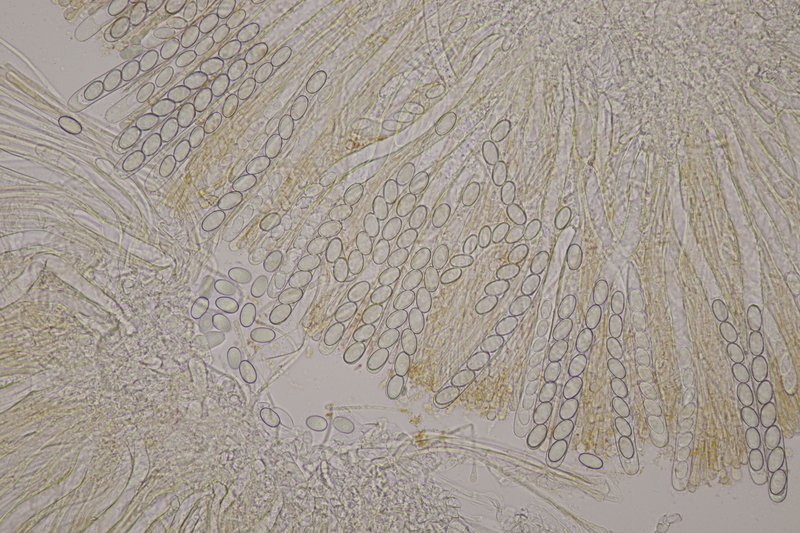
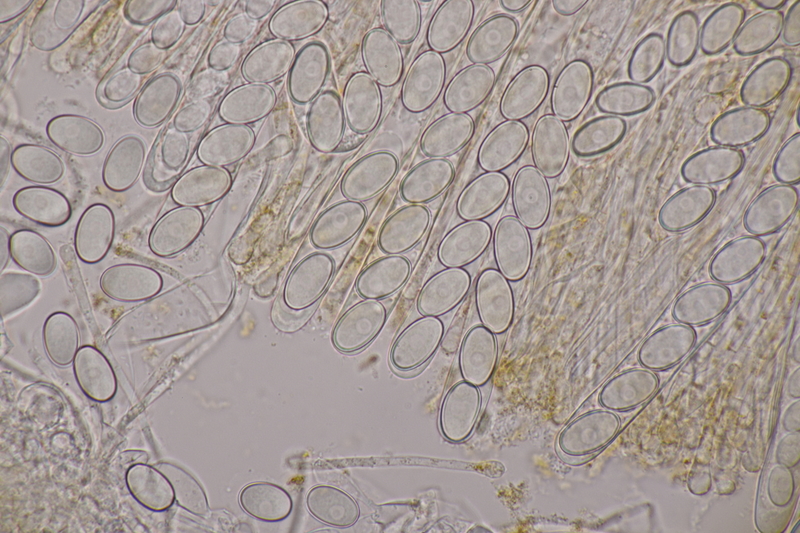
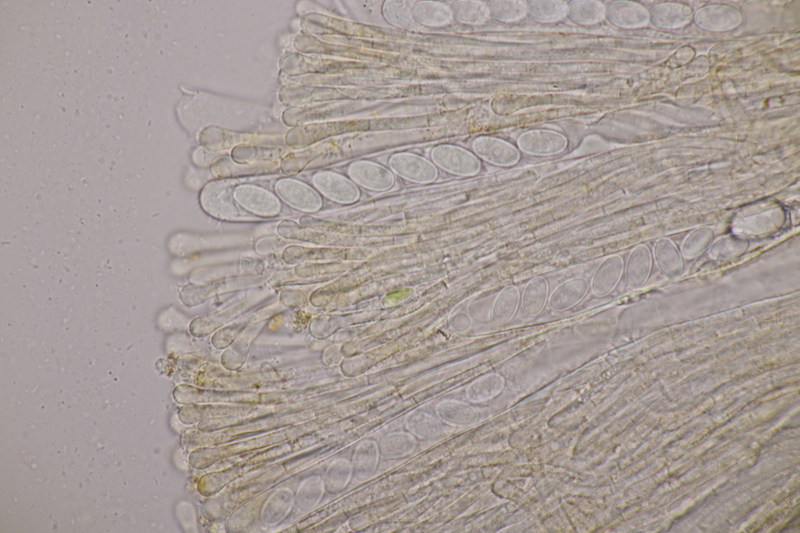
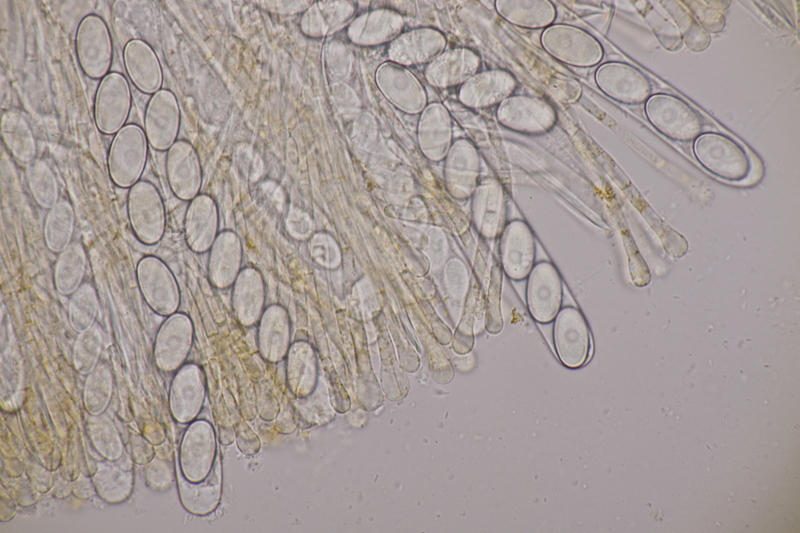
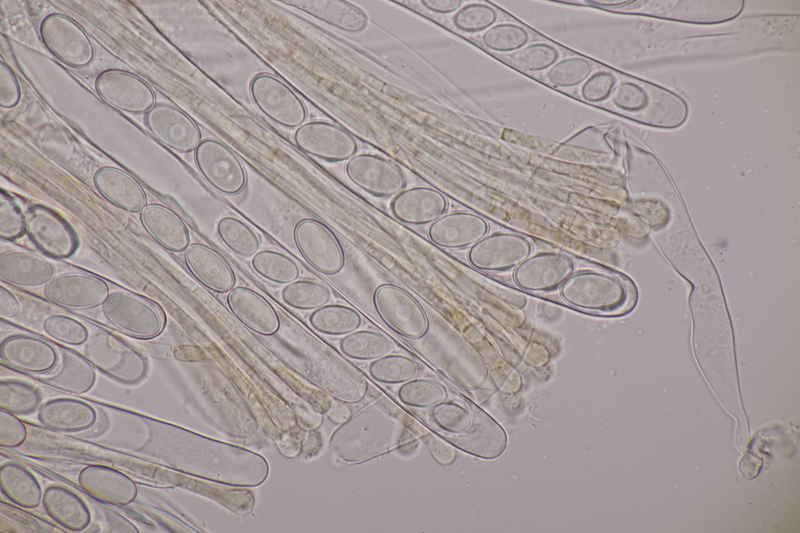
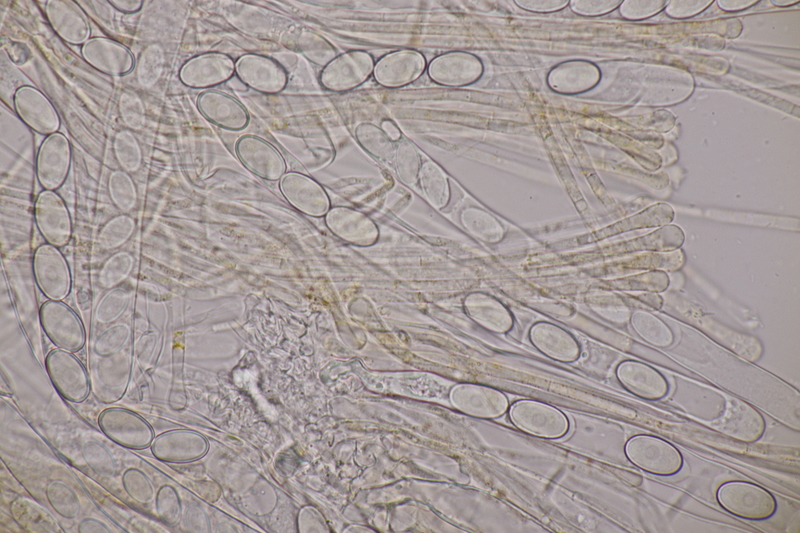
10. Lycoperdon utriforme


11. Simocybe haustellaris, die Hans anschleppte, während wir einen mageren Streifen nach Keulchen absuchten


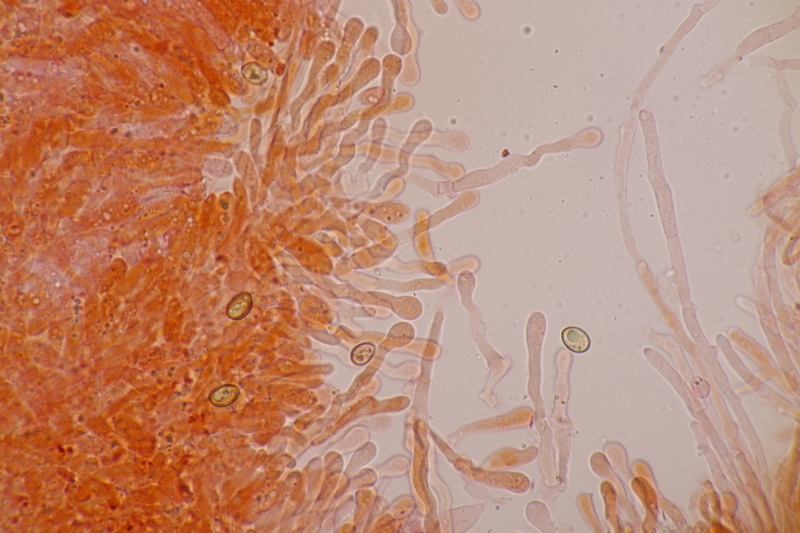
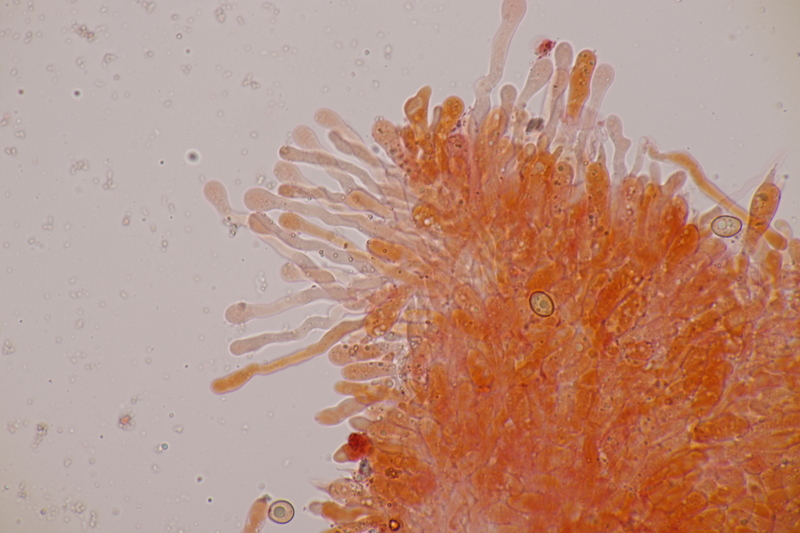
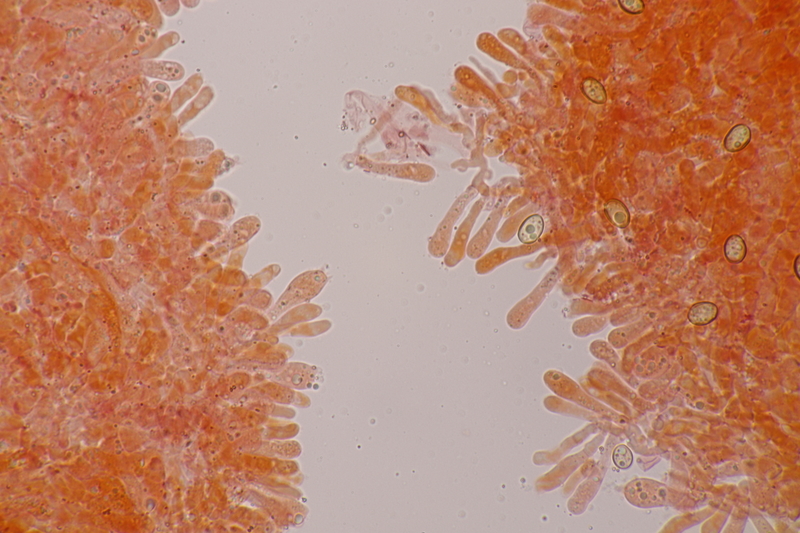
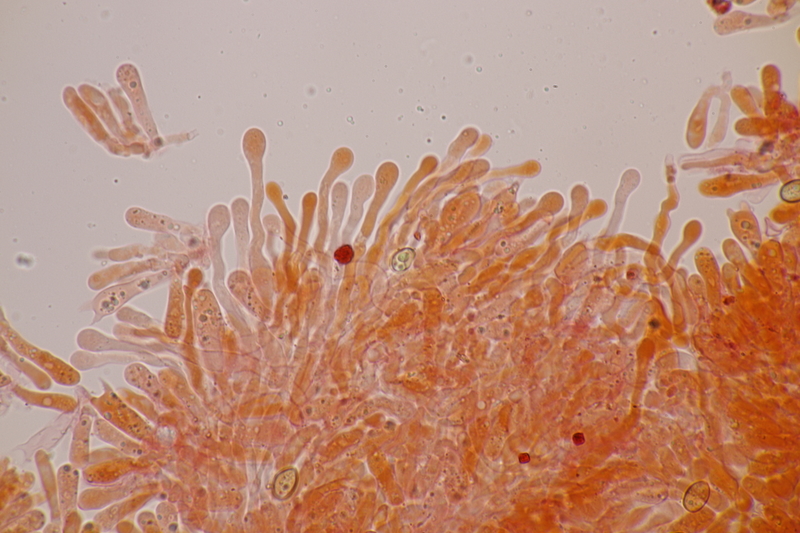
12. Und wenn man für die Simocybe niederkniet, kann man ja auch direkt den nächsten Pilz finden, damit sich das auch lohnt: Lamprospora miniata var. ratisbonensis


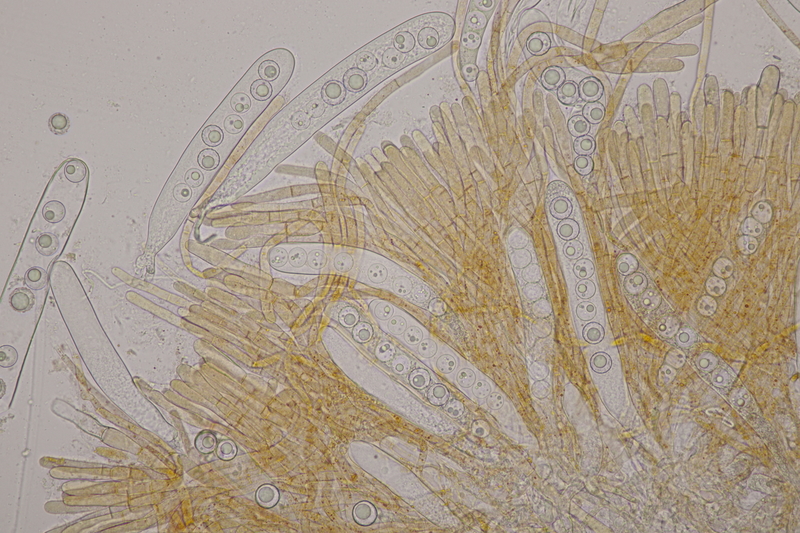
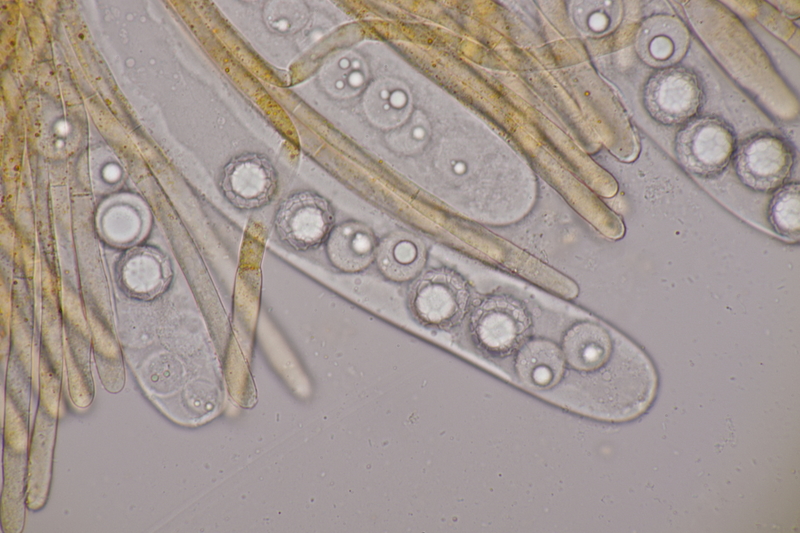
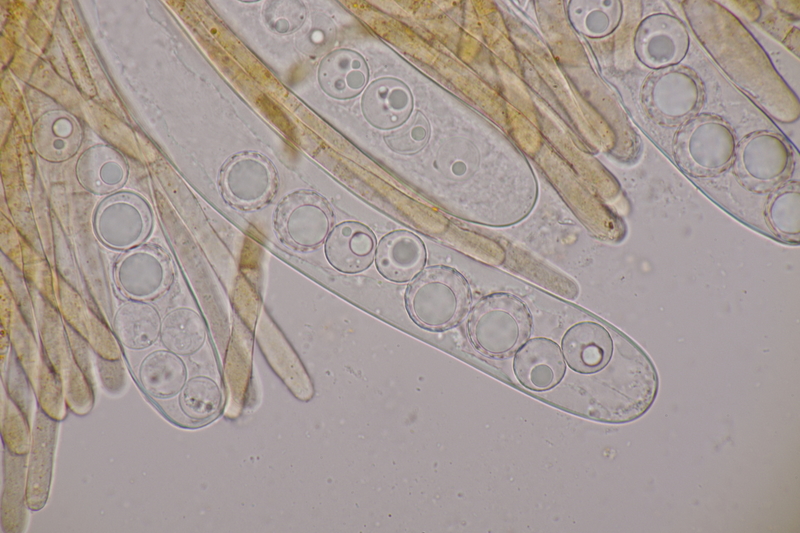
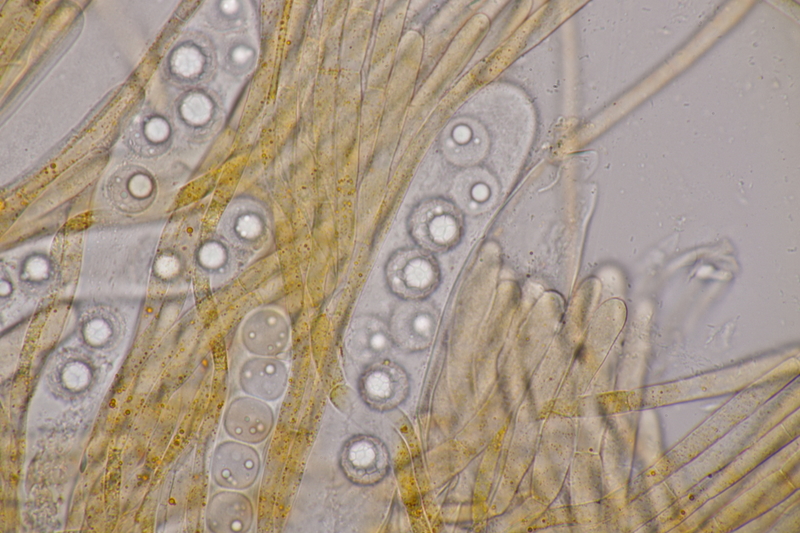
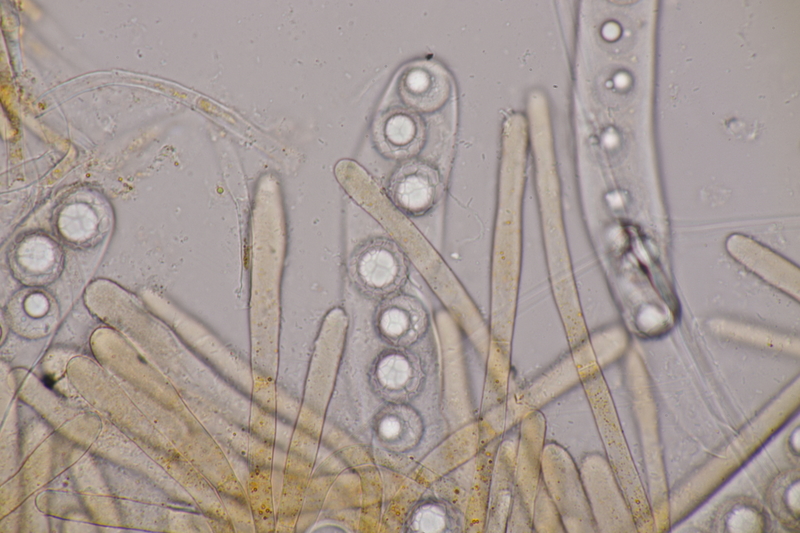
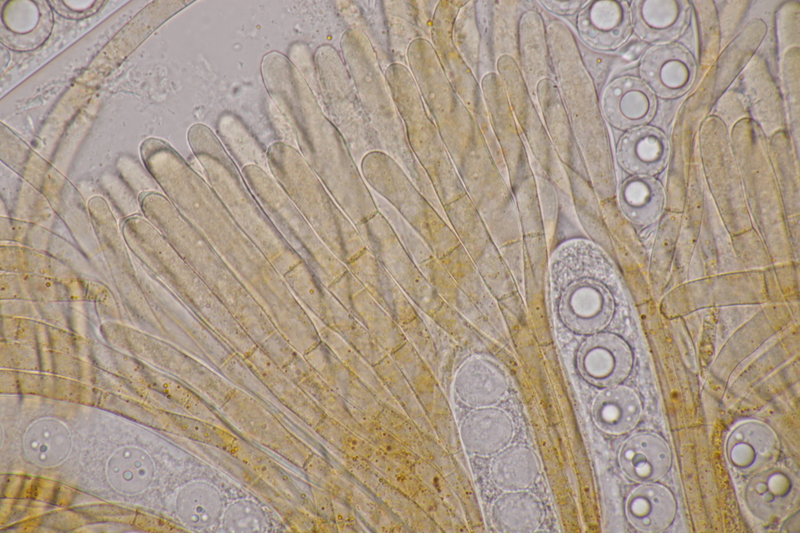
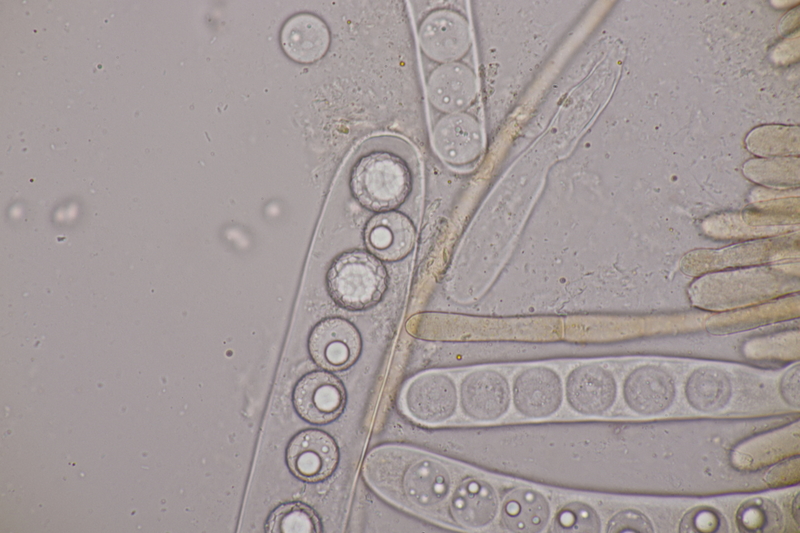
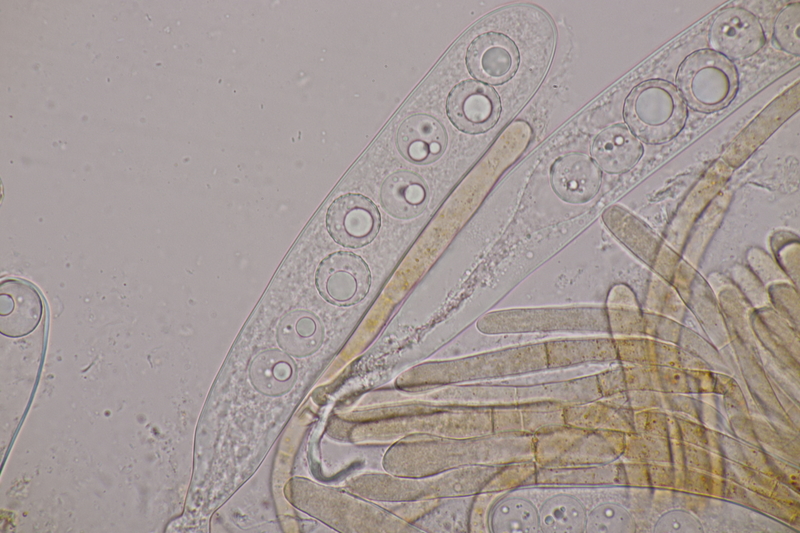
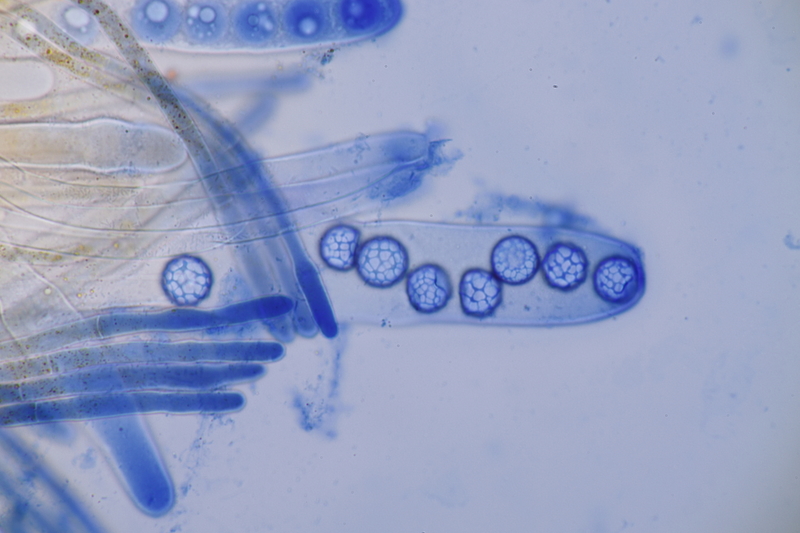
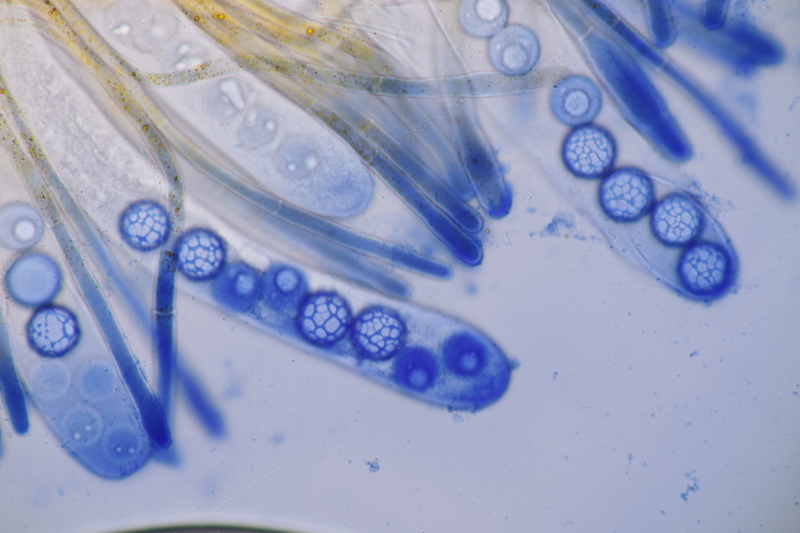
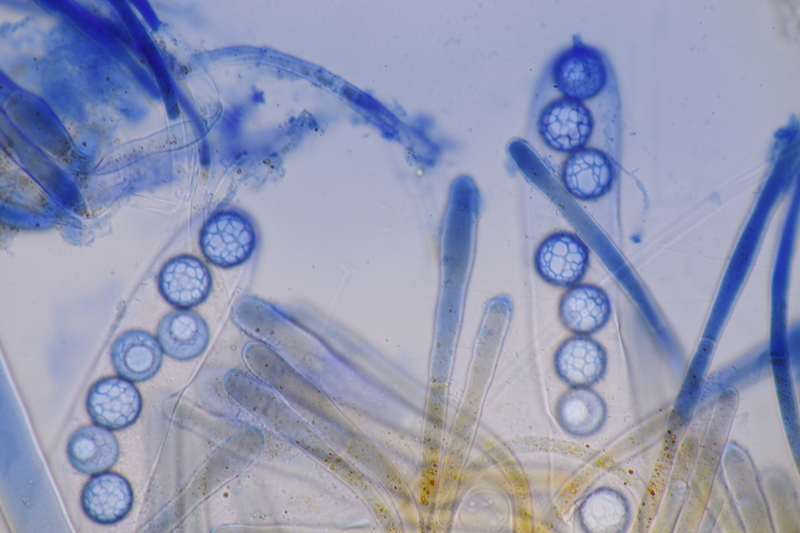
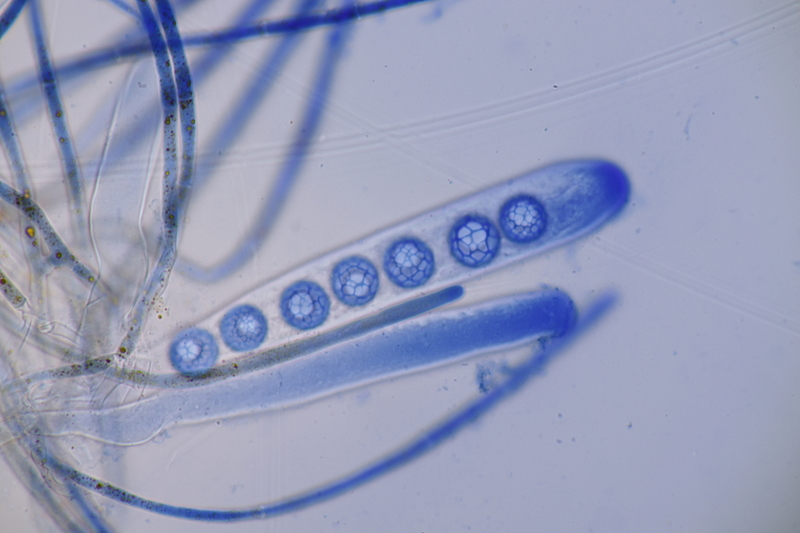
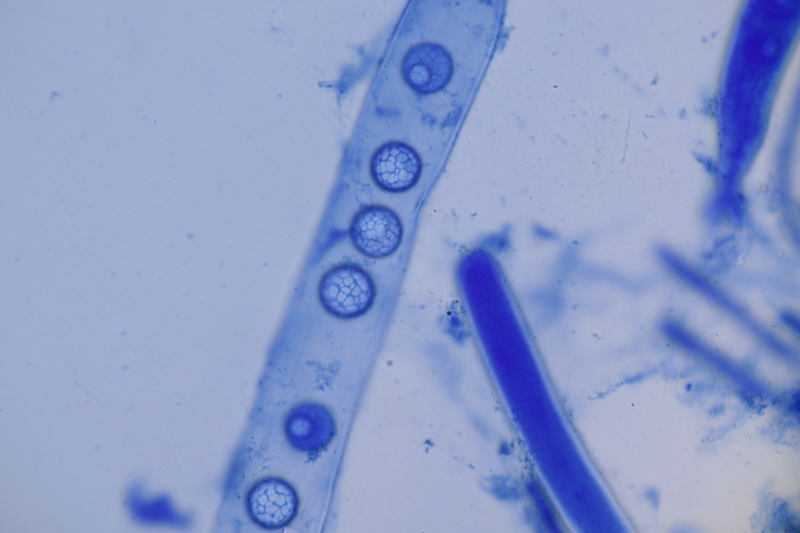
13. Laetisaria fuciformis

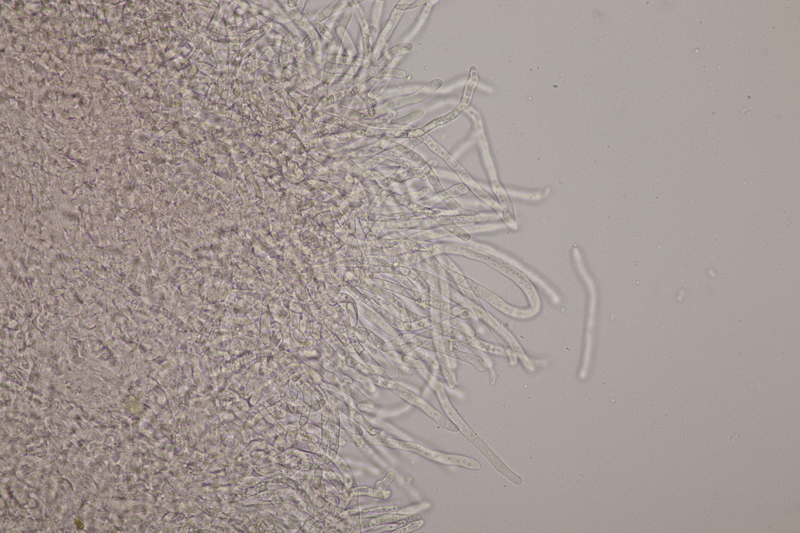
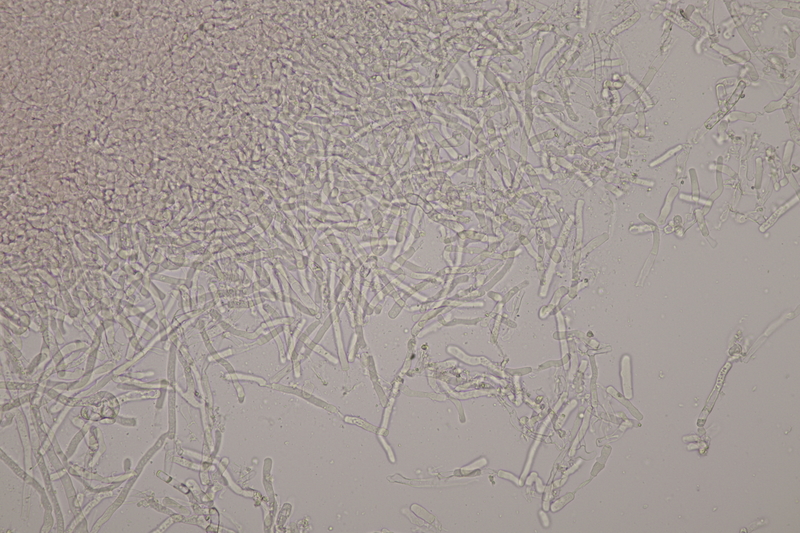
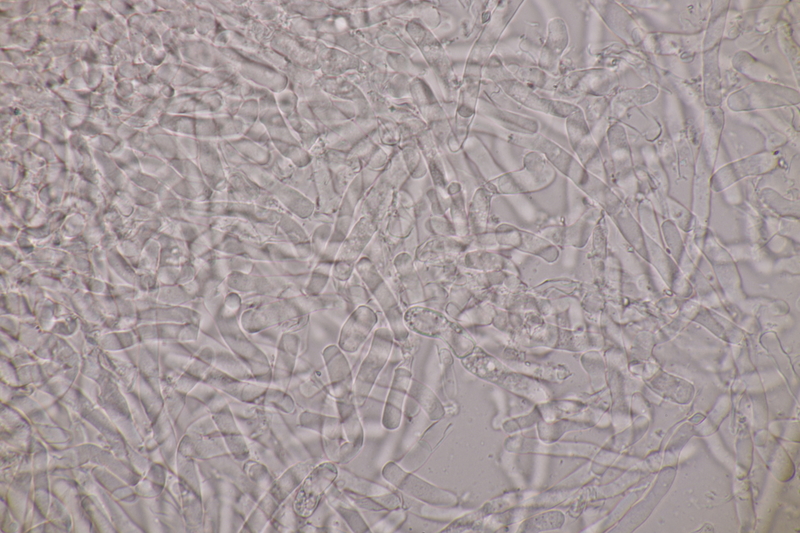
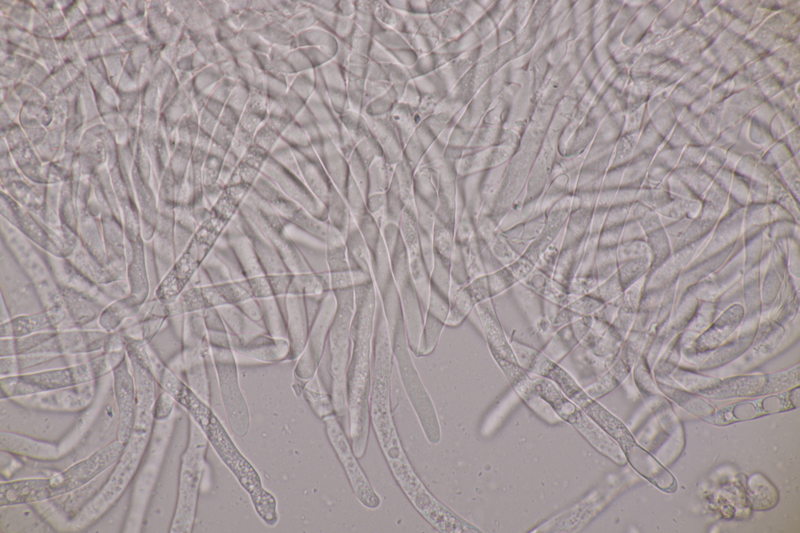
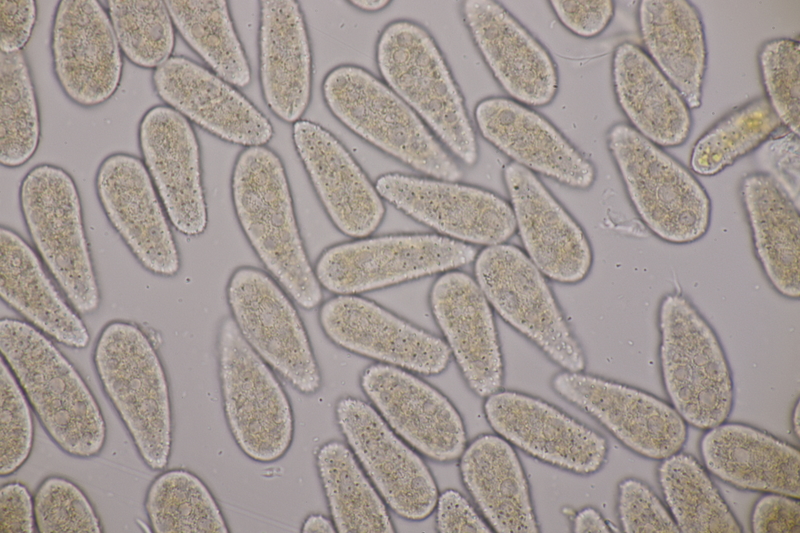
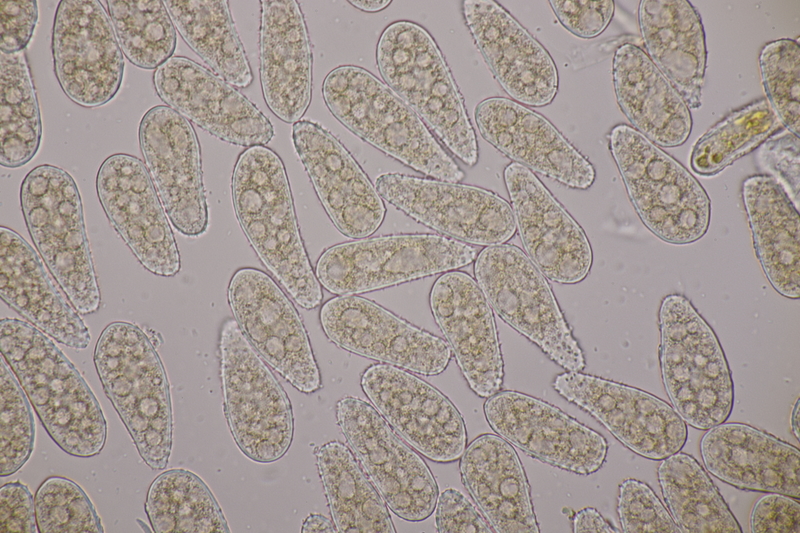
14. Entoloma sericellum. Sporenmaße: 9.4-11.1 x 6.2-8.1, Q=1.3-1.6


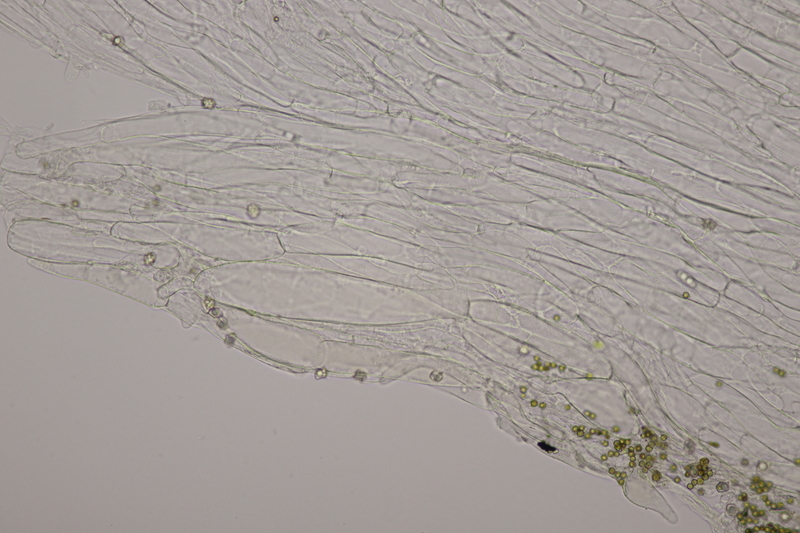
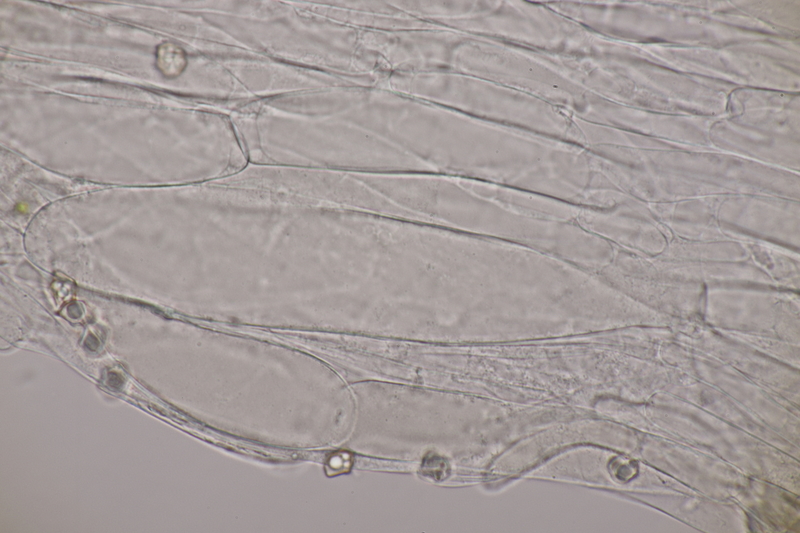
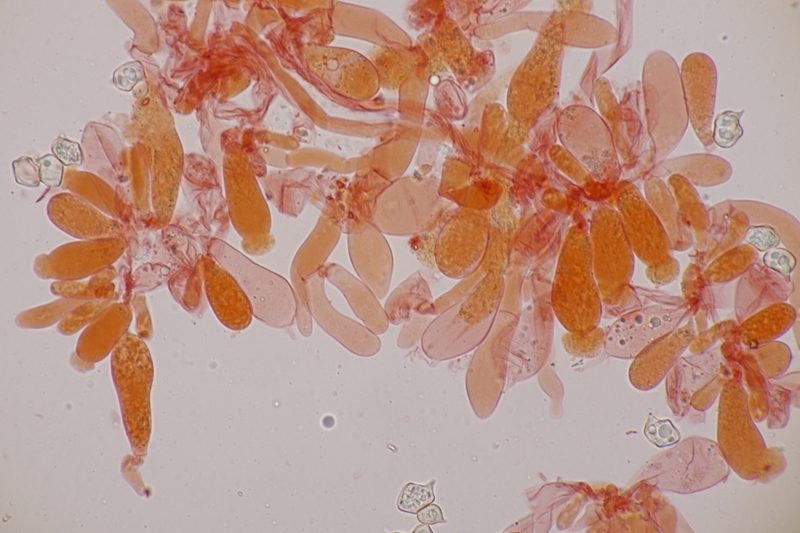
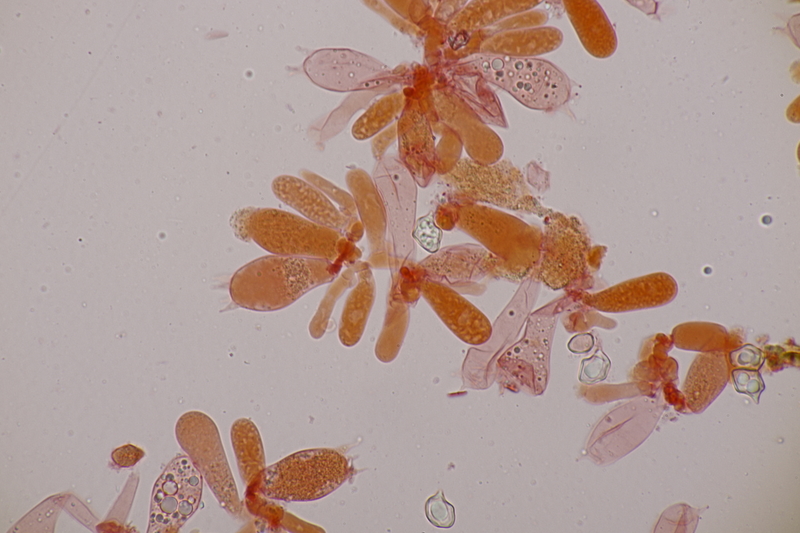
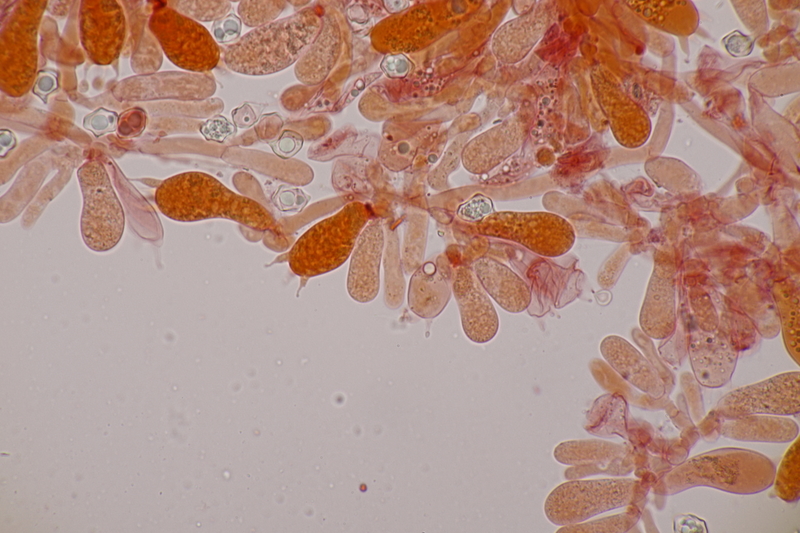
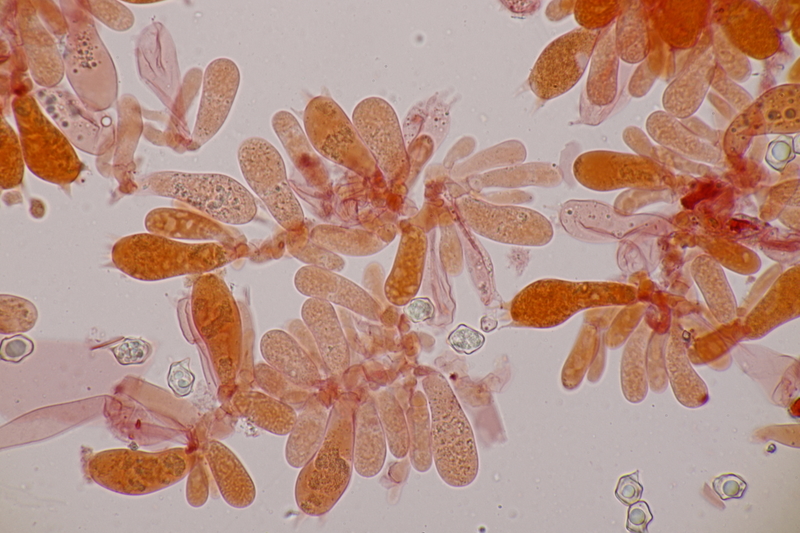
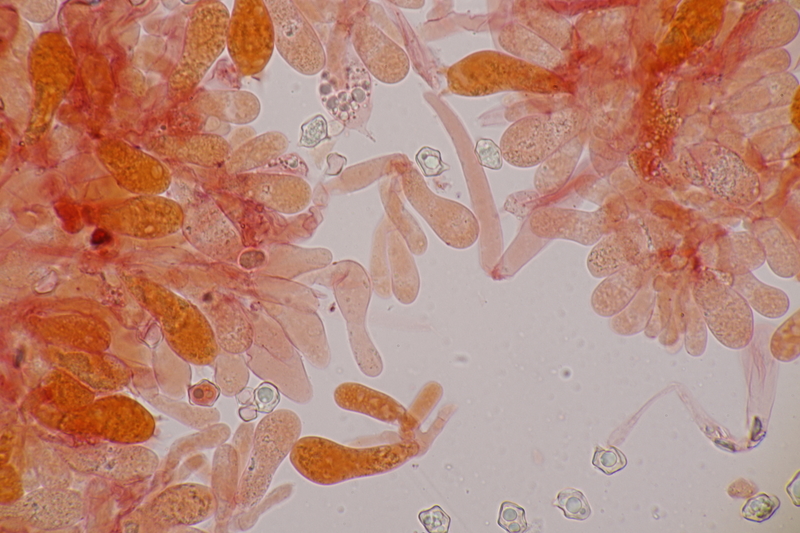
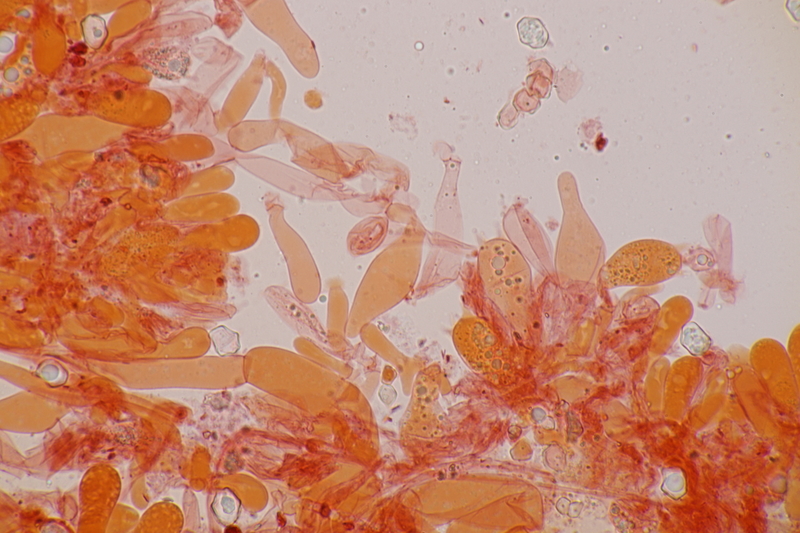
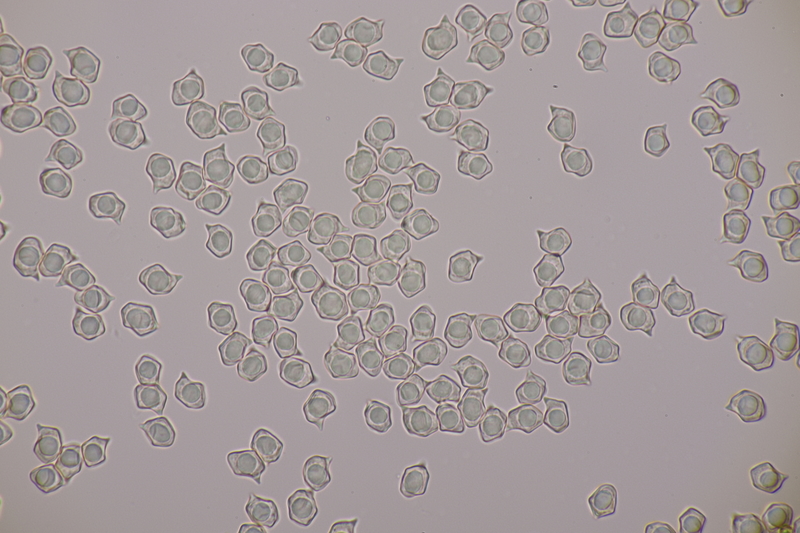
15. Phyllotopsis nidulans
IMG_9736.JPG

16. Hypholoma elongatum. Bei ganz jungen Exemplaren sind die Lamellen hell, so daß man erstmal gar nicht an einen Dunkelsporer denken würde.



17. Eine Entoloma, die wahrscheinlich Entoloma conferendum ist, die Karl aber zur Sicherheit auch noch eingesteckt hat.

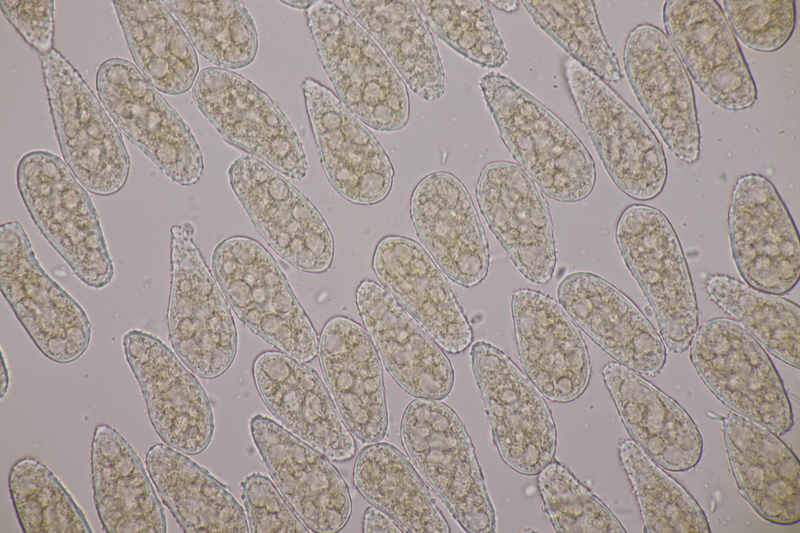
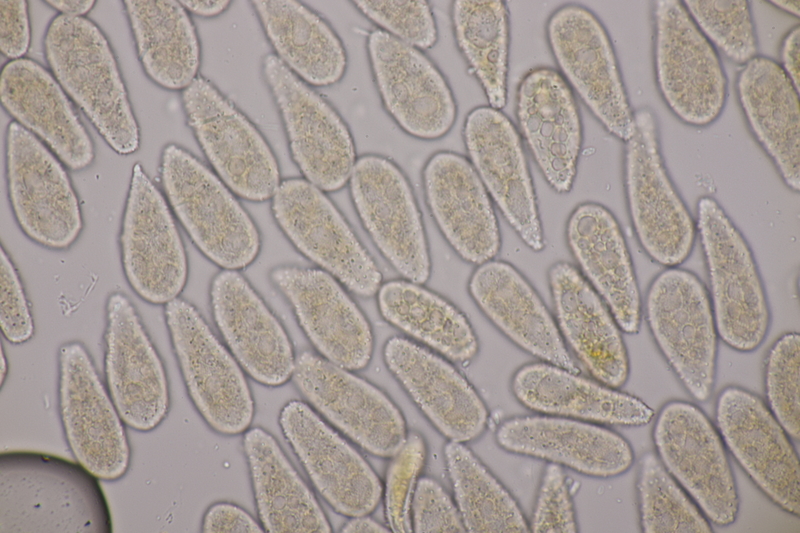
18. Melampsoridium betulinum ex Betula sp.



Björn


