Hallo liebe Pilzfreunde, es ist schon wieder Montag, mein Bestimmungsversuch Nummer 10
Mein heutiger Kandidat... pers. Hammer-Erstfund den ich meinen Pilzfreunden Mainfranken e.V. bei einer Exkursion rund um Würzburg verdanke, aber der dann für mich auch mit einer Herausforderung an der Präparat-Aufbereitung für das Mikroskop versehen war. Auch das Goldblatt Phylloporus pelletieri durfte ich an diesem Tag zum ersten mal bewundern.
Und noch ein Hammer!
Mykovino meinte: "Dein nächster Täubling wird dann wohl Russula amoena sein" und ich würde sagen: einfach Klasse, 1a, setzen. 
Jetzt zum Fund: 29.08.2017, Herbar: R17-013
Arbeitsname: Russula amoena, Brätlingstäubling-Samttäubling, Unter-Sektion Amoeninae (Rom.)
Makrodaten
FUNDORT: 280 müNN, MTB 6226, Mischwald, Eiche, Buche, Kiefer, Birke usw. sehr interessante Stelle, sowas habe ich bei mir in der Rhön noch nicht gesehen. Dieses Jahr muss ich unbedingt auch mal Standortaufnahmen machen.
PILZZUSTAND: jung, trocken, zersteut und doch öfters paarweise anzutreffen
HUT: vielfarbig, rot-braun, lila, violett, purpur, bläulich, leicht gedrückt, matt, seidig, bereift, wachsartig, 5,5cm Durchmesser
MITTE:
RAND: glatt, auch unrund und verdellt
PEELING: 1/2, unter der Huthaut rötlich-violett
LAMELLEN: creme bis blass-ocker, splitternd, mit Lameletten, Schneiden in Stielnähe violett-rot gefärbt und glitzernd
STIEL: zylindrisch, creme, weich bis fest, 5 x 1,3cm
BASIS: etwas zuspitzend
SPITZE: oberes 2/3 rötlich-lila behaucht, glitzernd
SCHNITT: wattig, voll bis gekammert, keine Verfärbung
GERUCH: schwach, sehr angenehm nach Milch-Brätling, Lactarius volemus
GESCHMACK: mild, und so bleibend
SPP-FARBE: nach ROMAGNESI II b
CHEMIE: FeSo4 nichts 20sec, Guajak neg. schwach blau-grün 20sec, >>> Phenol violett-bräunlich! 30sec <<<
Mikrodaten
HDS Pileozystiden: keine vorhanden
HDS inkr. Primordialhyphen: keine vorhanden
HDS sonst: auffällig bauchig-blasige Zellreihen, Endglied meistens spitz lanzettlich zulaufend, bis zu 4x mal septiert
SPOREN: Sporen[95% –• 48 –• SAP –• v –• H2O(nat) ] = 5,4 - 6,4 - 7,4(8,1) x 4,7 - 5,7 - 6,6(6,9) µm
SPORENMITTEL SONST: Q 1,13, V 109, A 36, n 48, Sporenform überwiegend rundlich
ORNAMENT: teil-netzig, auch von isoliert bis perlschnurartig fein bis gratig verbunden
WARZEN: stumpf-kegelig, bis 0,8 µm hoch
Resultierender Kibby Code: ADF-I-L-N Q-T-X
Die Bilder zum Fund...
1) Im abwechslungsreichen Mischwald, Eiche, Buche, Kiefer, Birke usw. fast immer 2-3 Stück beisammen

2) Hut Dm 5,5 cm, Stiel oberes 2/3 rötlich-violett behaucht, schwacher Milch-Brätling Geruch

3) Hut samtig, matt, bereift, wachsartige Oberfläche

4) später, gegen Abend sonderbar ins violett-bläuliche übergehend, Huthaut 1/2 abziehbar, unter der Hh rötlich-violett

5) Stiel mit Phenol nach 30 sek. violett-braun!, die braune Verfärbung der Stielbasis rechts kommt vom Transport mit anderen NICHT Speise-Pilzarten

6) mit Lameletten, Schneide am Stiel violett-rot, am Hutrand ungefärbt

7) Stiel oben und Schneiden wie bepudert glitzernd (bitte vergrössern)

8) 400x, Kongo SDS, auffällig bauchig-blasige Zellreihen
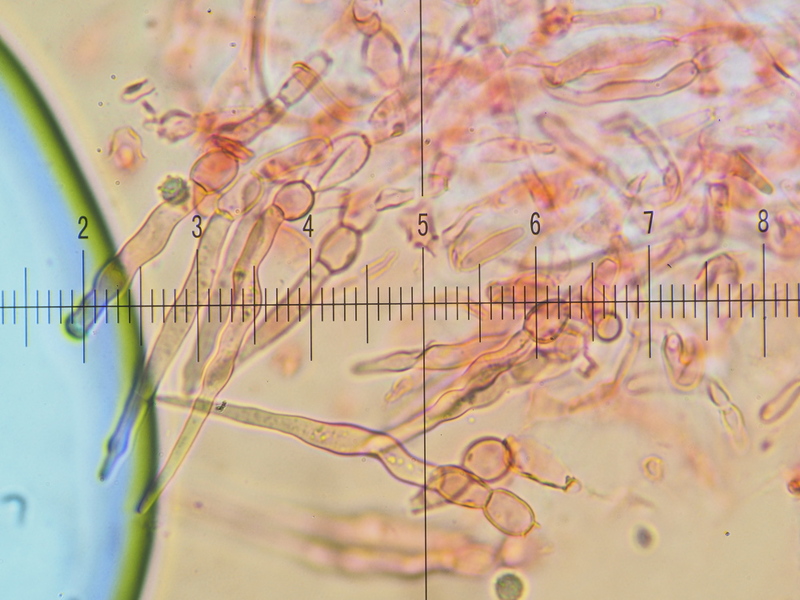
9) 400x, Kongo SDS, Endglied der Elemente überwiegend spitz lanzettlich zulaufend, nicht immer

10) 400x, Kongo SDS, die Zellen bis zu vier mal septiert
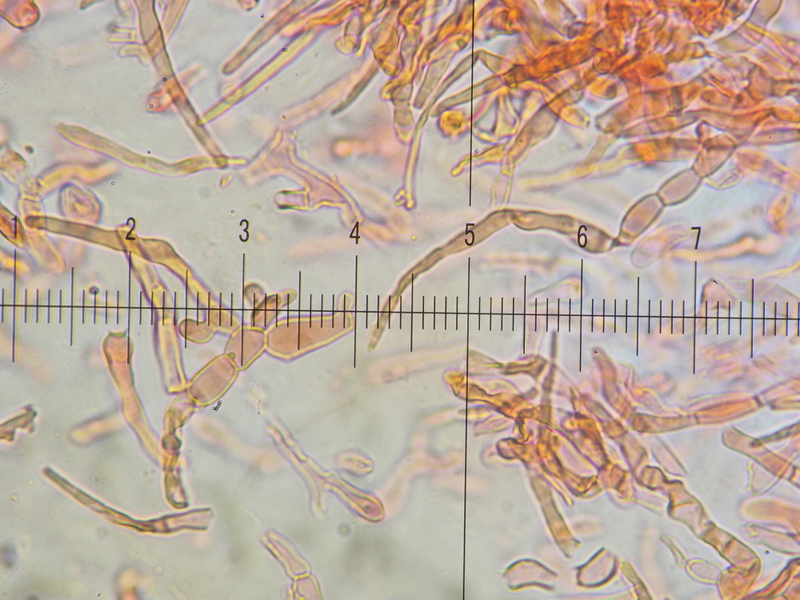
11) 100x, KOH 3%, dünner Lamellen Querschnitt, diese Herausforderung musste dieses mal wohl auch sein...
Zitat Frau MARXMÜLLER: Bei R. amoena sind neben dem Vorkommen auf Silikatböden, oft im Gebirge, dem spezifischen Geruch und der Phenolreaktion auch die mikroskopischen Merkmale zur Bestimmung erforderlich, und zwar nicht nur die Sporen und Epikutishaare, sondern auch Form und Größe der Zystiden, sowohl der Pleurozystiden als auch der am Lamellenrand vorstehenden Marginalzystiden. Ende Zitat.

12) 400x, KOH 3%, näher ran, an der ja hochkant-liegenden Lamellen-Schneide (Glück gehabt!) nun die Cheilo-Zystiden, überwiegend dünn, spitz zulaufend, teils büschelig
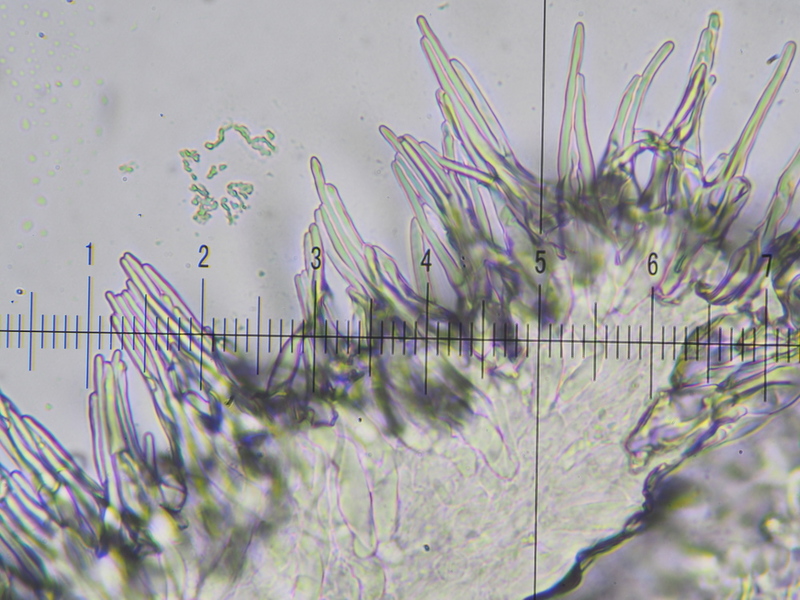
13) 400x, KOH 3%, eine einzelne Cheilo-Zystide, Breite 7 µm und um die 60 µm lang, Pleurozystiden (an der Lamellen-Fläche) wurden an diesem einen Präparat keine gefunden

14) Sporen Vermessung in H2O(nat)

15) Grafische Darstellung der Sporenmessreihe

16) 1000x, Melzer, Ornament von isoliert bis perlschnurartig fein bis teilnetzig-gratig verbunden

17) 1000x, Melzer, Sporenform rundlich, Warzen stumpf-kegelig und bis zu 0,8 mü hoch

FAZIT:
Meine makroskopische Bestandsaufnahme passt soweit, inkl. der Phenol-Reaktion
Die mikroskopische Nachprüfung der HDS und der Sporen zeigen auch die in meiner Literatur geforderten Merkmale.
Zitat Frau MARXMÜLLER: ...viele spitze, schlanke Marginalzystiden (am Lamellen-Rand). Huthaut weder mit Pileozystiden noch mit inkrustierten Primordialhyphen, aber mit langen, pfriemförmigen Haaren, auf etwas asymmetrischen, relativ wenig voluminösen Tönnchenketten aufsitzend; letztere können auch ohne schmale, pfriemförmige Endzellen mit einer breiten Zelle an der Oberfläche enden. Ende Zitat.
Auch bei diesem Punkt sehe ich in meinem Pilz eine Russula amoena und keine Russula amoenicolor. Und nur das wollte ich mir nachweisen.
>>> Alle Beiträge dieser Serie findet ihr mit der Forum-Suchfunktion mit "Mein Täubling diese Woche:"
Danke für das Interesse... nächste Woche geht es weiter mit der Farbe Rot und scharf...
Grüsse
claus


