Hallo liebe Pilzfreunde, mein Bestimmungsversuch Nummer 14a
ein weiterer Täublingsfund von 2017 den ich euch gerne zeigen möchte.
Mein heutiger Kandidat... kommt gleich im Doppelpack, hier der Erste
Fund: 17.10.2017, Herbar: R17-018
Arbeitsname: Russula queletii, Stachelbeertäubling, Unter-Sektion Sardoninae (Rom.)
Makrodaten
FUNDORT: 510 müNN, MTB 5725, bei Buche und Fichte, direkt neben Fichtenreizkern (L. deterrimus)
PILZZUSTAND: älter, trocken, gesellig
HUT: vielfarbig, schmutzig-violett, ocker, braun-grünlich, matt bis seidig, wachsartige Oberfläche, 8cm DM
MITTE: oliv-bräunlich
RAND: lappig, 1cm gerieft
PEELING: 1/3, unter der Huthaut violett durchgefärbt
LAMELLEN: blass-ocker, splitternd, queradrig
LA-SCHNEIDE: am Rand schwach violett-rot
STIEL: zylindrisch, violett-rot mit weiss, 6 x 1,5cm, weich, wachsartige Oberfläche
BASIS: 2cm weiss mit bräunlichen Flecken
SPITZE:
SCHNITT: wattig ausgestopft, keine Verfärbung
GERUCH: stark fruchtig
GESCHMACK: sofort scharf, dann bitterlich
SPP-FARBE: nach ROMAGNESI IId - [IIIa]
CHEMIE: FeSo4 nichts 20sec, Guajak neg. schwach blau-grün 20sec, Ammoniak auf Lamellen negativ
Mikrodaten
HDS: Pileozystiden vorhanden, teils sehr lang, zylindrisch, keulig, mit Ausstülpungen, nicht septiert, bis 9(10) µm breit
HDS: inkr. Primordialhyphen keine vorhanden
HDS sonst: Haare rel. dünn, vielgestaltig, zylindrisch, keulig, kopfig, gabelig, mit Divertikel, bis 5 µm breit
SPOREN: Sporen[95% –• 76 –• SAP –• v –• H2O(nat) ] = 6,8 - 7,8 - 8,7(9,2) x 5,9 - 6,7 - 7,5(7,8) µm
SPORENMITTEL SONST: Q 1,16, V 185, A 52, n 76, Sporenform rundlich bis leicht oval
ORNAMENT: grob, isoliert, doch mit einzelnen schwachen Verbindungen
WARZEN: stumpf-kegelig, bis 1,2+ µm hoch
Resultierender Kibby Code: AD-HI-L-N Q-SU-W
Die Bilder zum Fund...
1) Überwiegend Buchen mit eingestreuten Fichten, drei ältere Exemplare neben Fichtenreizkern, Hutdurchmesser 8cm

2) Hut seidig, wachsartig anfühlend, Mitte ocker-olivlich, Rand kurz gerieft, Hh nur 1/3 abziehbar, darunter violettlich

3) Lamellen blass-ocker, splitternd, queradrig, Lamelletten selten, Ammoniak auf Lamellen negativ

4) Stiel seidig, wachsartige Oberfläche, geadert, violett-rot gefärbt mit weisslicher Stielbasis

5) 400x, Sulfovanillin, Pileozystiden sehr lang, stark violett-schwarz eingefärbt
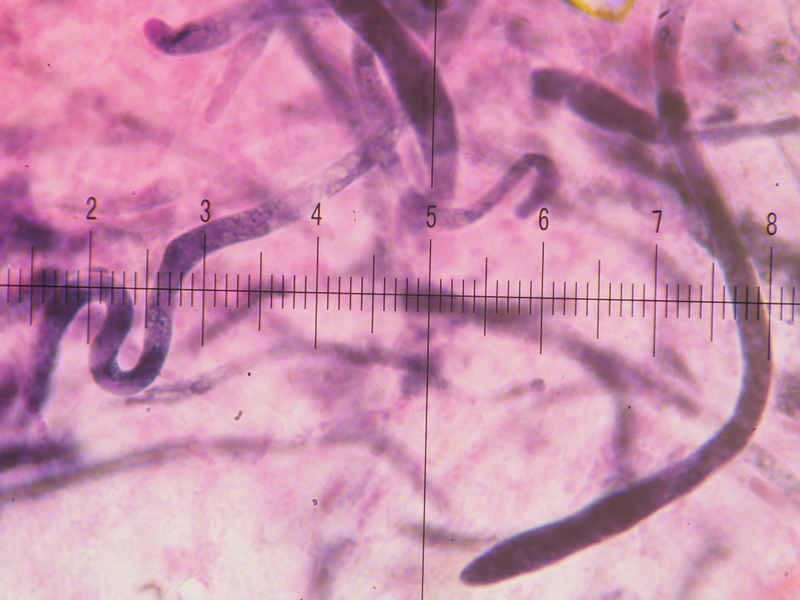
6) 400x, Kongo SDS, sehr auffälliges Erscheinen, meist keulig, Septen wurden keine festgestellt

7) 400x, Kongo SDS, teils auch mit grösseren kurzen Verzweigungen und Ausstülpungen
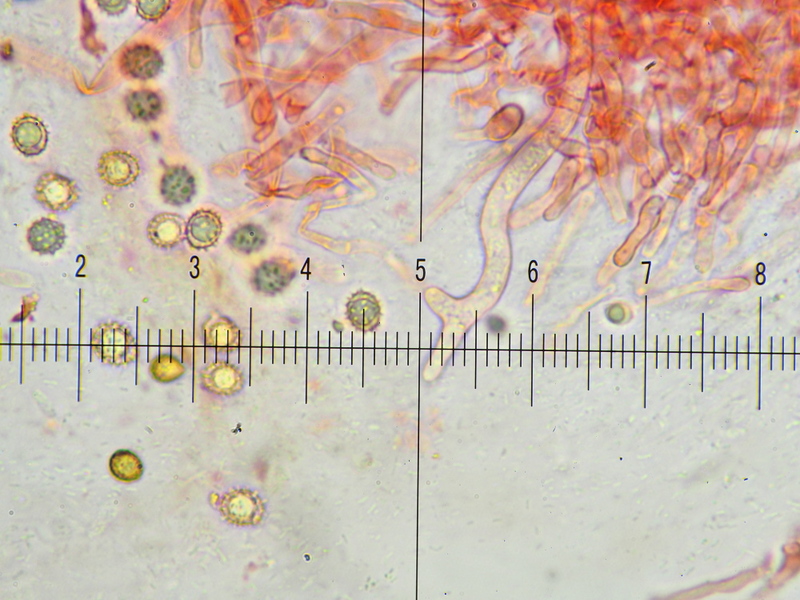
8) 400x, Kongo SDS, Zystiden mit gelb-grünen Elementen, um 10 µm breit, Haare unauffällig und vielgestaltig

9) Sporen Vermessung in H2O(nat)

10) Grafische Darstellung der Sporenmessreihe

11) 1000x, Melzer, Ornament kräftig, meist isoliert mit schwachen Verbindungen

12) 1000x, Melzer, aber auch einzeln zusammenfliesend

13) 1000x, Melzer, Warzen überwiegend stumpf-keglig und um die 1,0 bis 1,2+ µm hoch

FAZIT:
Die makroskopische Bestandsaufnahme passt gut
Die mikroskopische Nachprüfung der HDS und der Sporen zeigen auch alle geforderten Merkmale.
Betrachte ich nun bei meinem Pilz das Sporen-Ornament mit den meist isoliert "mit schwachen Verbindungen der Warzen"
UND vergleiche dann die artikulierte Dermatozystide in meinem Bild Nr.7 mit der Mikrozeichnung der Dermatozystide B1/S.304 von Frau HELGA MARXMÜLLER, sehe ich diese Bestimmung mit Russula queletii als gar nicht mal so abwegig an.
Als Zugabe gleich noch mal eine Russula queletii?? Oder doch was anderes??
Mein Bestimmungsversuch 14b
Fund: 25.10.2017, Herbar: R17-020, stand mir später zur Mikroskopie nur als Exsikkat zur Verfügung
- Anderer Fundort 350 müNN, MTB 5726, auch bei Buche und Fichte (aber nicht sonderlich beachtet), neben R. ochroleuca
- Einzelgänger mit anderen Farben, rauhe Hutoberfläche
- fellea-Geruch anstelle fruchtig
- verzögert leicht scharf anstelle sofort scharf
- SPP-FARBE: nach ROMAGNESI IIc - IId, anstelle IId - (IIIa)
- Sporen-Mittel 8,4 x 7,3 bei V=234 Q=1,16 (vorher bei qeletii 7,8 x 6,7 bei V=185 Q=1,16)
- Pileozystiden bis 12 µm breit, vorher 9(10) µm breit
Alles andere an Makro- und Mikrodaten sind für mich fast identisch gegenüber dem ersten Pilz.
(Soweit ich das als Laie überhaupt erkennen und beurteilen kann...)
Die Bilder zu diesem für mich nicht ganz geklärten Fund... (Bilder sind in Extra-Gross)
14) bei Buche und Fichte, Einzelexemplar fast ohne violett-Tönung, Hut 6cm, Frass-Stellen am Stiel gelblich-rötlich

15) Hut mehr rötlich, Mitte körnig-schwärzlich, Rand ganz schwach oliv?, Frass-Stellen rötlich, wachsartig, leicht glänzend

16) Huthaut 1/3 abziehbar, darunter rötlich, Rand nicht gerieft, Geruch stark wie bei R. fellea

17) Lamellen creme, blass-ocker, splitternd, wenige y-Gabel, Ammoniak auf Lamellen negativ

18) Stiel rötlich behaucht, gelbfleckig, weiss-schuppig, wachsartig, weich, im Schnitt wattig voll, keine Verfärbung

19) 400x, KOH + NH3, auch hier Pileozystiden sehr lang, unseptiert

20) 400x, KOH + NH3, mit viel längeren Verzweigungen und Ausstülpungen

21) 400x, KOH + NH3, apikal vielgestaltig

22) 400x, KOH + NH3, Pileozystiden breiter, bis 12 µm breit anstelle 9 µm

23) 400x, Sulfovanillin, Pileozystiden grau-schwarz eingefärbt, mit Ausstülpung

24) 400x, Sulfovanillin, auch mal kopfig, aber auch mal apikal eingeschnürt bis verengt

25) Sporen Vermessung in H2O(nat)

26) Grafische Darstellung der Sporenmessreihe

27) 1000x, Melzer, Ornament kräftig, meist isoliert mit zusammenfliessenden Warzen

28) 1000x, Melzer, Warzen überwiegend stumpf-keglig und um die 1,0 bis 1,2 µm hoch

FAZIT zu 14b:
Es spricht für mich vieles für Russula cf. fuscorubroides, aber auch teils für Russula queletii.
Mein Manko: Es hat mir noch keiner eine R. fuscorubroides gezeigt oder vorgestellt.
Zitat EINHELLINGER S. 85/86: "Glücklicherweise hat ROMAGNESI von dieser, wie er sie auch nannte, "kräftigeren und dunkleren Varietät" von q u e l e t i i wenigstens eine Skizze der HDS-Elemenre S 449 (Fig. 402) angefertigt. Ihr kann kann man entnehmen, daß die Pileozystiden sehr kräftig, ja sagar noch kräftiger als bei t o r u l o s a sind und eine Breite von 12 µm erreichen. Auch bei meinen beiden Kollektionen sind mir voluminöse (4) 6-12 (16) µm breite Pileozystiden aufgefallen und ich bin überzeugt, daß sie auch ein wertvolles Kriterium zur Abgrenrung darstellen." Ende Zitat
Ein Indiz für eine Russula fuscorubroides wäre es ja.
Vielleicht liege ich hier auch komplett verkehrt und das ist was ganz anderes...?
Hier komme ich an meine Grenzen und übergebe die Diskussion zähneknirschend an erfahrene Spezialisten weiter...
>>> Alle Beiträge dieser Serie findet ihr mit der Forum-Suchfunktion mit "Mein Täubling diese Woche:"
Danke für das Interesse... nächste Woche gehts weiter mit der Farbe gelb und bei weitem nicht so kompliziert.
Grüsse
claus
![]()
![]()


