Huhu.
Da es mich genervt hat, dass ich ständig irgendwelche "sensu lato"s und "cf" an meine Bestimmungen packen muss, dachte ich mir ich verwirre mich noch etwas mehr und stelle mir ein Mikroskop hin.
Ich habe in der Grundschule das erste und letzte mal mikroskopiert, beste Voraussetzungen also.
Mein erstes Problem auf das ich stoße: Die Kamera die dabei war ist wohl nicht so dolle. Jedenfalls sieht das Bild durchs Okular deutlich besser aus als das gecroppte auf dem Bildschirm. Die Kamera macht die Bilder ziemlich dunkel. Ich dachte die ist eine nette Beigabe, aber so richtig das Wahre scheint die nicht zu sein.
Hier mal ein paar Entoloma Sporen (40x) in destiliertem Wasser aus der Kamera:


Und hier die Bilder die ich einfach mit meinem billigen Handy durchs Okular geknipst habe (3x digitaler Zoom) - das kommt dem Bild was ich sehe schon näher:

Agrocybe Sporen in destiliertem Wasser (40x) - Kamera:

Handy:
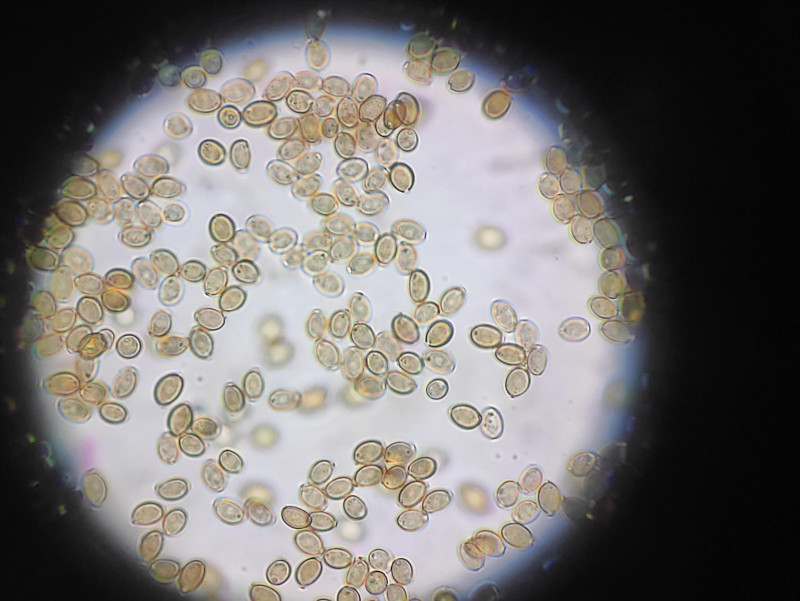
Ich wollte die Kamera gerne nutzen, um Sporen zu vermessen, da ich das manuell doch recht aufwändig fände und mir das als Einstiegsaufgabe in die Mikroskopie geeignet scheint. Denkt ihr die Kamerabilder reichen dafür? Oder sollte ich da lieber irgendwann nochmal Geld investieren für eine bessere? Gibt es empfehlenswerte Kameras zum Einstecken (habe nur ein Binocular)?
Dann würde ich erstmal nur Sporenformen angucken zum lernen, Färbekram muss ich aber auch noch besorgen (außer Melzers). So weit ich jetzt gelesen habe, muss ich zum Messen eh noch so ein Deckglas mit Maßeinheiten besorgen und das dann im entsprechenden Programm kalibrieren. Mit dem Handy kann ich ja nicht messen, da dann ja durch das Gewackel, den Winkel und den Zoom keine einheitliche Basis habe.
Und vlt. 'ne doofe Frage, aber ich habe es eben nicht gefunden bei der Suche: Misst man die Sporen (und Zystiden?) in der 40x Vergrößerung oder besser immer in der 100x Ölimmersion? Letztere habe ich noch nicht ausprobiert, da ich nachlesen muss wie man das richtig reinigt hinterher...da gehen die Meinungen scheinbar auch auseinander, aber Alkohol scheinen wohl viele zu nehmen.
Hier auch meine ersten kläglichen Schnittversuche. Als Frischpilz hatte ich nur noch einen Buchenwasserfuß im Kühlschrank, den ich jetzt zerschnibbelt habe. Keine Ahnung ob das richtig so war, ich hab's versucht möglich dünn zu bekommen und sehe glaube ich meine ersten Würstchensporen?
Kamera (40x):

Ich glaube ich habe an dem guten Stück auch meine ersten Zystiden entdeckt, entlang der seitlichen Lamellen müssten das seitlich Pleurozystiden und unten an der Schneide Cheilozystiden sein, wenn ich es richtig gelesen habe:
Handy-Schnappschuss (10x):


So viel erstmal von mir. Rechnet mit weiteren, dummen Fragen, denn ich weiß nicht was ich tue aber es ist spannend...Ich sitze jedenfalls schon ein paar Stunden vor meinen 3 Studienobjekten.
LG,
Schupfi.


