Hallo zusammen!
Anbei ein hübscher Fund, den ich schon lange erwünscht hatte.
Die Flechtenart, die aufgrund ihres Aussehens in fast keinem Flechtenbuch fehlt, ist makroskopisch unscheinbar.
Deshalb konnte ich sie erst zuhause unter dem Mikroskop erkennen.
Die Flechte zeichnet sich durch einen dünnen, grünlich weißen Thallus aus, der auf Ästen und Nadeln einer jungen Fichte zu finden war.

Bild 1 Habitat mit schütterem Baumbewuchs über Schieferschutt

Bild 2 Fichtenast mit Aufwuchs aus diversen Algen, Flechten und Moosen.
In der Hoffnung auf einen interessanten Fund wurde ein kleines Ästchen mitgenommen.
Insbesondere die bei reiner Inaugenscheinnahme undefinierbare Masse auf der Rinde des Astes ist interessant:

Bild 3 Flechte auf Rinde in Profil, mit 200-400 µm langen grünen Auswüchsen mit weißen Spitzen.

Bild 4 Hyphophoren mit weißen Spitzen

Bild 5 Trockener Thallus mit grünlichen Hyphopohren, schwerpunktmäßig auf der Rinde wachsend, aber auch über die gesamte Länge der Nadeln zu finden.
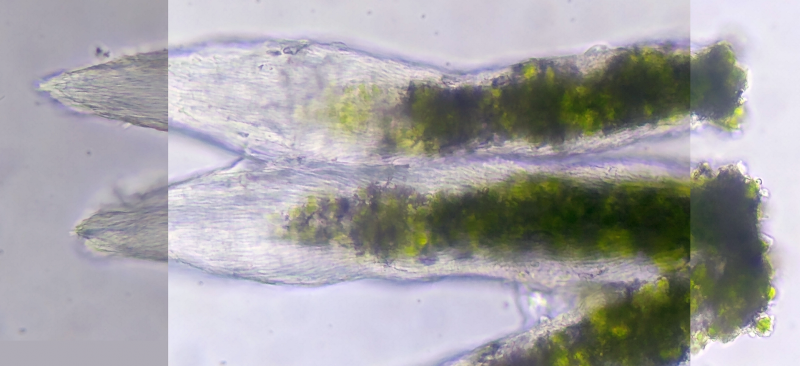
Bild 6 Spitz zulaufende, transparente, im unteren Abschnitt mit trebouxioiden Algen gefüllte Auswüchse in Wasser.
Die Hülle besteht aus parallelen Hyphensträngen, die zu einer durchsichtigen Spitze, ähnlich einer Pinselquaste, zusammenlaufen.
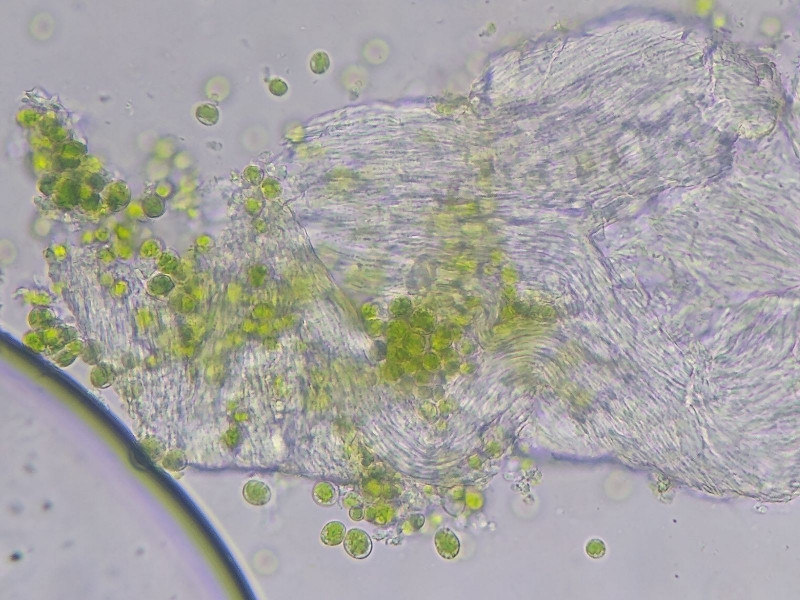
Bild 7 Diese Hyphophoren sind gefüllt mit einer gelartigen Masse aus Algenzellen und kleinen kompakten Konidien. Keine monifiliforme Hyphen an der Außenseite.
Beim Schlüsseln lernt man, dass es zwei habituell ähnliche Arten gibt:
Gyalectidium setiferum (die "Igel-Tannennadelflechte"), kommt hierzulande auf Tannen-, selten auf Fichtennadeln vor, außerhalb Deutschlands besonders gerne auf den Blättern von Bux und Kirschlorbeer.
Die Hyphophoren (Stachel, "Thlasidien") dieser Art sind sind gänzlich durchsichtig / weißlich.
Sie sind 300-500 µm lang und bilden basal an deren Außenseite perlkettenartige Hyphen-Algen Gemenge, die der Ausbreitung dienen.
Das ist hier nicht der Fall, die Stachelchen sind hingengen in der unteren Hälfte mit Algen und Konidien (2 x 1-1,5 µm ?) gefüllt, wodurch sie grün erscheinen.
Diese Eigenschaft und das Vorkommen auf Fichtenrinde und -nadeln passt lt. Wirth-Hauck-Schultz genau zu Jamesiella anastomosans, der "Dorn-Firnisflechte", die demnach hier vorliegen sollte.
Die Hyphophoren dieser Flechtenart besitzen eine ähnliche Höhe, wirken auf Abbildungen etwas kompakter; insbesondere die grüne Basis mit weißer Spitze ist für die Art charakteristisch.
Beide Arten bevorzugen feucht-warme, ozeanische Lagen.
Die derzeitige Klimaänderung unterstützt offenbar die Ausbreitung beider Flechtenarten.
LG, Martin




