Hallo zusammen, liebe Ditte
Ich habe mal wieder drei Risspilze. Bei den ersten zwei habe ich mir die Zähne ausgebissen.
Trotz aller Mühe finde ich keine Art die mir wirklich zu passen scheint. Ich könnte hier jetzt irgendwelche Namen hinschreiben, aber das bringt nichts wenn ich ohnehin weiss dass es falsch ist.
Also bleibt mir wieder einmal nur die Hoffnung auf Ditte's weisen Rat.
1:
Habitat: Unter Fichten auf Kalk.
Geruch: Spermatisch

FK klein aber von eher kompaktem Habitus. Der grösste Hut hatte einen Durchmesser von 1.5 cm.
Jung mit deutlichen, weissen Velumresten.
Hutmitte kahl und schwach gebuckelt.

Stiel weiss überfasert, bei Berührung kommt die rötlichbraune Farbe darunter zum Vorschein.

Schnittbild
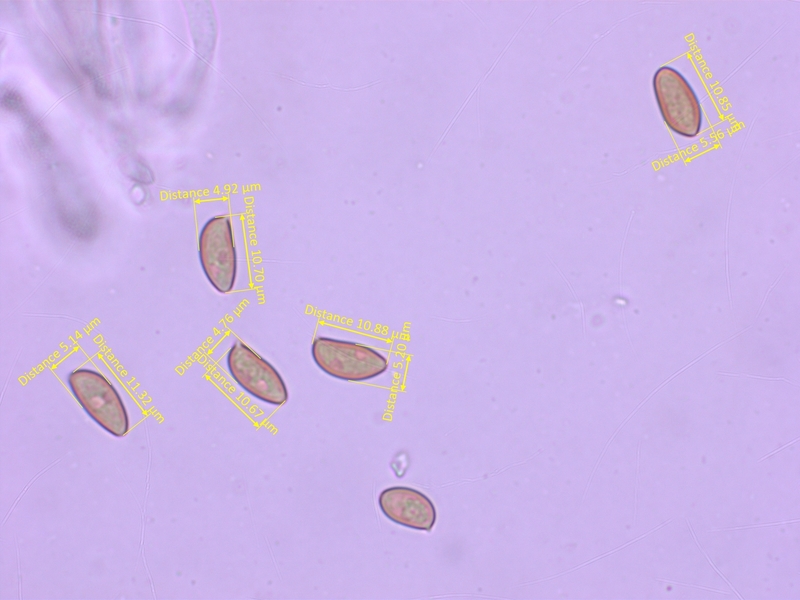
Sporen meistens recht schlank: 10.2-11.3-12.3 x 4.6-5.2-5.9 µm, Q = 1.95-2.18-2.43 (n=20)


Cheilozystiden fast immer mit Kristallen, in KOH nur schwach gelblich, mässig dickwandig. Parazystiden vorhanden.
50-56-66 x 13-14.5-17 µm (n=8)

Pleurozystiden ähnlich
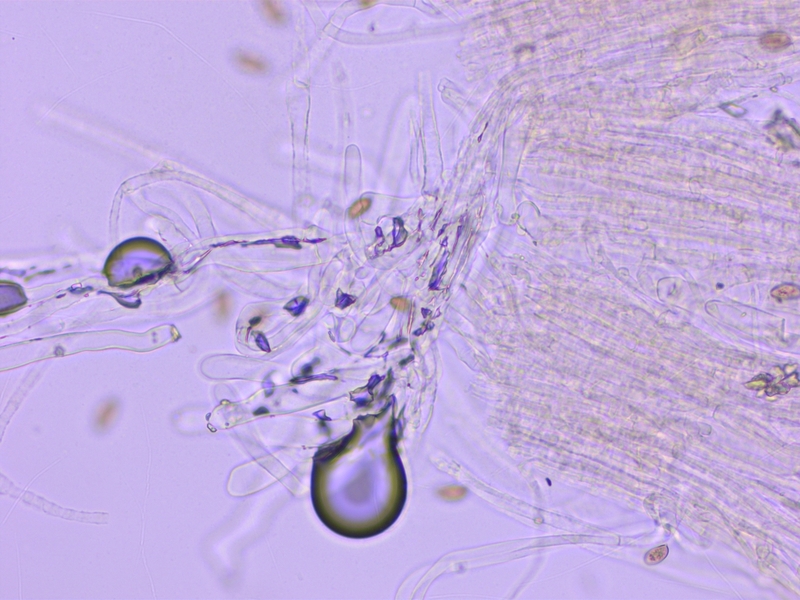
Kaulozystiden nur im obersten Viertel vorhanden und auch dort spärlich und nur angedeutet metuloid-kristallisiert.
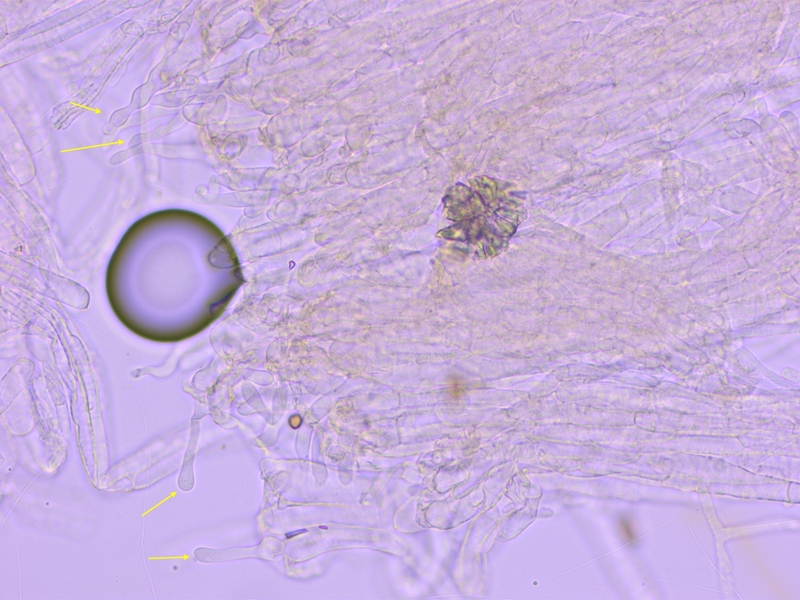
Zudem fielen mir im oberen Stieldrittel spezielle Hyphenenden auf, ich weiss nicht ob das relevant ist.
Sie waren schlank keulig, rostrat oder moniliform.
[trennlinie][/trennlinie]
2:
Habitat: Bei Fichten und Kiefern auf Kalk. In der Nähe gab es auch einzelne Birken.
Geruch: Spermatisch

Auch diese Fruchtkörper sind sehr klein, kaum über 1 cm Hutdurchmesser. Aber insgesamt schlanker im Habitus.



Sporen : 9.5-10.4-11.6 x 6.1-6.5-7.0 µm, Q = 1.45-1.61-1.85 (n=20)
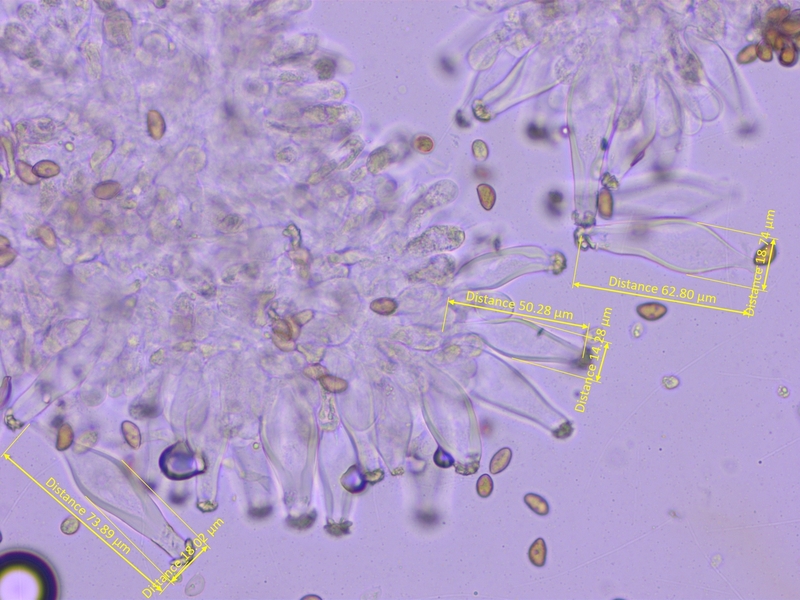
Cheilozystiden mit teils recht langem Fuss, recht dickwandig, in KOH blassgelb, oft irgendwie verbogen. Parazystiden vorhanden.
Abmessungen: 50-65-75 x 14-17.5-19 µm (n=10)

Viele Zystiden mit auffälligem "Sand" unter dem Kristallschopf.

Pleurozystiden ähnlich

Kaulozystiden im oberen Stieldrittel zahlreich, darunter fehlend.
[trennlinie][/trennlinie]
3:
Hier habe ich zumindest eine plausible Vermutung, nämlich ganz einfach Inosperma erubescens. Oder gibt es eine Art die so rötet?
Ganz sicher bin ich mir aber nicht, weil die Sporen etwas kürzer sind als in den Beschreibungen und weil die Zystiden nicht rein keulig sind.
Gut möglich, dass das in der Variationsbreite der Art liegt.
Habitat: Gemischt mit Kollektion 2, also bei Fichten und Kiefern sowie etwas entfernten Birken.
Geruch: komplex mit fruchtigen, aromatischen und spermatischen Komponenten



Sporen: 10.9-11.9-12.7 x 6.6-7.1-7.9 µm, Q = 1.38-1.69-1.90, oft phaseoliform.

Cheilozystiden 45-55-65 x 8-13-15 µm (n=5)
Die meisten keulig, aber auch einige schwach kopfig oder birnenförmig.

Kaulozystiden an der Stielspitze
Viele Grüsse
Raphael


