Hallo zusammen
Ab Freitag drohen hier Schnee und Frost, deshalb war ich gestern noch einmal auf Pilzjagd. Es gab ein paar erfreuliche Sachen:
Zunächst war ich im nahegelegenen Föhrenwald.
1:

Ich weiss, dass ihr alle Trichterlinge liebt.
Dieser hier ist typisch mit dem genabelten Hut und den deutlich helleren, aber nicht weissen Lamellen: Clitocybe barbularum.
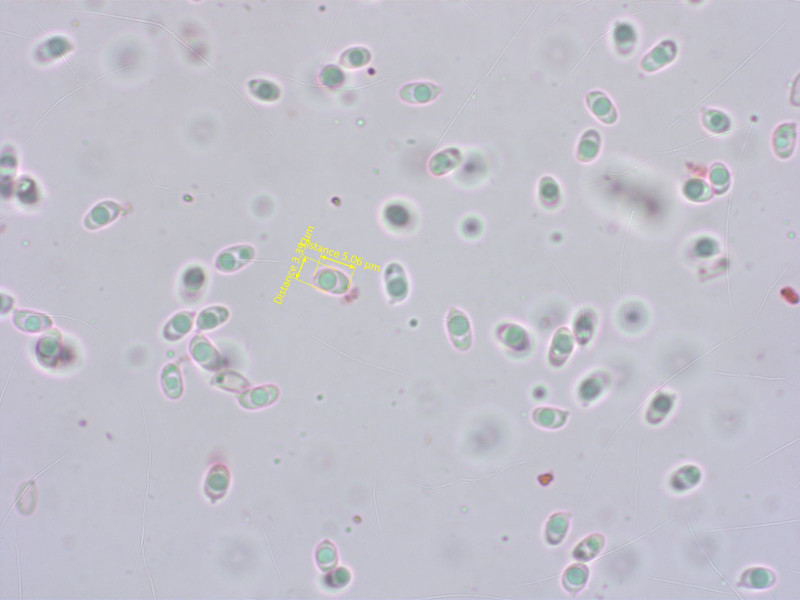
Sporen... naja, was soll ich dazu schreiben. Sporen halt.
HDS schwach intrazellulär pigmentiert, stellenweise aber auch fein inkrustiert.
2:

Ich will mir jetzt ab und zu auch ein paar Aphyllophorales anschauen. Der hier ist typisch für Kiefernwälder: Irpicodon pendulus.

Von unten sieht er aus wie leuchtende Lampenschirme.
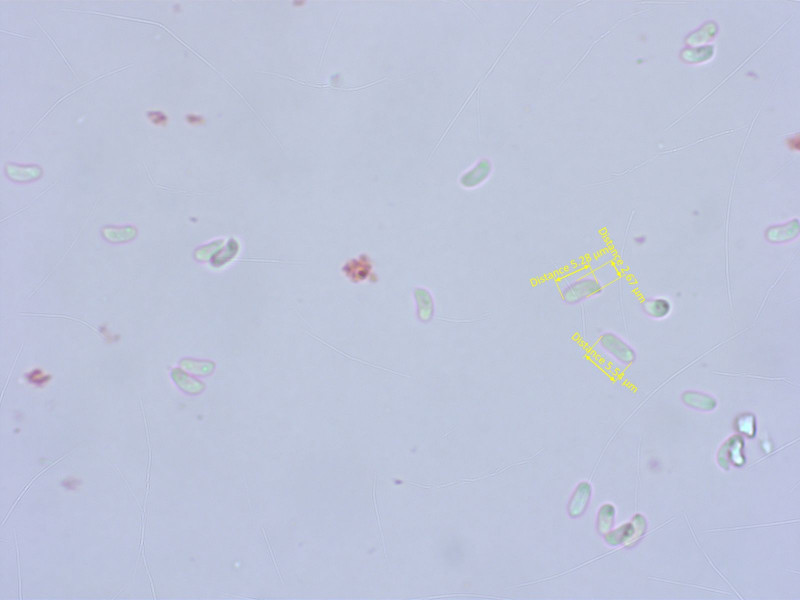
Die Sporen sind klein, schmal und etwas allantoid.
3:

Eine Kruste... bisher habe ich immer die Flucht ergriffen, wenn ich sowas sah. Aber eigentlich machen die Spass.
Diese Kruste hier heisst Peniophorella pubera.

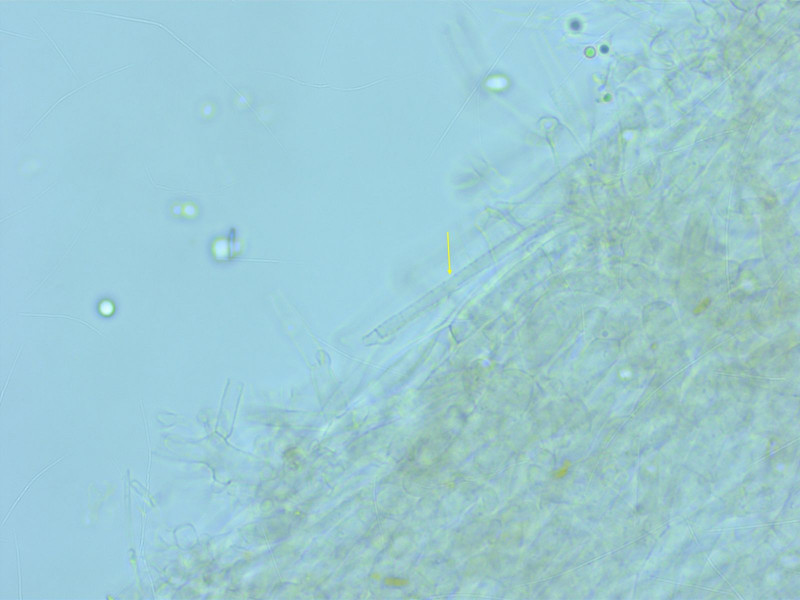
Was am Holz langweilig aussieht, ist unter dem Mikroskop umso schöner: Riesige, kristallisierte Lamprozystiden (hier in SV)
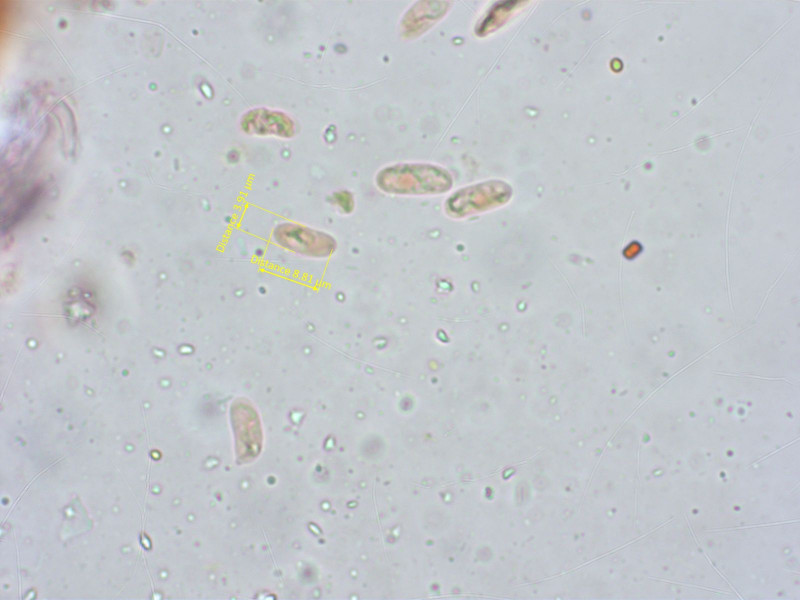
Sporen schlank und schwach gebogen.
Im Anschluss ging ich noch in die Sandfelder am Rhoneufer. Hier gab es zwei schöne Sachen:
4:

An dunkler Nabeling zwischen Pionier-Vegetation. Arrhenia obscurata.
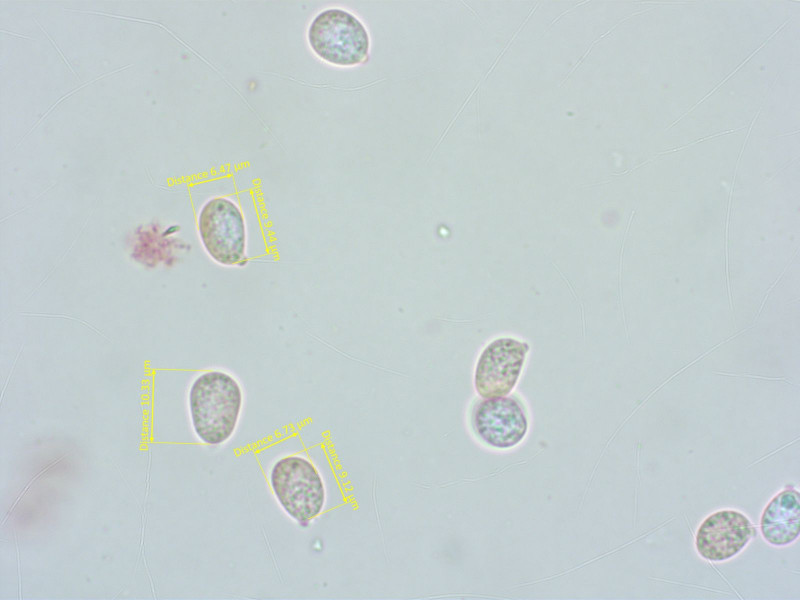
Sporen...

HDS wie bei Nabelingen üblich grob inkrustiert.
5:

Dieser schäbige, dreckige Pilz ist eigentlich eine kleine Sensation. Im Feld wusste ich nicht recht was es sein soll.

Aber wenn man genau schaut, sieht man dass die Huthaut wohl hymeniform ist, das grenzt die Sache schon mal ein.
Die Mikroskopier-Arbeit war eine Herausforderung, es war fast unmöglich ein Stückchen Pilz völlig vom Sand zu befreien.
Nach etlichen zerbrochenen Deckgläsern habe ich es aber schlussendlich geschafft.
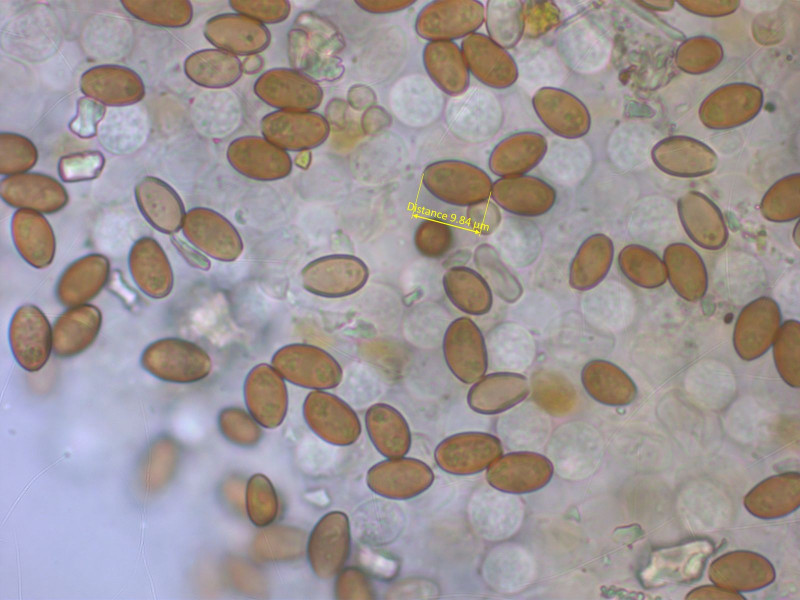
Dickwandige Sporen mit Keimporus sind schon mal ein gutes Indiz für Conocybe.
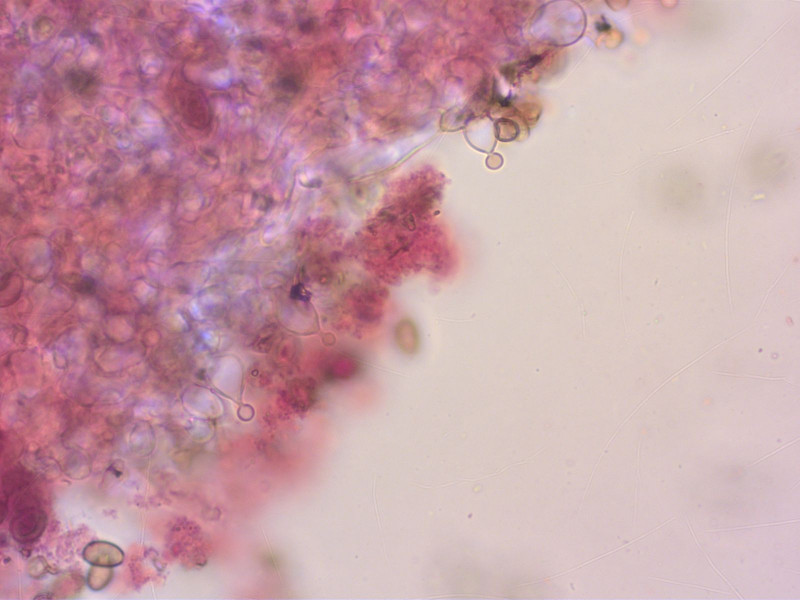
Die gattungstypischen Cheilozystiden habe ich schliesslich auch finden können.
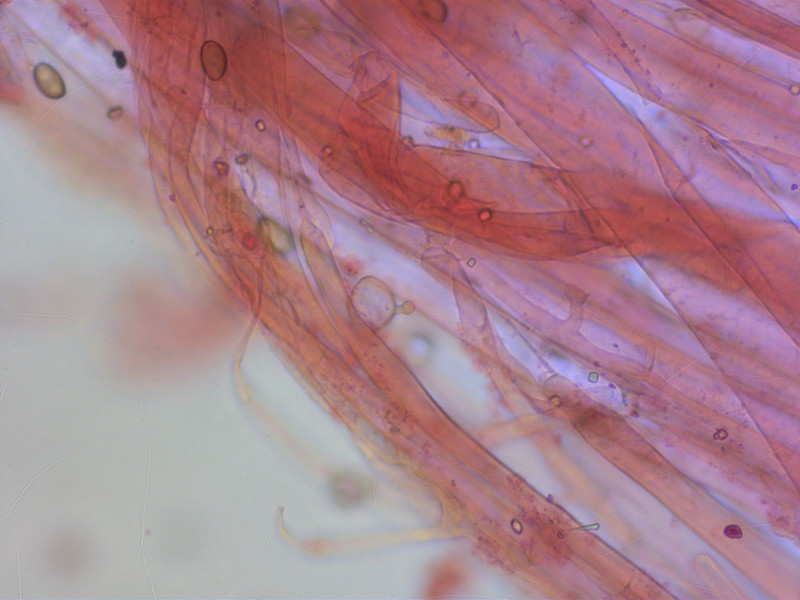
Am Stiel-Apex gab fast ausschliesslich leythiforme Kaulozystiden.
Nach FE11 kommt man ohne Alternative auf Conocybe sabulicola. Laut GBIF bisher nur in Italien und Grossbritannien nachgewiesen 
6:
Den schmuggele ich jetzt mal hier rein, habe ihn aber eigentlich vor zwei Wochen gefunden.
Auf 1400m, am Ufer eines Bergsee unter Salix.

Ein kleiner Fälbling, der offenbar auch ziemlich selten ist (oder einfach ignoriert wird): Hebeloma salicicola.
Dank des KI-Bestimmungstools auf hebeloma.org ist die Bestimmung von Fälblingen deutlich einfacher geworden.
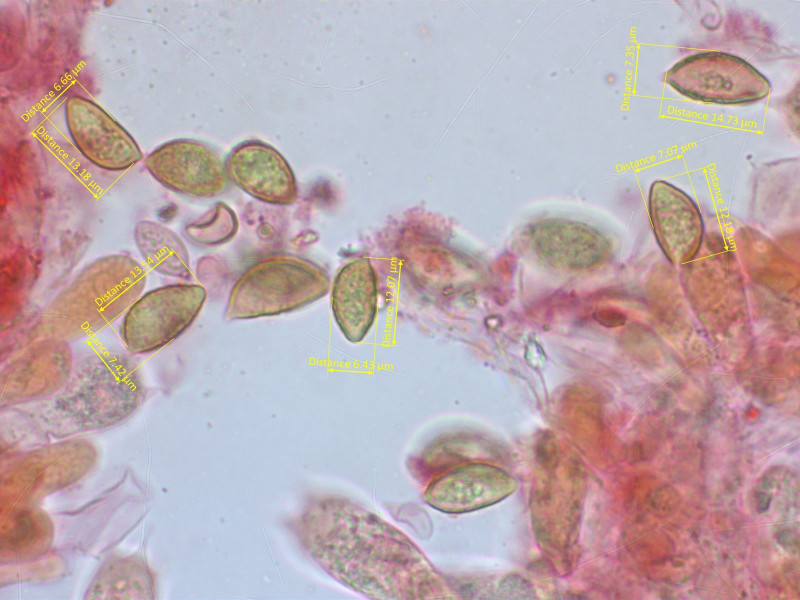
Sporen moderat warzig (O2), schwach dextrinoid (D1-2), Perispor selten ablösend (P0-1)
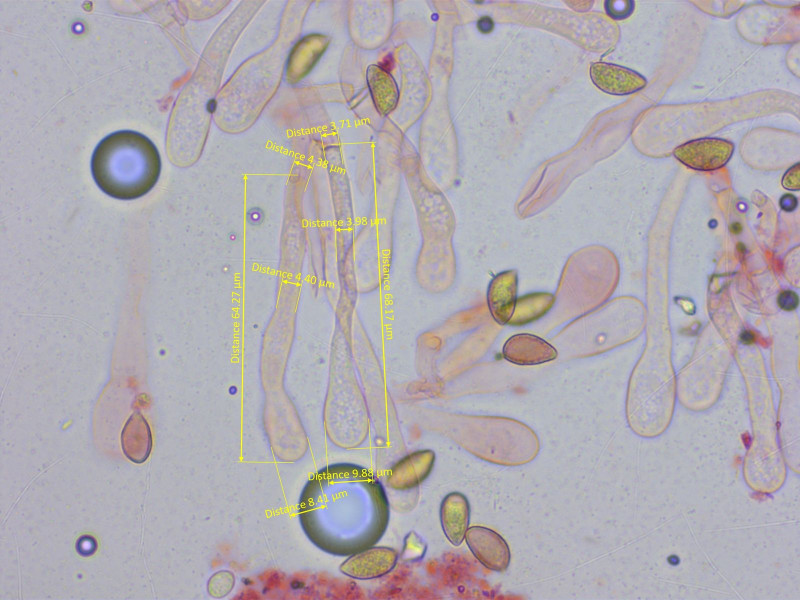
Zystiden schlank keulig.
Nun hoffe ich, dass es nochmal ein wenig wärmer wird, ansonsten ist die Saison hier leider vorbei...
Viele Grüsse
Raphael


