09.09.2017:
Viele Erstfunde, schwer Bestimmbares und Leckereien - Teil 2
Hallo Pilz-Freunde,
dies ist Teil 2 des Berichtes vom 09.09.2017.
Teil 1 findet Ihr hier
Teil 3 findet Ihr hier
Und weiter geht's...
Fundnummer:
2017-09-09-1405
Die Art finde ich nicht sehr oft, hier aber in Massen. Auch wenn wegen Maden
nicht so viel für die Pfanne blieb, die Fotos verderben einem die Viecher
wenigstens nicht.
Edel-Reizker (Lactarius deliciosus):

☻

☻

☻

☻

☻

☻
Fundnummer:
2017-09-09-1412
Morphologische Daten:
Fundort: ca. 550 müNN. ca. N50, O12, bei
Birke und Kiefer
Fundzeit: 09.09.2017
Wuchsform:
einige am Standort
Hutform:
schwach konvex bis flach, verbogen
Huthaut:
braun, nach außen hin deutlich heller werdend,
unter Lupe netzartig gefasert, etwas klebrig
Huthaut-Abziehbarkeit:
1/2 abziehbar
Hygrophanität: nicht untersucht
Hutrand:
ist zwar nicht gerippt aber aber die Durchscheinenden Lamellen lassen es so
aussehen, kantig
Lamellen:
gelblich,
Zwischenlamellen
Lamellenschneiden:
bräunlich, braunfleckend
Lamellen-Stielübergang:
fast ausgebuchtet angewachsen aber eher gerade
Stiel:
bräunlich längs überfasert, oben bereift, keulig aber Basis spitz zulaufend,
längsfaserig, hohl
Stielbasis:
spitz
zulaufend
Fleisch:
im Stiel hellgelb mit bräunlichem Zentrum, im Hut weiß mit bräunlichem Zentrum
Größe: Hutdurchmesser ca.
6-9 cm,
Stiellänge ca.
5-7 cm
Stieldurchmesser
an der dicken Stelle 1,2-2 cm
Sporenpulverfarbe:
rein weiß
Geruch:
unzerrieben & zerrieben: mehlig
Geschmack:
mehlig, unangenehm, ganz leicht bitterlich
Wegen er Hutrandrippung, dem Geschmack und dem Geruch ist das der
Gelbblättrige Ritterling (Tricholoma fulvum):

☻

☻

☻
Fundnummer:
2017-09-09-1431
Auch ein wunderbarer Erstfund für mich:
Violetter Becherling (Peziza violacea):

☻

☻
Asci:
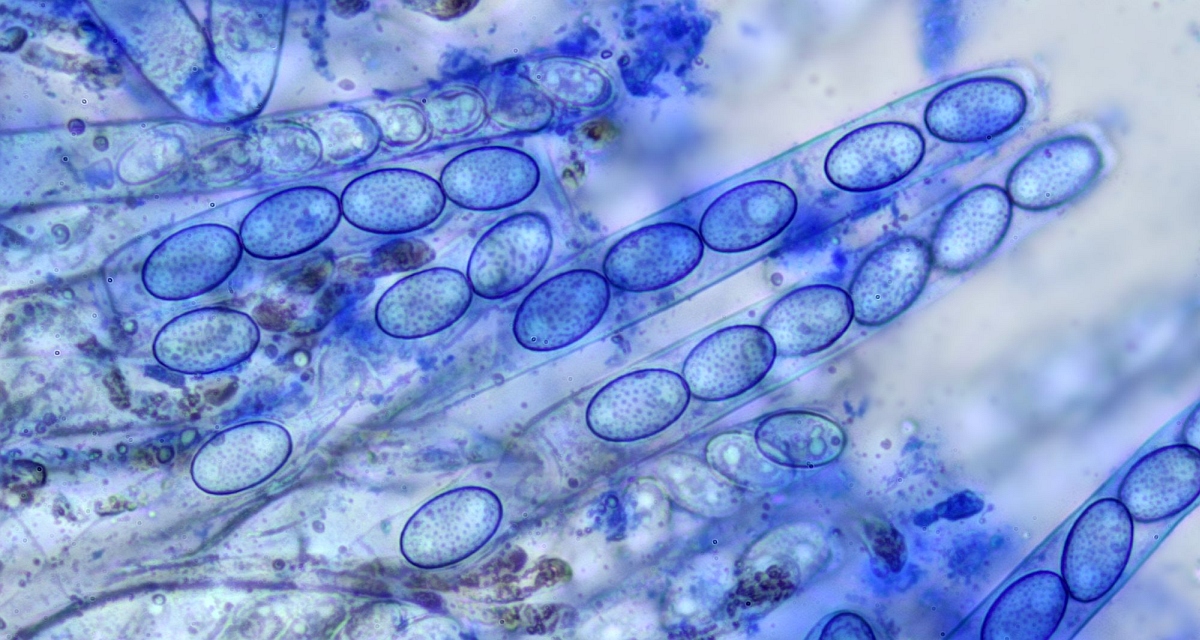
☻
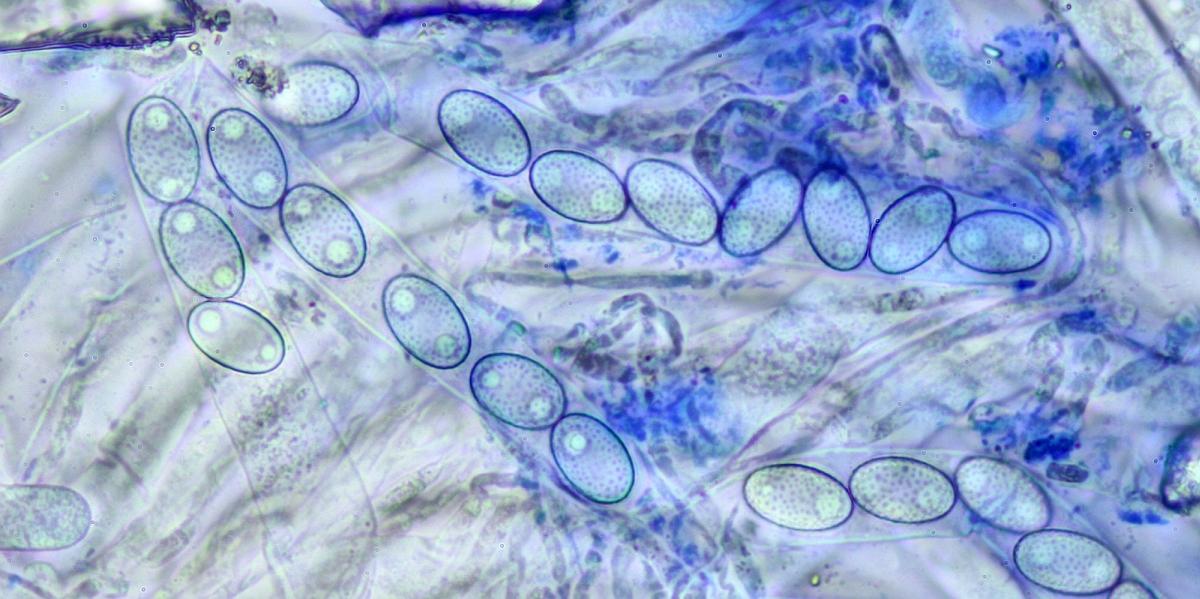
☻
Fundnummer:
2017-09-09-1437
Morphologische Daten:
Fundort: ca. 550 müNN. ca. N50, O12, bei
Fichte und Birke
Fundzeit: 09.09.2017
Wuchsform:
gesellig
Hutform:
konvex
Huthaut-Konsistenz:
glatt, etwas glänzend
Huthaut-Farbe:
fleischrosa bis zu grauweiß ausgeblasst, glänzend,
Huthaut-Abziehbarkeit:
1/4 bis 1/3 abziehbar
Fleischfarbe unter Huthaut:
rosa
Hut-Fraßstellen-Rand-Verfärbung:
keine vorhanden
Hutrand:
kantig,
nicht gerieft
Lamellen:cremeweiß,
mit Zwischenlamellen
Lamellenschneiden: ohne Besonderheiten
Lamellensprödigkeit:
nicht besonders spröde
Lamellen-Stielübergang:
gerade angewachsen
Stiel:
weiß,
leicht grauend,
etwas runzelig,
etwas keulig,
voll, nicht wattig ausgestopft
Stielbasis:
rund
Fleisch: ohne Besonderheiten
Größe:
Hutdurchmesser
bis 5 cm,
Stiellänge 2-4 cm, Stieldurchmesser ca. 7-12 mm
Sporenpulverfarbe:
am ehesten:
IId im direkten Vergleich mit der Marxmüller-Tafel,
IIIa im direkten Vergleich mit der
Romagnesi-Tafel
Geruch:
absolut neutral
Geschmack:
scharf aber erträglich und scharf bleibend
Makrochemische Reaktionen:
Guajak:
nach 20 Sek. blaugrün, nach 25 sek. stark
blaugrün
Anilin pur: keine Reaktion
Eisensulfat FeSo4: keine Reaktion
Phenol:
nach 2 Minuten blass-rosa, nach 5 Minuten weinrot
KOH 40%: keine Reaktion
Nicht häufig bei uns: der
Verblassende Täubling (Russula exalbicans):

☻
Fundnummer:
2017-09-09-1510
Morphologische Daten:
Fundort: ca. 550 müNN. ca. N50, O12, bei
Birke und Weide auf Laubstreu und Ästchen
Fundzeit: 09.09.2017
Wuchsform:
gesellig bis büschelig
Hutform:
Mitte vertieft
Huthaut:
cremeweiß, mit rosa Schimmer, matt, trocken
Hutrand:
gerieft, mehlig bereift, flattrig, kantig, feinst eingerollt
Lamellen:
cremeweiß, sehr viele Zwischenlamellen, sichelförmig
Lamellenschneiden:
vollkommen glatt auch unter der Lupe
Lamellen-Stielübergang:
herablaufend
Stiel:
weiß und rosalich, innen etwas weichlich ausgestopft
Stielbasis:
weiß, stark myzelfilzig, rund bis etwas spitz zulaufend
Fleisch:
weiß, ganzer Pilz sehr elastisch gummiartig
Größe:
Hutdurchmesser
2-5 cm,
Stiellänge ca. 3 cm, Stieldurchmesser ca. 5 mm
Sporenpulverfarbe:
rein weiß
Geruch:
am Fundort: nur pilzig, zuhause: pilzig und etwas süßlich fruchtig
Geschmack:
sehr stark irgendwie "nicht gut pilzig ranzig"
Auch ein sehr schöner Erstfund:
Weißer Holztrichterling (Clitocybe truncicola):

☻

☻

☻

☻

☻

☻
Fundnummer:
2017-09-09-1526
Morphologische Daten:
Fundort: ca. 550 müNN. ca. N50, O12, bei
Pappel, Birke, Weide und Fichte
Fundzeit: 09.09.2017
Wuchsform:
einige am Standort
Hutform:
kugelig bis konvex
Huthaut:
graubraun, samtig
Hutrand: ohne Besonderheiten
Röhren:
grau-cremefarben, auf Druck: verfärben zu grau
Stiel:
schwärzliche Flocken auf weißem Grund,
keulig
Stielbasis:
rund,
Fraßstellen blau
Fleisch-Verfärbung:
nach 2 Minuten im Hutfleisch rosa-rötlich und im Stiel und Basis tut sich
zunächst nichts, nach 40 Minuten: Violett im Hutfleisch und nach unten rötlich
Geruch:
im Schnitt harzig
Der
Pappel-Raufuß (Leccinum duriusculum):

☻

☻
Hier seht ihr mal die Verfärbung im Fleisch:

☻

☻

☻
Fundnummer:
2017-09-09-1539
Voucher:
DW201709091539
Matthias schrieb dazu im Jahr 2017:
Dieses braune Graublatt ist für mich aktuell nicht bestimmbar. Mit der
Sporengröße kann man alles ausschließen. T. cessans kommt noch hin, aber auch
für den sind die Sporen zu klein, zu länglich und es fehlen die Zystiden. Das
was ich optisch gedacht hätte (inolens/boudieri) hätte alles deutlich größere
Sporen, der hier hat Sporen konstant unter 6µm Länge.
Im Jahr 2023 kamen wir dann endlich dazu die Sequenzierung zu
machen.
Hier der verkürzte Bericht dazu:
Auswahl der Loci für die Sequenzierung
Die Familie Lyophyllaceae ist nur
lückenhaft phylogenetisch geklärt. Es sind kaum Sequenzdaten für die höhere
Phylogenie vorhanden. Allerdings liegen bereits einige Sequenzdaten für die
niedere Phylogenie vor. Manchmal reicht die Aufnahme der ITS1/2 aus, manchmal
nicht.
Deshalb wurde zu Beginn nur die ITS1/2 sequenziert. Als Primer wurde zunächst
der ITS4 Primer verwendet, welcher auch funktionierte.
Prüfung der Rohdaten
Nach der DNA-Extraktion, Amplifikation und Sequenzierung lagen die Rohdaten als
Rückwärtssequenz vor.
Das Reverse Complement der Rohdaten wurde zunächst optisch am ITS Chromatogramm
geprüft:
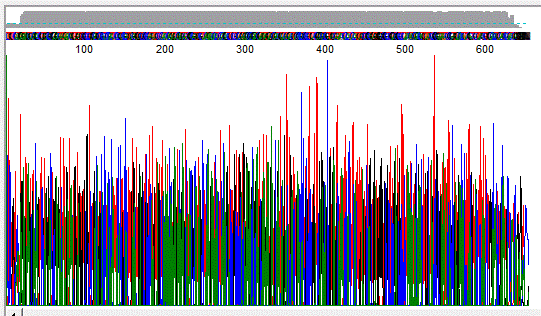
Es lag keine Dachschräge und kein kein sudden drop vor, der Verlauf war
einwandfrei.
Anhand der Confidence Scores der Rohdaten wurden unsichere Sites ermittelt:
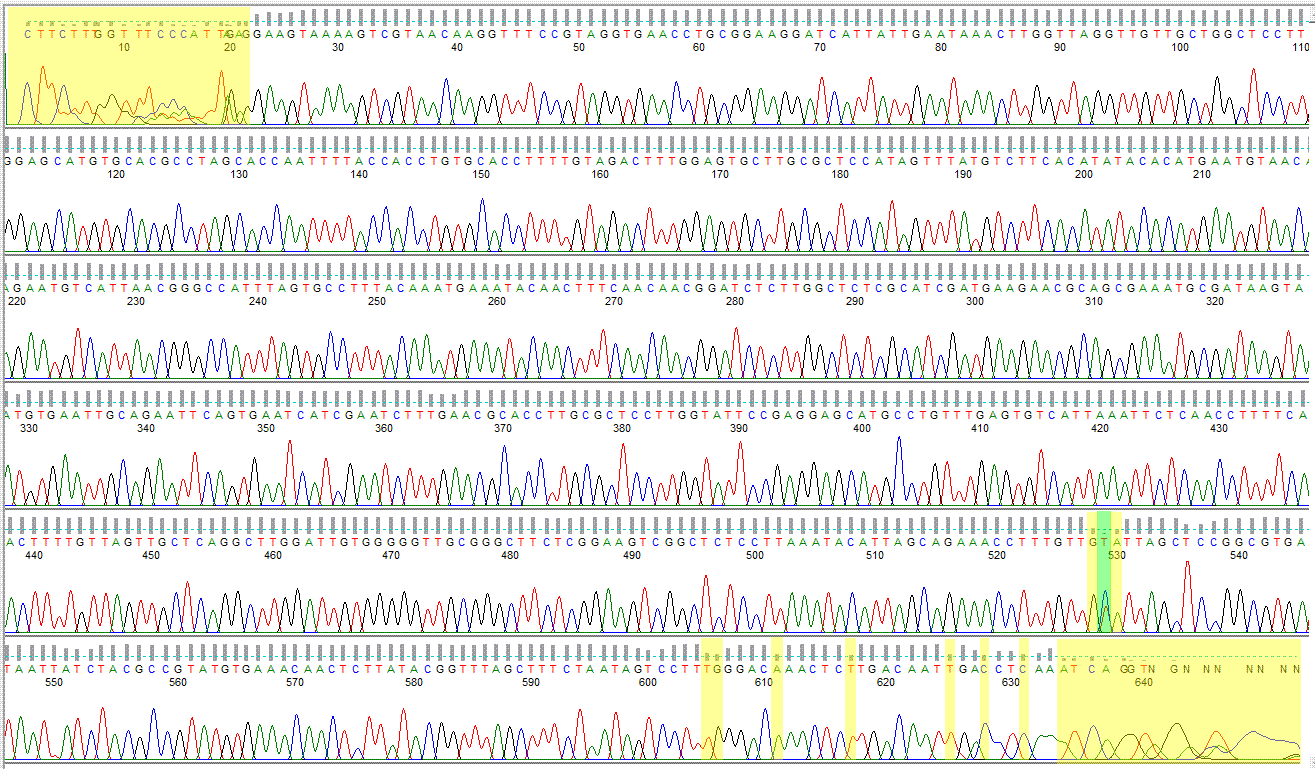
Die gelben Bereiche sind schlechte Confidence-Scores.
Die grünen Bereiche sind potentielle Polymorphe.
Diese Sites müssen geprüft werden (siehe nachfolgend).
ITS-Sequenzsammlung
Die ITS-Sequenzsammlung wird um Zeit zu sparen gleich für folgende
Analyse-Schritte durchgeführt:
-
Sequenzsammlung für Divergenzmatrix
-
Sequenzsammlung für die Ingroup
-
Sequenzsammlung für die Outgroup
- Sequenzsammlung
der Environmental Samples
Quellenauswahl für die Sequenzsammlung: Die
ITS-Sequenzen werden gesammelt von NCBI und Unite.
Es wurden insgesamt 1200 ITS-Sequenzen gesammelt. Davon 745 von Environmental
Samples. In der Ingroup verblieben am Ende aber nur 17 und in der Outgroup nur
3. Die große Menge war für die nachfolgenden Prüfungen erforderlich und wurde
dann weiter auf die Menge für das finale Phylogramm reduziert.
Prüfung und Korrektur der Rohsequenz und Basecalling
Für die Divergenz-Matrix konnten alle Sequenzen der Ingroup verwendet werden.
Als Alignisierungs-Software wurde Mafft Version 7.520 gewählt. Als
Aliginisierung-Strategie wurde FFT-NS-2 welche für die Divergenz-Matrix völlig
ausreicht.
Das Ergebnis der Prüfung der Rohsequenz:
Anfang: CTTCTTTGGTTTCCCA muss gelöscht werden; TTAGAG ist korrekt.
Site 528: korrekt – ist ein G
Site 529: Ist ein Problem. T kommt nicht vor in der kompletten Matrix, C kommt
bei naheliegenden vor. In den Environmentals fehlt die Base weil zu kurz. Da
unklärbar, Polymorph, C oder T. Polymorph – geändert auf Y
Site 530: korrekt – ist ein A
Site 605: korrekt – ist ein T
Site 606: korrekt – ist ein G
Site 611: korrekt – ist ein A
Site 625: korrekt – ist ein T
Site 628: korrekt – ist ein C
Site 631: korrekt – ist ein C
Ende: Nur NGNNNNNNN muss gelöscht werden, Rest ist OK
Die finale ITS-Sequenz des Fundes lautet somit:
>DW201709091539_final
TTAGAGGAAGTAAAAGTCGTAACAAGGTTTCCGTAGGTGAACCTGCGGAAGGATCATTATTGAATAAACTTGGTTAGGTT
GTTGCTGGCTCCTTGGAGCATGTGCACGCCTAGCACCAATTTTACCACCTGTGCACCTTTTGTAGACTTTGGAGTGCTTG
CGCTCCATAGTTTATGTCTTCACATATACACATGAATGTAACAGAATGTCATTAACGGGCCATTTAGTGCCTTTACAAAT
GAAATACAACTTTCAACAACGGATCTCTTGGCTCTCGCATCGATGAAGAACGCAGCGAAATGCGATAAGTAATGTGAATT
GCAGAATTCAGTGAATCATCGAATCTTTGAACGCACCTTGCGCTCCTTGGTATTCCGAGGAGCATGCCTGTTTGAGTGTC
ATTAAATTCTCAACCTTTTCAACTTTTGTTAGTTGCTCAGGCTTGGATTGTGGGGGTTGCGGGCTTCTCGGAAGTCGGCT
CTCCTTAAATACATTAGCAGAAACCTTTGTTGYATTAGCTCCGGCGTGATAATTATCTACGCCGTATGTGAAACAACTCT
TATACGGTTTAGCTTTCTAATAGTCCTTTGGGACAAACTCTTGACAATTGACCTCAAATCAGGT
GenBank Eintrag
Die Sequenz wurde bei GenBank hinterlegt:
Tephrocybe confusa voucher DW201709091539 small subunit ribosomal RNA - Nucleotide - NCBI
Vorprüfung, Aussortierung und Erstellen des finalen Alignments
Der
Fund landet in eine Klade die zwar phylogenetisch klärbar ist, aber noch nicht
korrekt kombiniert ist. Wir überlegten, ob wir diese Klärung in Zuge der
Fundanalyse machen. Zur eindeutigen Klärung müsste ein Supertree berechnet
werden. Er zeitliche Aufwand ist so groß, dass wir dies derzeit nicht angehen
können. Wir beschränkten uns deshalb auf die reine Fundbestimmung.
Entsprechend haben wir den sehr großen Baum auf die minimal nötige Klade
beschränkt und 3 Taxa für die Outgroup belassen.
Die verbleibenden Sequenzen wurden neu aligined mit Prank (ohne Switches).
Folgende Liste zeigt die verbleibenden Sequenzen im Alignment:
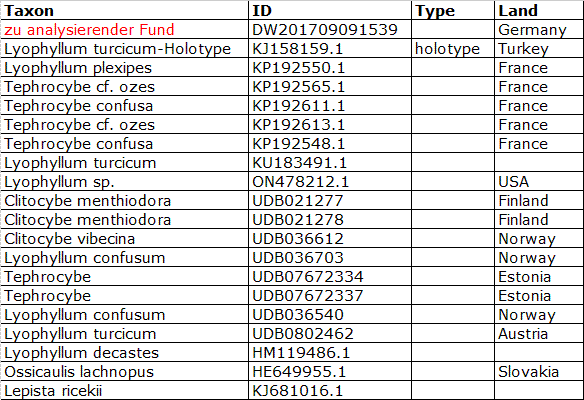
Gap-Coding
Für
das Gap-Coding wurden die Indel-Matrizen gecoded.
Für
die vorliegende Studie wurde das SIC-Verfahren „Simple Indel Coding“ gewählt.
Als Codiersoftware wurde SeqState gewählt.
Partitionierung
Für
diese sehr einfach Studie wurde die ITS nicht weiter partitioniert. Es wurden
also nur 2 Partitionen verwendet
Phylogrammberechnung
Das
finale Phylogramm wurde mit RAxMLberechnet.
Evolutionsmodell DNA: GTR+G
Evolutionsmodell Indels: BINARY+G+A
Correct for Ascertainment bias: Ja, nach Paul Lewis
Finales Phylogramm
Der
berechnete best tree wurde übersetzt und gerootet an der finalen Outgroup. Die
Knoten <50% wurden kollabiert. Die Outgroup wurde ebenso kollabiert.
Finales Ergebnis:

Bestimmung des Fundes und Hinweis zu den noch fehlerhaften Gattungsnamen
Da
die Klade in der sich der Fund befindet sich phylogenetisch deutlich von den
anderen trennen lässt kann der Fund eindeutig zugeordnet werden.
Allerdings kann "Tephrocybe"
confusa nicht zur Gattung Tephrocybe gehören, genauso wie "Lyophyllum" turcicum
nicht zu Lyophyllum gehört. Dies ist deshalb so, weil der phylogenetische
Abstand zu hoch ist, sich eine große Deletion in der Klade /confusa befindet und
die Kladen durch andere Gattungen (z.B. Hypsizygus, Atractosoprocybe und
Leucocybe) eben von Tephrocybe und Lyophyllum abgetrennt sind.
Wir belassen die Namen so, weil sie derzeit so gültig sind. Vielleicht findet
jemand mal die Zeit um hier eine Neuordnung anzugehen.
Unabhängig davon ist jedoch eine Sache sicher: Alle Funde in der Klade sowie
unser Fund sind nur eine einzige Art. Ohne den Typus von "Tephrocybe" confusa
sequenziert zu haben ist der Name der Klade zwar nicht 100% sicher aber sehr,
sehr wahrscheinlich. Wir können unseren Fund also guten Gewissens "Tephrocybe"
confusa benennen.
Und
hier seht Ihr nun den Fund: Dickstieliges
Graublatt ("Tephrocybe" confusa):

☻

☻
HDS - genauer: Hauptsächlich die Schichten unterhalb der eigentlichen HDS:
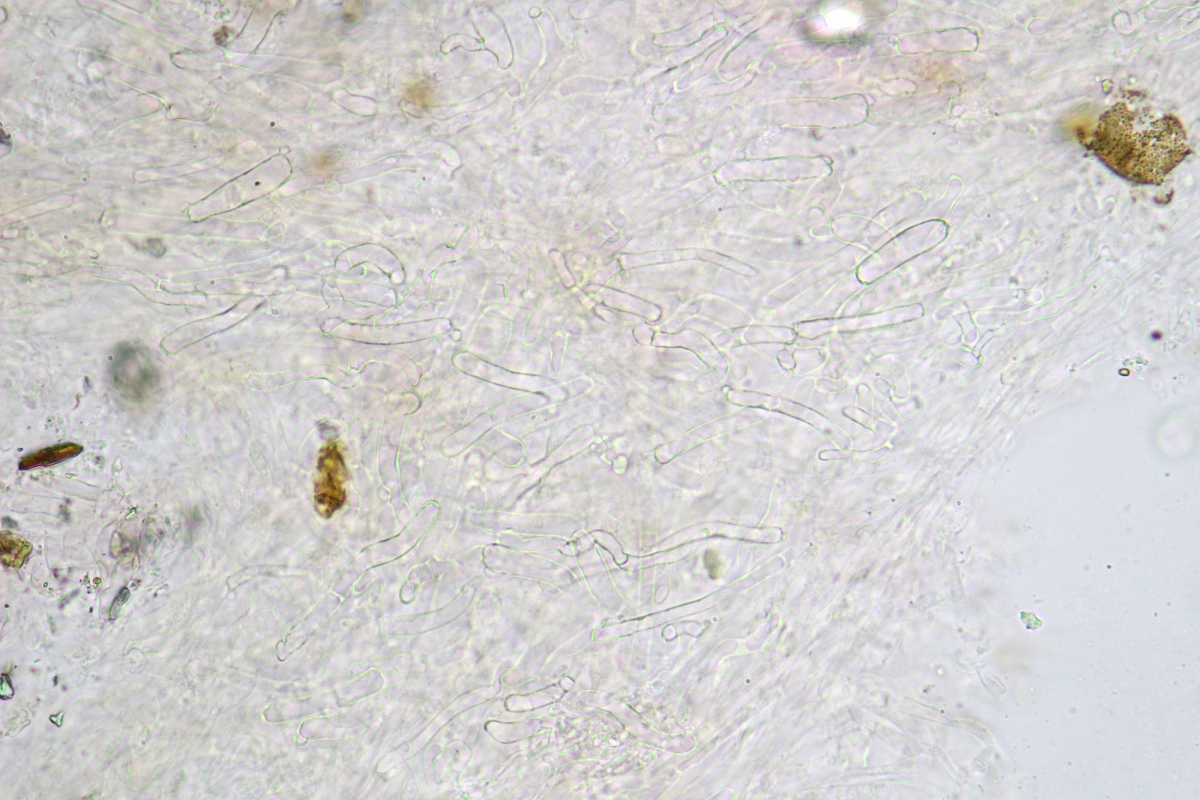
☻
Sporen:
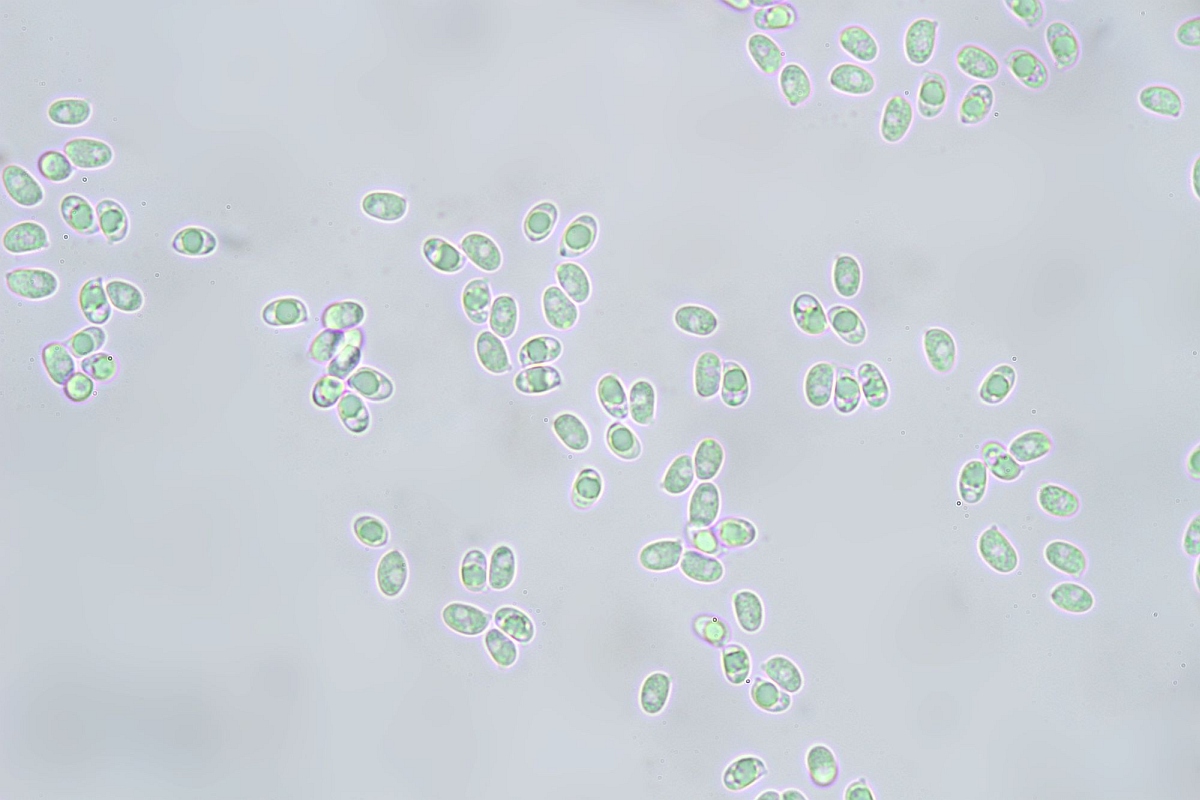
☻
Fundnummer:
2017-09-09-1542
Hier wieder mal ein Beispiel dafür, dass M. limosus nicht nur an
Schilf/Rohrglanzgras vorkommt. Hier wuchsen die Pilzchen auf einem grasigen,
sehr feuchten Waldweg. Man muss aber schon sehr genau hinsehen, um sie zu
entdecken.
Schilf-Schwindling (Marasmius limosus):

☻

☻

☻
Weiter zum Teil 3


