Hallo zusammen
Hier ist jetzt gerade so richtig viel los. In manchen Wäldern muss man schauen wo man hintritt.
Ein paar interessante Funde:
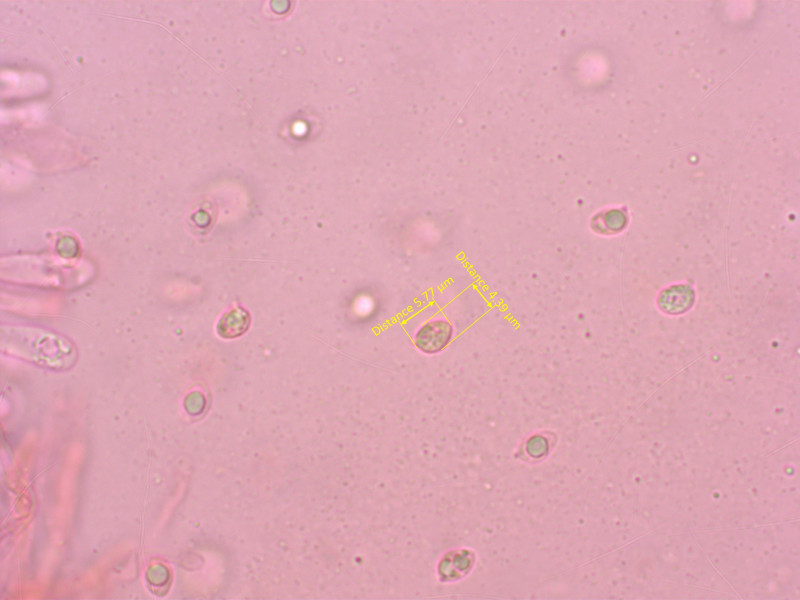
1: Conocybe siliginea:
Ein Samthäubchen mit mittelgrossen Sporen, ohne lecythiforme Kaulozystiden und 1-/2-sporigen Basidien.

Sporen:

Cheilozystiden:
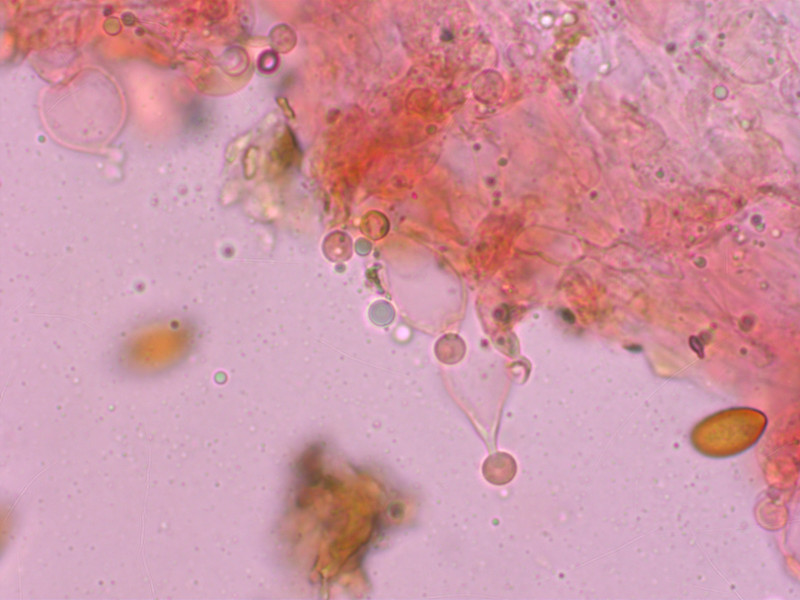
Stiel-Elemente recht unauffällig:
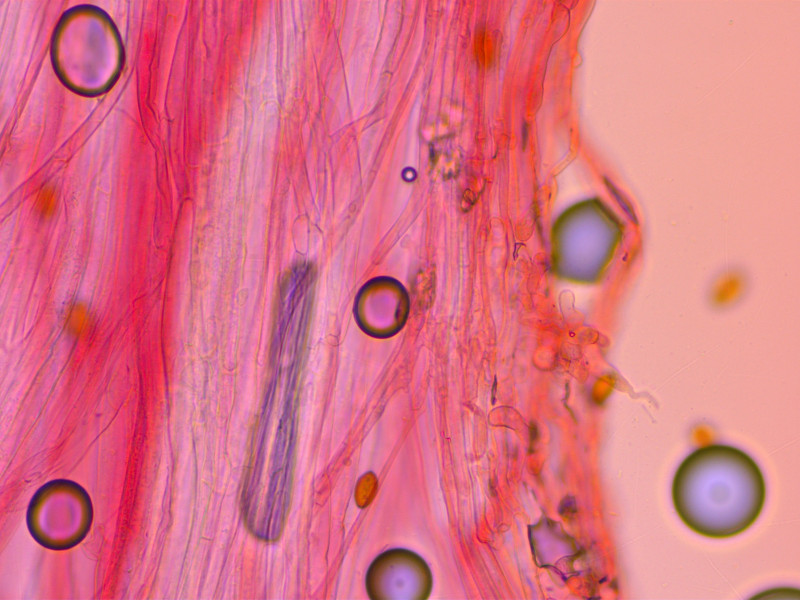
Basidien mehrheitlich 1-sporig, woanders fand ich auch zweisporige:
2: Lentinellus flabelliformis:
Die Art ist in dem Wald recht häufig, ist eigentlich jedes Jahr auf dem Programm.
Der Unterschied zu L. micheneri ist mir nicht ganz klar, oft werden die beiden Arten zusammengelegt.

Sporen:

3: Psilocybe subcoprophila:
Wuchs auf Pferdemist, wie es sich gehört. Die riesigen Sporen (es gab welche bis 23µm) lassen m.E. keine andere Bestimmung zu.

Sporen:

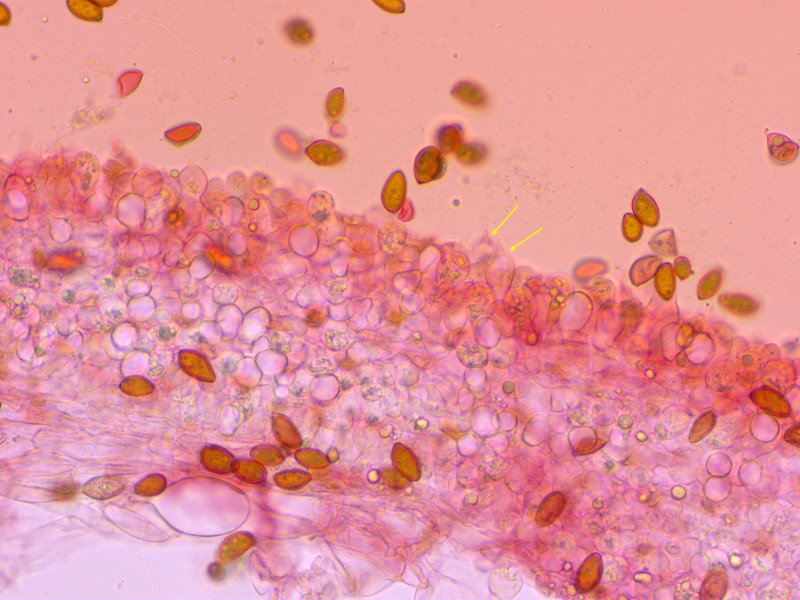
4: Tricholoma stiparophyllum
Geruch passte, Schnallen waren auch zu finden. Und natürlich Birken in der Nähe.

Sporen:
HDS mit Schnallen:
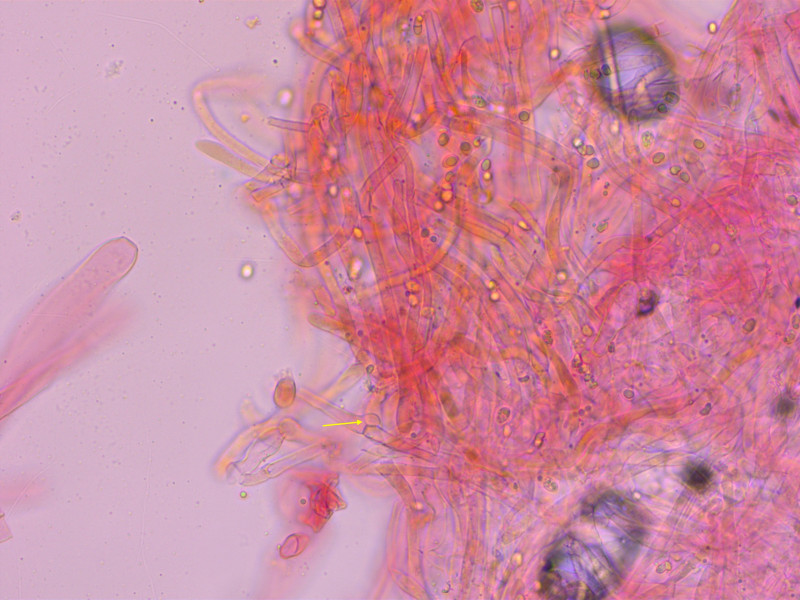
5: Cortinarius elegantior cf. cedretorum
Ökologie: Nadelmischwald mit Fichten, Kiefern und Weisstannen. Im Gras am Waldrand.
Den Geruch zu betiteln fällt mir schwer, irgendwie etwas süsslich, nicht sehr stark.

Grosse, stark warzige Sporen:

Schnitt: Fleisch im Hut mit Grüntönen, im Stiel schwach violettlich (sieht man auf dem Bild schlecht), in der Knolle gelblich:

3% KOH auf Hut:

6: Cortinarius cf. tortuosus:
Diese Telamonia müsste eigentlich weisse Velumreste am Rand haben.
Ich war aber nach starkem Dauerregen unterwegs, daher darf man da wohl ein Auge zudrücken.
Der ähnliche C. evernius sollte eher eine verjüngte Stielbasis haben, sonst schwer zu unterscheiden.
Für C. tortuosus spricht auch der Stiel, der an den meisten Fruchtkörpern etwas gedreht ist.
7: Ramaria sanguinea:
Leicht zu erkennen an den weinroten Flecken am Strunk. Es sind keine Verletzungen oder Druckstellen.
Die Farben sind auf dem Bild völlig daneben, eigentlich waren die Äste schön zitronengelb.
Vielleicht mache ich heute nochmal ein besseres Bild.

Sporen:
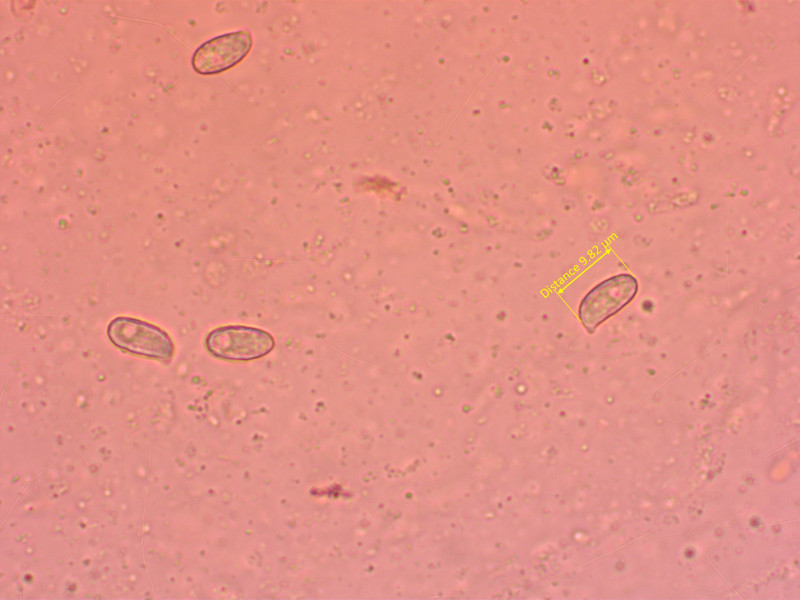
8: Sarcodon fuligineoviolaceus
Wunderschön violett im Schnitt. Leider nur ein bescheidenes Exemplar.
9: Tricholoma aurantium
Massenpilz in wunderschönen Gruppen.
10: Pleurotus dryinus
Eigentlich nichts besonderes, ich fand nur den Korkenzieher-Stiel speziell. Man könnte ihn als "drehstieligen Seitling" bezeichnen.
Viele Grüsse
Raphael


