Hallo liebe Pilzfreunde,
am Mittwoch waren wir eigentlich auf (erfolgreicher) Steinpilzjagt, da finde ich doch glatt noch diesen Täubling den ich euch gerne zeigen möchte. Im ersten Augenblick dachte ich aah...hhja, ein Harter Zinnobertäubling, der kommt mir gerade recht, hatte ich mir nach einem Forums-Beitrag letztes Jahr doch vorgenommen, die Chemie insbesondere SV bei diesem mal zu testen. Nun, ein wenig wunderte ich mich schon, dass der neue Fund irgendwie lebhafter gefärbt aussah als meine bisherigen R.lepida/rosea.
Hier nun die Fundbeschreibung von einem weiteren Pilz zur Gruppe Roseinae.
Laubwald: 430m, Buche, Eiche, Kiefer, in der trockenen Laubschicht
Exemplar: jung, einzeln, Hut 5-6cm
Hut: rosa-rot mit violettem Ton, ocker-gelber Mitte, +/- ungeriefter Rand, vertieft, matt und bereift
Peeling: 1/3 - 1/2r, unter der Huthaut rötlich
Lamellen: spröde, cremefarben, Stielgabelig, wenige Zwischenlamellen, Schneide unfefärbt
Stiel: einseitig rosa-rot, sonst weisslich und längsgeriffelt, fest, trotzdem irgendwie wattig (nicht hart wie lepida)
Geruch: neutral
Geschmack: mild, verzögert ganz ganz leicht bitterlich
SpP Farbe: Ib - IIa (mein Eindruck)
Chemie: zu Hause natürlich gleich mit SV getestet und... am Frischpilz negativ, AUSSER ein kleines Fitzelchen an der abgebrochenen
Stiel-Basis wurde schlagartig rot, vielleicht schon trocken?
Ich dachte an die Bemerkung von GRÖGER "karminrot (immer so an Exsikkaten; an Frischpilzen oft nur blass rosa, aber nicht konstant und gelegentlich ausbleibend)"
Das positive Ergebnis am Exsikkat seht ihr in den folgenden Bildern.
Bild 1, im Laubwald Buche, Eiche, Kiefer

Bild 2, freigelegt

Bild 3, Hut mit rot-violettem Einschlag und gelb-ocker Mitte, bereift

Bild 4, Lamellen cremeweiss, vereinzelt Lameletten, Stiel nur einseitig gefärbt, Basis ockerlich

Bild 5, Stiel keulig, gerunzelt und rötlich gefärbt

Bild 6, die Huthaut bis zu 1/3 - 1/2r abziebar, darunter rötlich gefärbt

Bild 7, die Sulfovanillin Reaktion am Exikkat nach 5sek, nachdunkelnd

Bild 8, die Sporenpulverfarbe

Bild 9, SV, Dermatozystiden wurden keine festgestellt
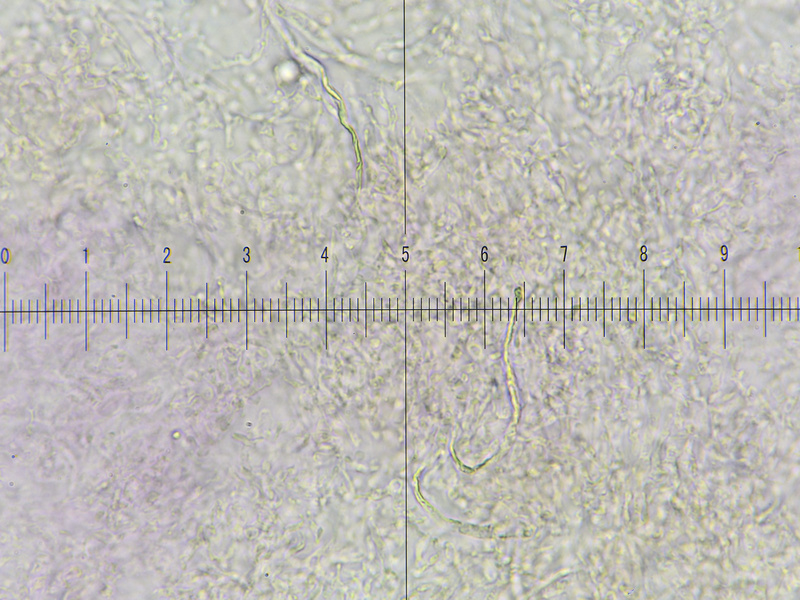
Bild 10, KF+Lactogl, Primordialhyphen auffällig

Bild 11, KF+Lactogl, teils mit kräftigen Placken incrustiert
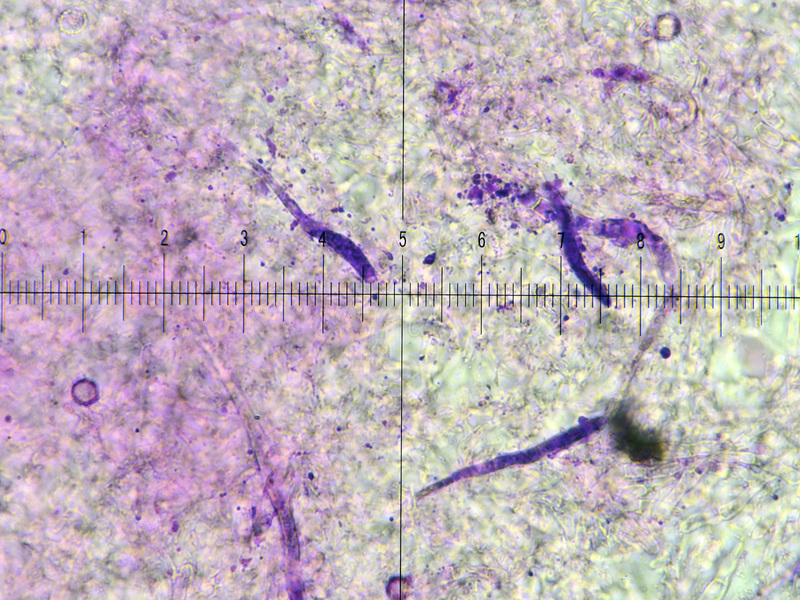
Bild 12, Kongo Nh3, Incrustierte Hyphen in Kongo schon sichtbar

Bild 13, Kongo Nh3, meistens zylindrisch und ausspitzend, wenig 1-3 Septen
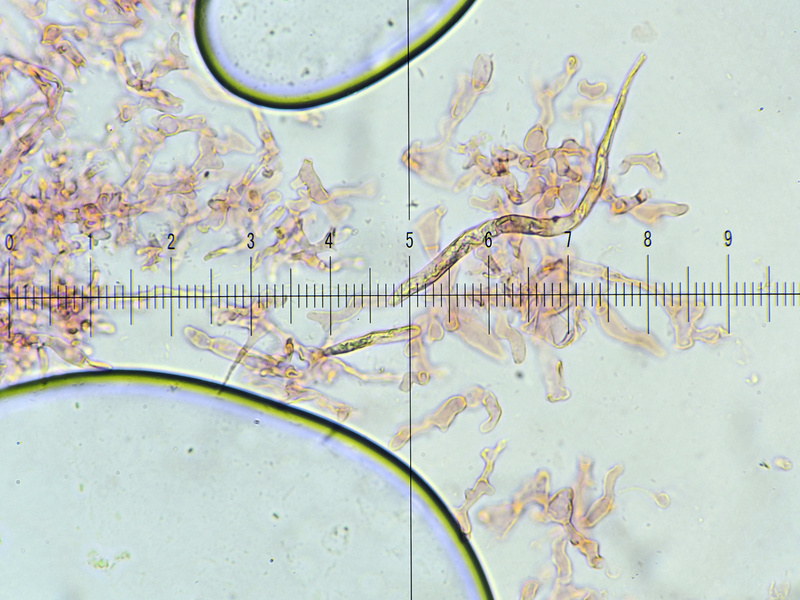
Bild 14, Kongo Nh3, auf diese gelblich Spitzen Teile über der Ziffer 6 war ich aus, sind bei GRÖGER S.553 erwähnt

Bild 15, Kongo Nh3, hier nochmals über 6, GRÖGER "mit lang zugespitzten „Borsten“, wie die „crins“ bei R. vesca und R. heterophylla"
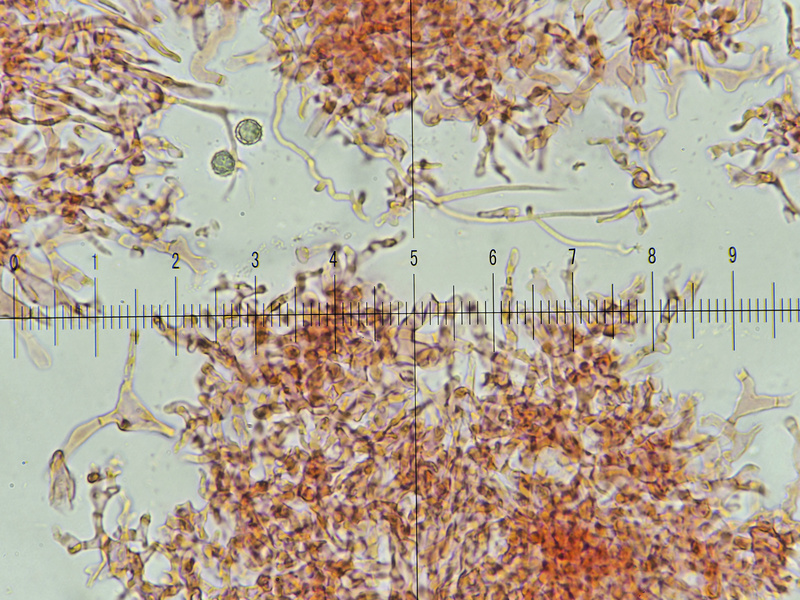
Bild 16, Kongo Nh3, das übliche Durcheinander von Haaren

Bild 17, kommen wir zu dem Messprotokoll der Sporen

Bild 18, Melzer, Sporen Ornament überwiegend netzig, mit wenig einzelnen Warzen

Bild 19, Melzer, überwiegend netzig, aber auch mit grösseren Freiräumen

Bild 20, Melzer, die Sporenform ist elliptisch, die Warzen bis max. 0,4 mü hoch

Nach R. pseudointegra, R. velutipes, R. minutula und dieser R. lepidicolor komplettiere ich meine Gruppe Roseinae.
Berichtigungen auch kritisch, werden gerne entgegengenommen.
Grüsse
claus


