Huhu.
Wiesenpilze sind nicht unbedingt meine Welt. Ich staune immer wieder über die CHEG-Arten, die hier im Forum, beispielsweise von Karl W., Wutzi oder Björn eingestellt werden.
An Saftlingen habe ich bisher selbst gefunden: Hygrocybe conica agg. und dieses Jahr erstmals ein paar Ecken mit Gliophorus psittanicus (agg?). Das war's.
Bei Cuphophyllus sieht's nicht viel besser aus. C. virgineus findet sich immer mal, einmal hatte ich C. pratensis. Das war's.
Meinen Fundus der Gattungen konnte ich auch in den letzten 2 Wochen nicht groß erweitern. Aber dafür konnte ich endlich mal ein paar andere Wiesen-Farbtupfer entdecken und Erstfunde sammeln. 
Mit freundlicher Unterstützung von Enno der deutlich mehr Erfahrung mit den Wiesenpilzen hat, konnte ich ein paar Sachen so grob für mich einsortieren. Ansonsten habe ich die Kollektionen erstmal herbarisiert, um ggf. im Winter nochmal nach zu mikroskopieren und/oder Teile der Belege in fähigere Hände abzugeben zur Untersuchung/Sequenzierung ( AlexanderK ?).
Man mag den Bildern ansehen, dass ich keine Wiesenpilz-Spezi bin - eine Grasschere gehört vermutlich ins Foto-Repertoire bei dieser Art der Pilzsuche...
Benennungen sind alle provisorisch, da wohl ohnehin viel im Umbruch ist bei den Wiesenpilzen.
Los geht's mit einem Fund am Wegrand (nicht von mir, sondern von Schupfnudeline in dem Fall...):
1. Eine hübsche gelbe Keule, vermutlich Clavulinopsis laeticolor s.l.

2. Wenn man einmal hockt, sieht man dann oft auch noch weitere Arten. So ging es mir in den letzten 2 Wochen jedenfalls oft. Das entschädigt dann fürs fruchtlose Bücken an vielen anderen interessant aussehenden Stellen.
Karl W meinte im Online-Treff, dass es vermutlich eine unbeschriebene Art ist.

3. Die einzigen Saftlinge am Wegrand waren jedes mal welche aus dem H. conica-Aggregat. Dieser kleine sah etwas anders aus und mit dem bitter schmeckenden Hut dachte ich an H. mucronella. Dummerweise hat er dann doch noch geschwärzt, also wieder keine neue Saftlingsart. 

3. Ansonsten gab es auf der Strecke nix wiesenpilziges mehr zu finden, abgesehen von einigen Cuphophyllus virgineus mit Befall.

4. Am Freitag ging es dann mit zwei anderen Pilzverrückten auf einen Friedhof. Die vielen Galerinas im Moos an einigen Stellen machten Hoffnung. Und dann kam tatsächlich wieder ein gelbes Keulchen zum Vorschein. Die sollten wieder ins C. laeticolor Aggregat gehören.

5. Ein paar Meter weiter dann mal eine andere "Farbe". Ziemlich große, weiße Keulchen. Ich glaube die kann man noch so ansprechen als Clavulina rugosa. Erstfund für mich.

6. Häufiger zu finden, wenn man gebückt umherkriecht war Arrhenia retiruga

7. Das gleiche gilt für Rickenella swartzii und seinen orangefarbigen, sehr häufigen Bruder, den ich nicht abgelichtet habe.

8. Dann wieder ein neues Keulchen. Wieder weiß, aber nicht runzelig. Enno konnte sich falcata vorstellen, ich hatte aber nur kurz die Sporen angeschaut und dann ab ins Herbar. Vermutlich ein Erstfund.

9. Hier dachte ich auch erst an eine Wiesenkeule. Aber ich vermute fast es ist gar keine. Wuchs auf dem Boden neben anderen Keulen, bei Kiefern. Geruchlos und keine KOH-Reaktion. Sporen feinwarzig und recht klein. Ramaria spec.?

3,9-4,8x2,6-3,3
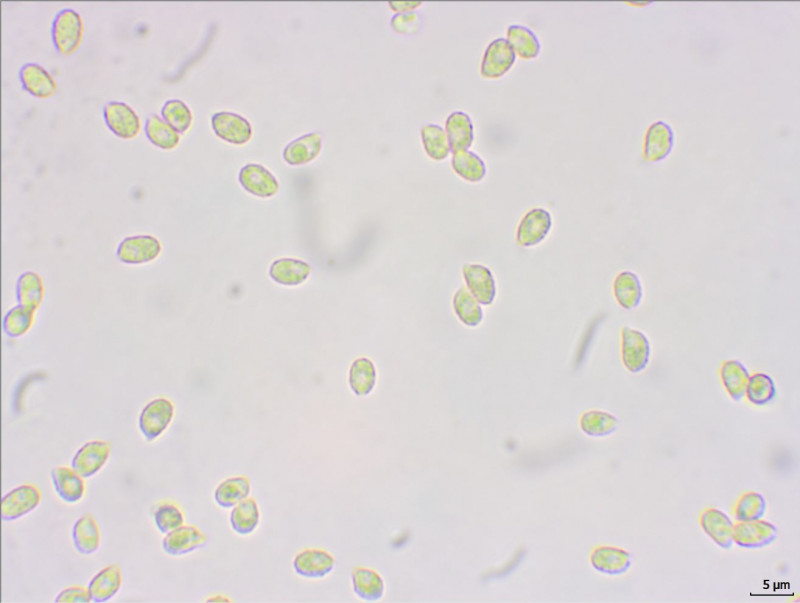
Ab jetzt blieb dann wegen abendlicher Verpflichtungen leider bisher keine Zeit mehr fürs Mikro, so dass ich nur noch Belege angefertigt habe.
10. Mal was mit Hut und Stiel zur Abwechslung (und ohne Beleg, falls jemand fragen wollte  ). Psilocybe cyanescens wächst hier tatsächlich auch regelmäßig auf der Wiese. Die meisten waren aber schon nicht mehr fotogen. Die hier habe ich aber mal zusammengelegt für ein Foto.
). Psilocybe cyanescens wächst hier tatsächlich auch regelmäßig auf der Wiese. Die meisten waren aber schon nicht mehr fotogen. Die hier habe ich aber mal zusammengelegt für ein Foto.

11. Im Gras fanden sich beim gebückten Vorwärtsgang dann kleine rosa Puschel.
Rotspitzigkeit - Laetisaria fuciformis

12. Zudem dieses hübsche Grüppchen. Vielleicht Omphalina pyxidata, muss ich im Winter mal schauen, ob ich den bestimmt kriege, wobei Arrhenia und Omphalina glaube ich auch nicht gerade die einfachsten Gattungen sind.

13. Genug Ablenkung von Pilzen mit Hut und Stiel, es gibt ja Keulchen! Die hier standen direkt nebeneinander. Ich dachte daher es sind junge und alte Exemplare, mittlerweile vermute ich eher es sind 2 Arten. Die dunkleren sind auch als Beleg nochmal deutlich dunkler geworden als die hellen. Die hellen hätte ich in Richtung C tenuipes s.l. gesteckt, die dunklen - keine Ahnung...sicherlich Erstfunde für mich, was auch immer es ist.

14. keine richtigen Keulchen aber auch hübsch - Leotia lubrica.

15. Den Abschluss der Friedhofsrunde macht noch einmal ein Pilz mit Hut, Stiel und Röhren, von dem ich noch kein gutes Kollektionsbild hatte.
Zwergröhrling trifft es hier ganz gut - Chalciporus piperatus.

Mit schmerzenden Knien und Rücken kam dann gestern die Nachricht, ob man nicht Sonntag nochmal los wolle. Nach einiger Diskussion schlug ich dann vor mal eine Parkwiese im Leipziger Umland zu prüfen, die auf Googlemaps ganz nett aussah. Also gesagt, getan und und mit freundlicher Begleitung ging es heute nochmal raus zum Pilze suchen.
16. Empfangen wurden wir von Unmengen an Gliophorus psittacinus - dafür alleine hätte es sich schon gelohnt.

Aber wer sich bückt, der findet auch andere Pilze. Zum Beispiel...Keulchen!
17. Vielleicht wieder Clavulinopsis laeticolor - auffällig runzelig aber die Fruchtkörper.

18. Und ein paar Meter weiter dann immer wieder diese hübschen verzweigten Keulen. 
Vermutlich Clavulinopsis corniculata agg. - Erstfund


19. Direkt nebenan, dann ebenfalls verzweigte Exemplare, aber andere Farbe. Enno meinte eventuell Richtung Clavulinopsis umbrinella s.l. - Erstfund


20. Ein paar Meter weiter dann diese tolle Gruppe von Keulchen mit deutlichem Orangegelb. Solche hatte ich auch noch nicht bisher. (Bilder von meiner Begleitung)
Clavulinopsis cf. luteoalba?


21. Nebenan stand dann auch noch ein Einzelexemplar eines Lamellenpilzes mit Mehlgeruch und auffällig punktiertem Stiel. Ich glaube das ist mein Erstfund aus der Gattung Dermoloma. (Bilder von meiner Begleitung)
Könnte das passen und hat jemand einen Artvorschlag?


22. Der hübsche kleine Öhrling (Otidea sp.) unter Eiche war dann nur ein kleiner Beifang und durfte stehenbleiben, da ich ohnehin zu blöd bin Öhrlinge zu bestimmen.

Bild von meiner Begleitung:

23. Kaum zu glauben - ein Saftling, der nicht schwärzt und auch kein Papageiensaftling ist! Ein wenig konnte ich also meine Saftlingsliste doch noch ausbauen. Er ist überall dolle schleimig, Lamellen leicht herablaufend. Ich komme da auf Hygrocybe glutinipes? (Bild von meiner Begleitung) Könnte das passen?

24. Den Abschluss macht schließlich diese hübsche Keule in einer Farbe, die noch gefehlt hatte. Ein wunderschönes Exemplar. Scheinbar gibt es hier auch wieder mehrere Arten wie es ausschaut. Namensvorschläge nehme ich trotzdem gerne - bei der hübschen versuche ich auch noch die Sporen nachzuliefern diese Woche, da ich ein Exemplar zum Aussporen hingelegt habe, während die anderen beiden auf dem Dörrer darauf warten ins Herbar zu kommen.

Besseres Bild von meiner Begleitung:

Und damit kann ich also auch endlich mal einen Fundbericht von Wiesenpilzen abhaken.
Vorschläge/Verbesserungen/Korrekturen wie immer erwünscht. 
LG,
Schupfi


