Hallo zusammen, Ditte
Hier kommt ein nächster Schub alpine Risspilze. Es gab noch einige mehr aus der lacera- und calamistrata-Gruppe, die zeige ich jetzt aber nicht alle.
Habitat: Oberaargebiet (Grimselpass), zwischen 2450m und 2550m. Bei Salix herbacea oder Salix retusa.
Der Boden ist nur stellenweise schwach kalkig.
1:

Dieser blaufüssige Risspilze mit Pelargonium-Geruch könnte die dritte alpine Art sein. Aber so ganz sicher bin ich nicht.
Mit bis zu 25mm Hutdurchmesser ist er mir eigentlich für Inosperma gracilentum zu gross.
Auch die Hutoberfläche ist irgendwie strähniger. Deshalb meine ich, es könnte Inosperma subhirsutum sein.
Aber die Mikromerkmale passen eher zu gracilentum.
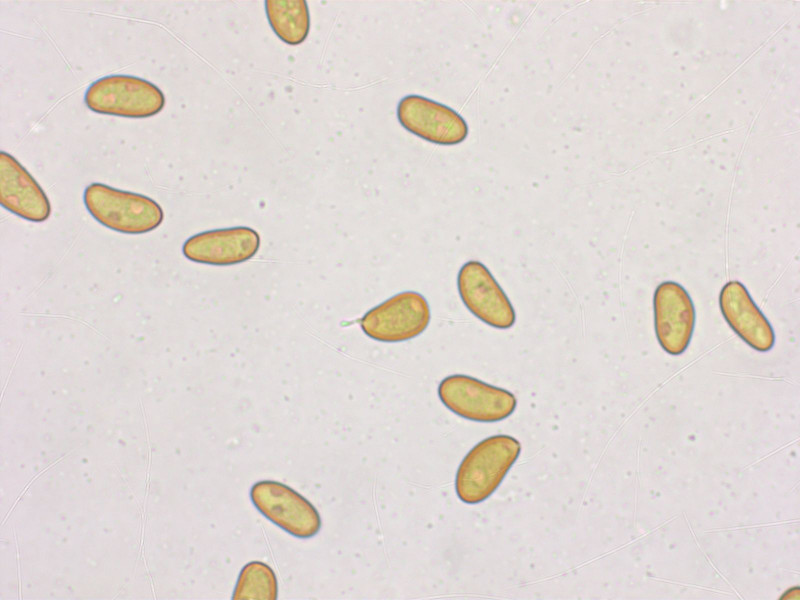
Die Sporen passen aber eher zu Isp. gracilentum, 9.5-10.5-11.6 x 5.3-6.1-7.0 µm, Q = 1.51-1.74-1.93 (n=20)

Auch die Zystiden sind eher kurz, 29-36-46 x 9-11-12 µm.
Hier zum Vergleich eine weitere gracilentum-Kollektion vom gleichen Tag, die ich für typisch halte:

2:

Diesen hier aus der lacera-Gruppe will ich doch kurz zeigen, weil die Zystiden recht auffällig sind.
Ich hatte zwei Kollektionen an dem Tag. Auffallend ist einerseits die gelbliche Hutfarbe.

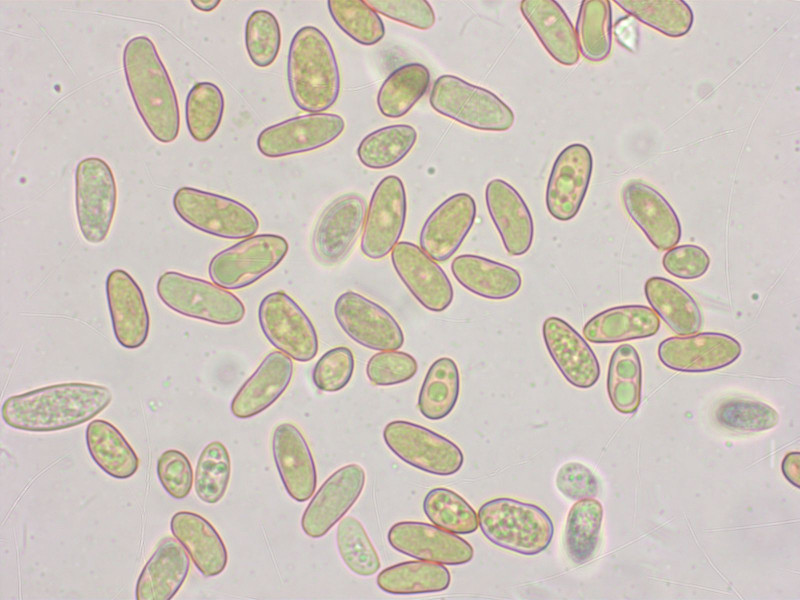
Sporen mehrheitlich laceroid, 9.7-12.3-14.4 x 4.6-5.0-5.8 µm, Q = 1.90-2.45-2.94 (n=20)
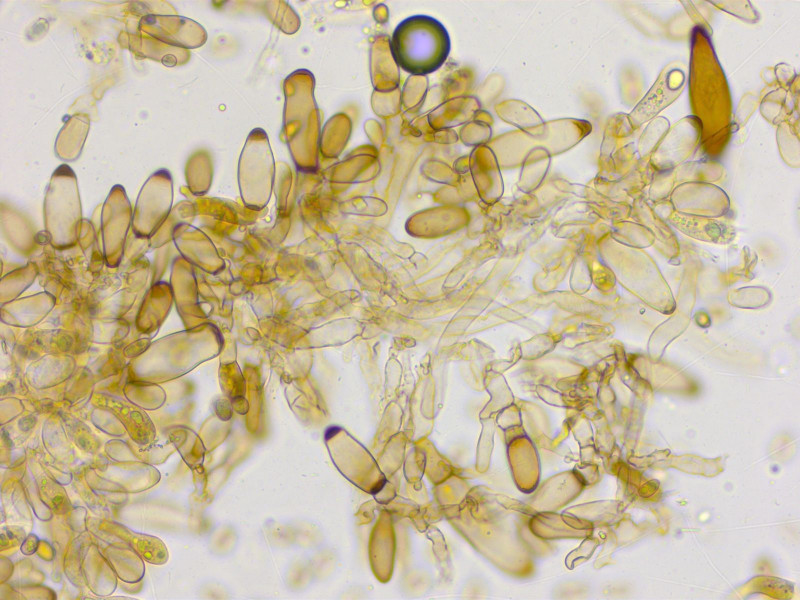
Viele Cheilozystiden haben oben und unten einen schwarzbraunen Inhalt. Nur wenige sind metuloid.
Es fiel mir schwer zu entscheiden welche ich messen soll und welche nicht, ich komme auf 40-55 x 11-18 µm.
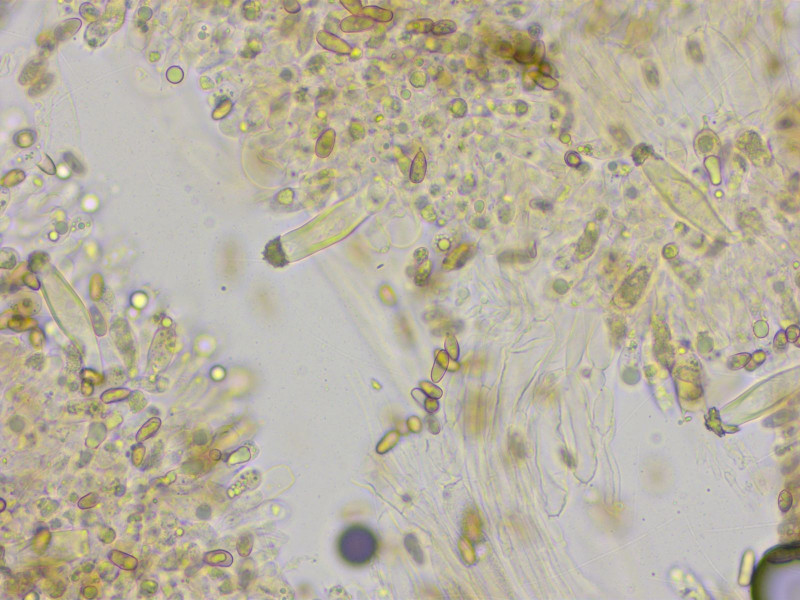
Die Pleurozystiden sind immer metuloid und haben meistens einen auffallend rundlichen Kristallschopf.
Kaulozystiden gab es nur ganz vereinzelt.
Trotz allem ist es wohl Inocybe lacera oder moravica, denke ich. Mein Favorit wäre letztere.
3:

Hiervon gab es leider nur zwei. Geruch schwach fruchtig. Gehört wohl in die Gattung Pseudosperma.

Oben auf dem Foto wirkt der Stiel knollig, ist er aber nicht.
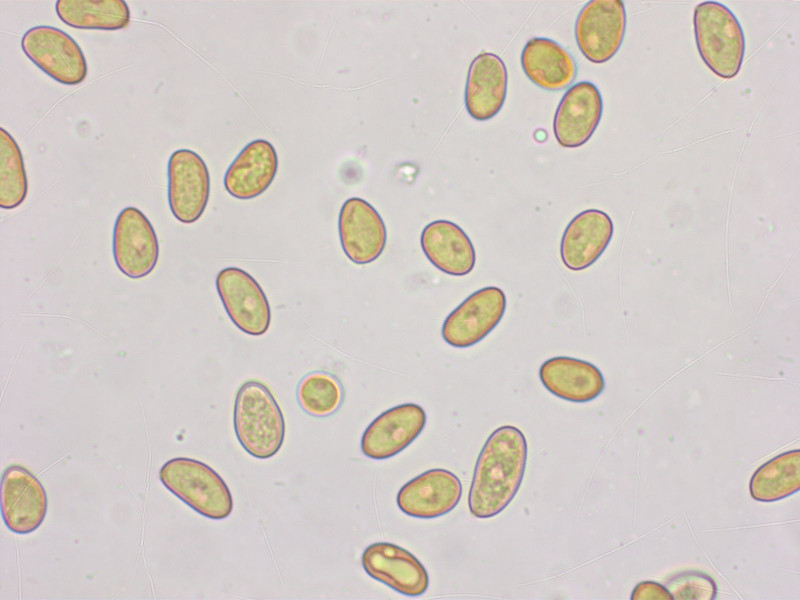
Sporen meistens recht kurz, 8.9-9.9-11.2 x 5.4-5.9-6.6 µm, Q = 1.35-1.68-2.02 (n=20)
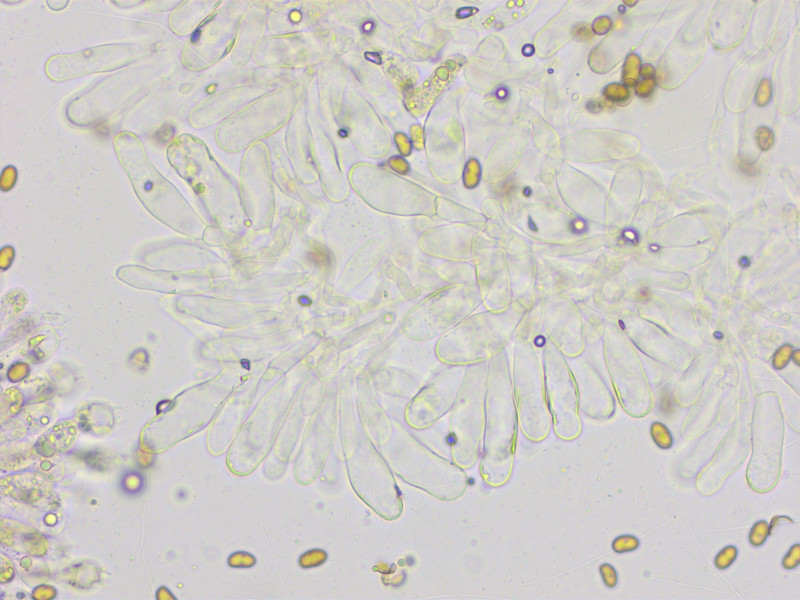
Cheilozystiden 31-41-55 x 12-13-14 µm, teils mit apikal verdickten Wänden.
Die Bestimmung ist schwierig, es gibt offenbar wenige alpine Pseudosperma-Arten mit so kurzen Sporen.
Nach Bon komme ich auf eine dubiose "Inocybe" cucullata, die nie umkombiniert wurde.
Über die Art finde ich keine glaubhafte Informationen aus neuerer Zeit.
4:

Noch ein Pseudosperma, was mir aber erst zu Hause klar wurde. Geruchlos.


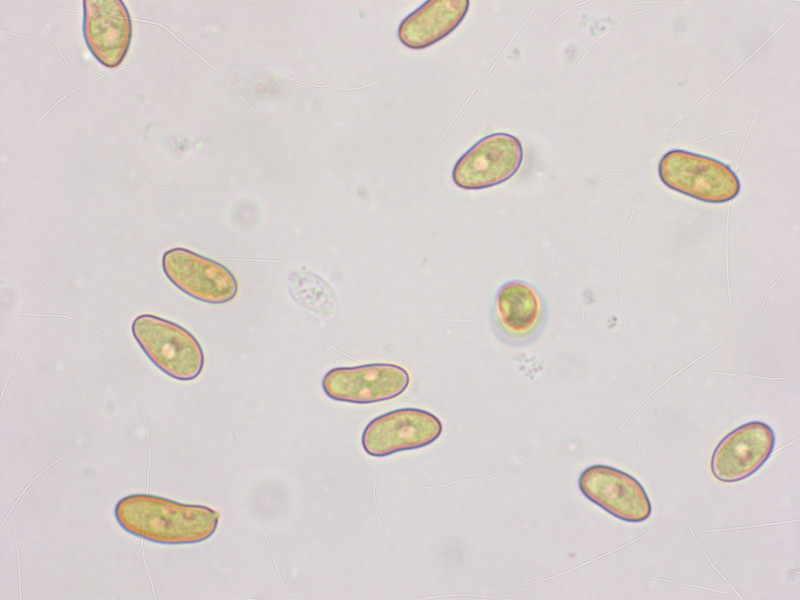
Sporen: 10.7-11.5-12.5 x 5.3-5.8-6.4 µm, Q = 1.75-1.99-2.28
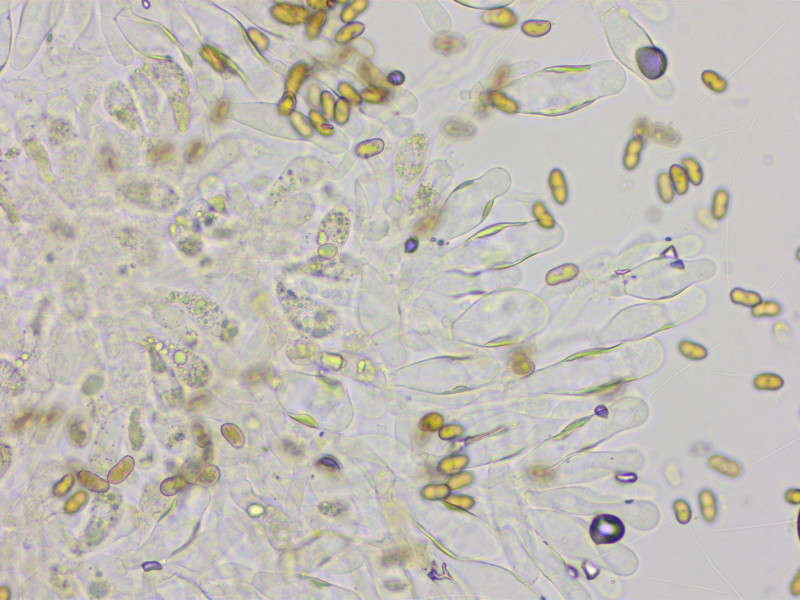
Zystiden zylindrisch, breit lageniform, einige etwas kopfig, mit auffallendem Pigment im mittleren Bereich, 33-47-59 x 10-15-20 µm.
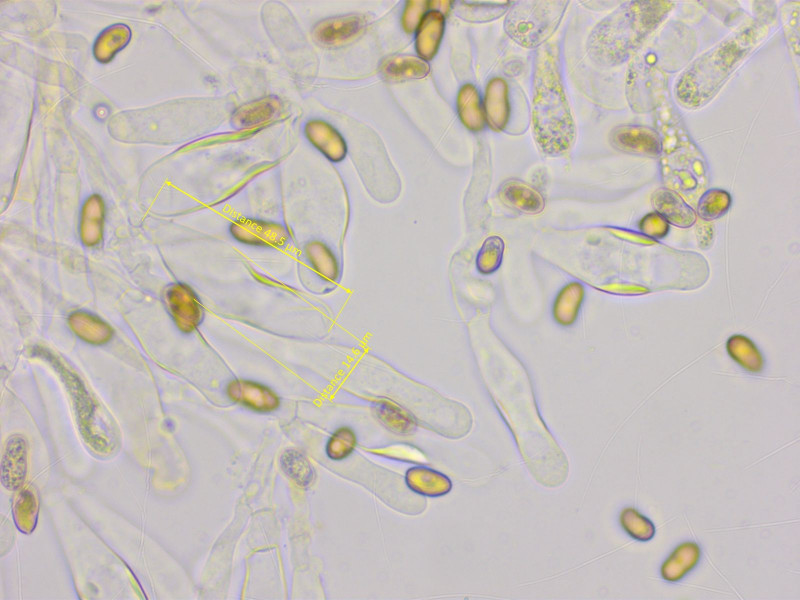
Hier nochmal das Pigment 630x.
Ich habe zwei Kandidaten, Pseudosperma guttuliferum oder Pseudosperma flavellum.
5:

Bei dieser Mallocybe habe ich wenig Hoffnung auf eine Bestimmung, aber vielleicht hilft die dunkle Farbe weiter.
Diese zwei Exemplare wuchsen auf der asphaltierten Strasse, wo etwas Gras und Salix durchgebrochen war.
Wir haben sie ganz zu Beginn gefunden, da ist man noch versucht alles mitzunehmen. Geruchlos.

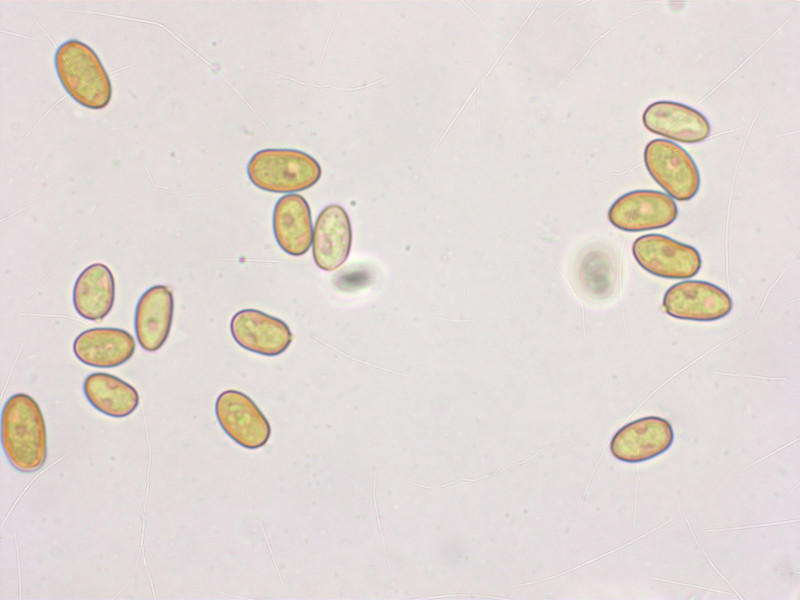
Sporen unauffällig: 8.4-9.3-10.4 x 4.8-5.5-6.3 µm, Q = 1.58-1.71-1.94 (n=20)

Zystiden verketten aus bis zu vier Elementen, das vorderste meist keulig, 17-22-26 x 8-10-11 µm.
6:

Noch eine Mallocybe, hier habe ich die vage Hoffnung dass die Sporenmessung die Auswahl eingrenzt. Geruch schwach pelargoniumartig.
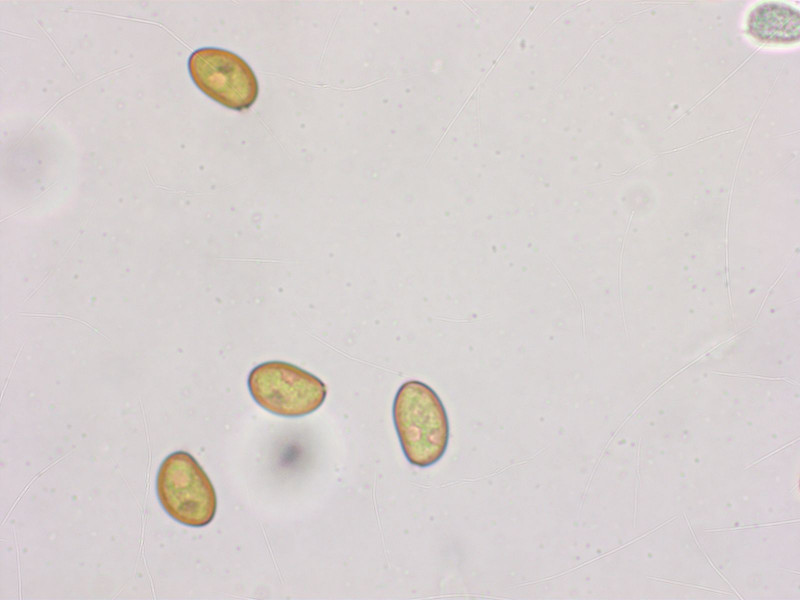
Sporen gab es wenige, aber sie sind auffallend breit: 8.6-10.4-12.0 x 6.4-7.1-8.3 µm, Q = 1.25-1.45-1.85 (n=20)

Zystiden breit keulig, aus 1-2 Elementen, 31-34-40 x 13-17-20 µm
Mit diesen breiten Sporen finde ich eigentlich nur Mallocybe latispora. Ich weiss aber nicht, ob die alpin vorkommt.
LG Raphael


