Hallo zusammen
Nach einer seeehhhhhr langen Durststrecke gibt es hier endlich wieder Pilze, vor allem in der Höhe:

Hier die Blick vom "Roc de la Vache" (also vom Kuhfelsen) Richtung Zinal im Val d'Anniviers.

Manchmal ist man auch nicht alleine dort oben. Er kratzte sich dauernd mit seinen Hörnern, eigentlich recht praktisch.
Der viele Regen, kombiniert mit frischen Temperaturen (5-10 Grad in den Bergen), lässt auch kleinere Pilze überleben.
Die folgenden Kollektionen stammen alle aus einem kalkreichen Gebiet auf ca. 2350m, mit viel Salix reticulata und Salix repens.
1:

1: Arrhenia's sind kaum bestimmbar, und es gibt noch etliche unbeschriebene Arten.
Das hier könnte Arrhenia griseopallida sein, ohne Gewähr.
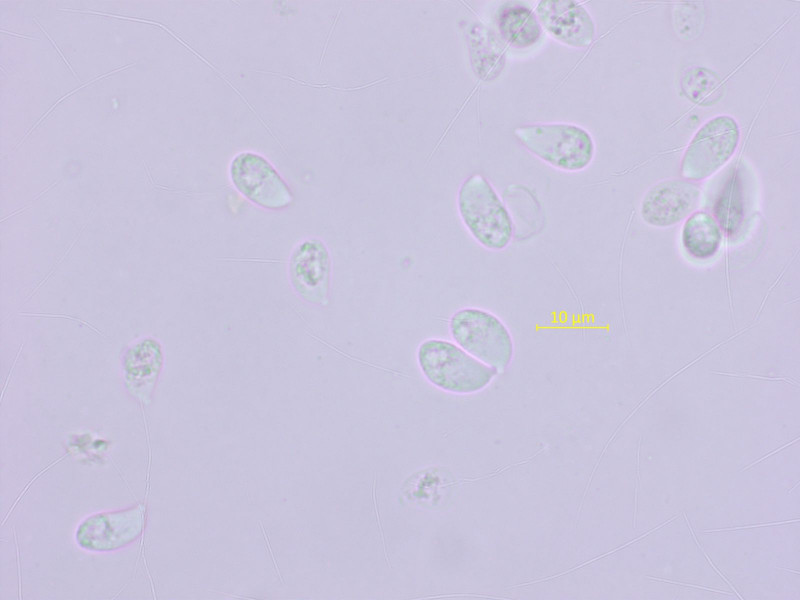
Die Sporen sind gross, bis über 12 µm lang, Basidien zweisporig, Schnallen überall häufig.
2:

Diese Arrhenia hat einen fein samtigen Stiel. Davon gibt es (leider) nicht nur eine, aber hier ist es wohl die stinknormale Arrhenia velutipes.
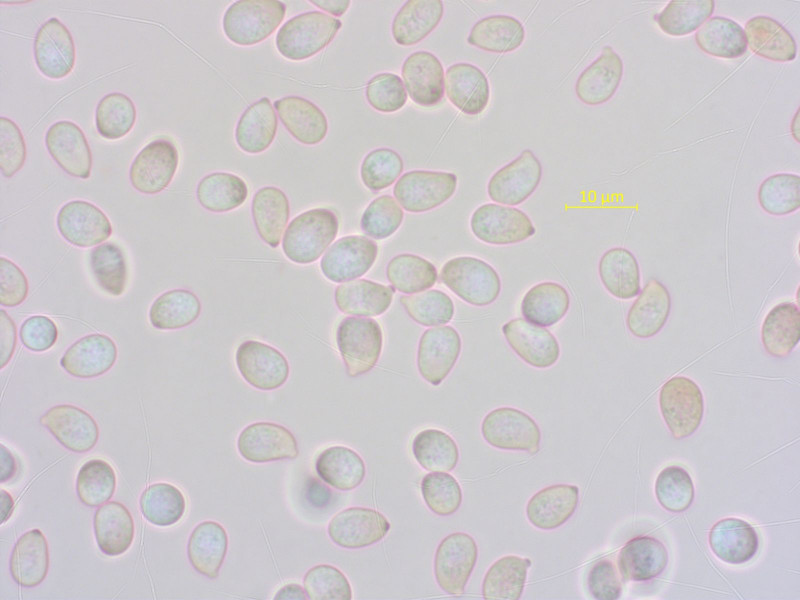
Sporen gedrungener und kürzer. Basidien 4-sporig, mit Schnallen.
3:

Dieser Trichterling ist recht häufig und wurde jahrzehntelang mit einem falschen Namen versehen (Clitocybe dryadicola).
Inzwischen hat er einen neuen Namen bekommen, nämlich Clitocybe lamoureae.
Die Art gibt es auch nicht-alpin, ich habe einen sequenzierten Beleg aus einem Auwald auf 550m bei Populus.
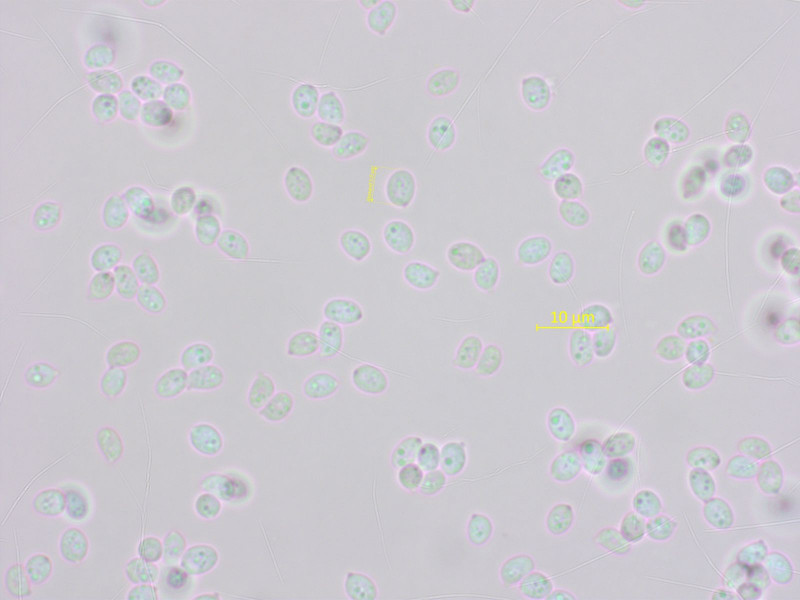
Typisch sind die winzigen Sporen.
4:

Das hier sollte Clitocybe paxillus sein. Muss aber erst in die Sequenzierung.
Im Gegensatz zum ähnlichen Clitocybe festivoides stinkt er überhaupt nicht, und hat kein inkrustierendes Pigment.
Und das Sporenpulver war tatsächlich cremerosa.
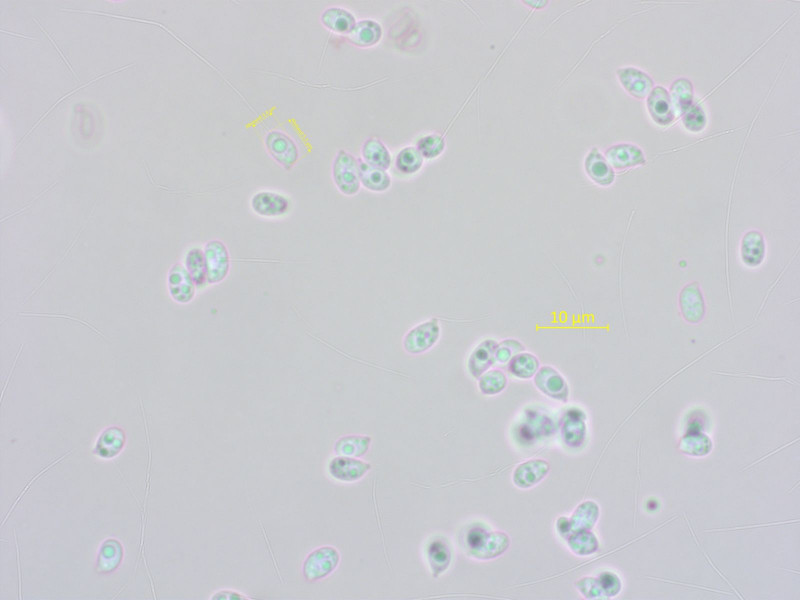
Sporen auch recht klein.
5:

Alpine Telamonien, naja... ich nenne es mal Cortinarius minutalis.
Ohne Sequenzierung geht da vorläufig nichts.
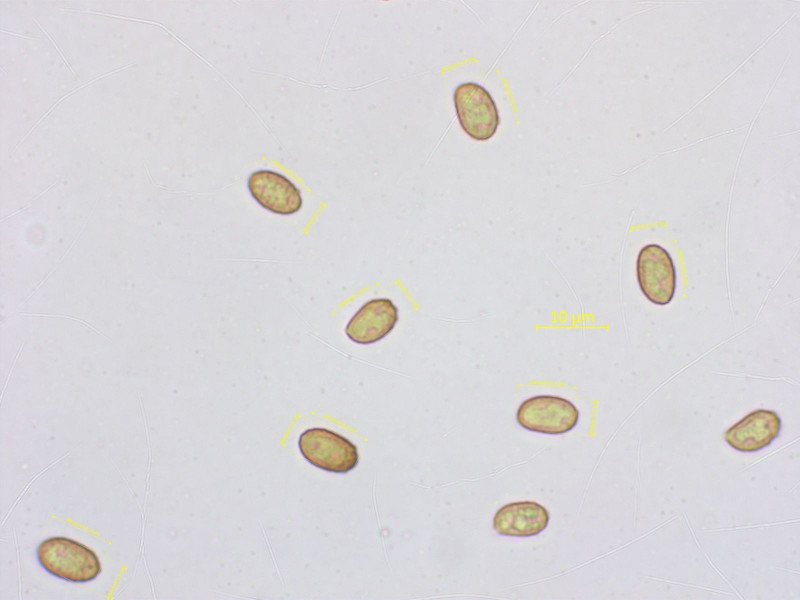
Sporen etwa 8.0-9.5 x 5.0-5.5 µm.
6:

Alpine Galerina's sind meistens vittiformis, aber das hier nicht.
Nach langem Stöbern halte ich es für Galerina minima. Der Fund passt gut zu der Kollektion von Armada et al. 2023.
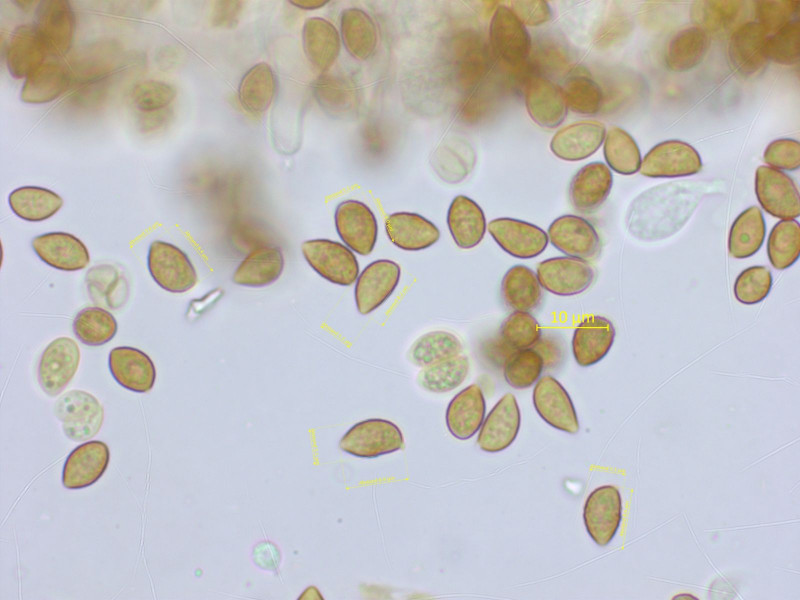
Sporen kaum warzig, 8.0-9.0 x 5.0-5.5 µm. Basidien 4-sporig.
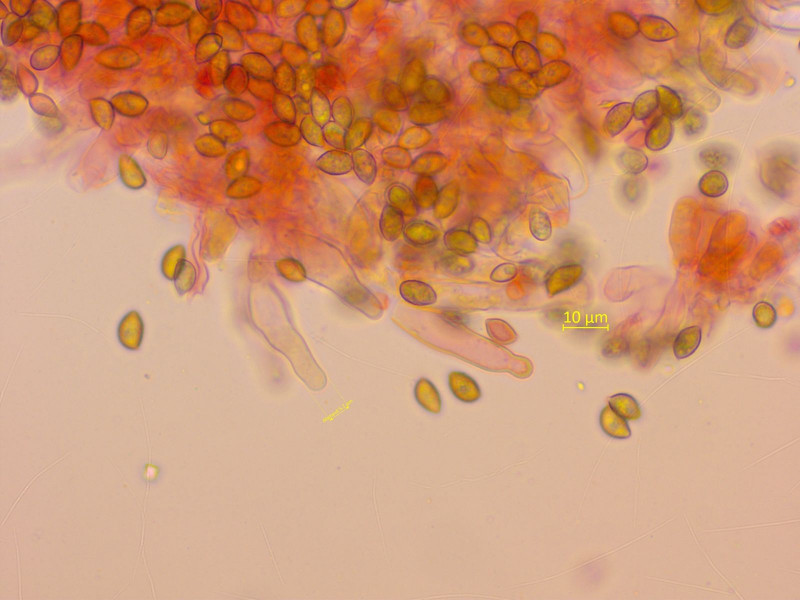
Die Cheilozystiden haben einen recht breiten Hals, was es nur bei wenigen Galerina's gibt.
Pleurozystiden konnte ich in mehreren Lamellenschnitten nicht finden.
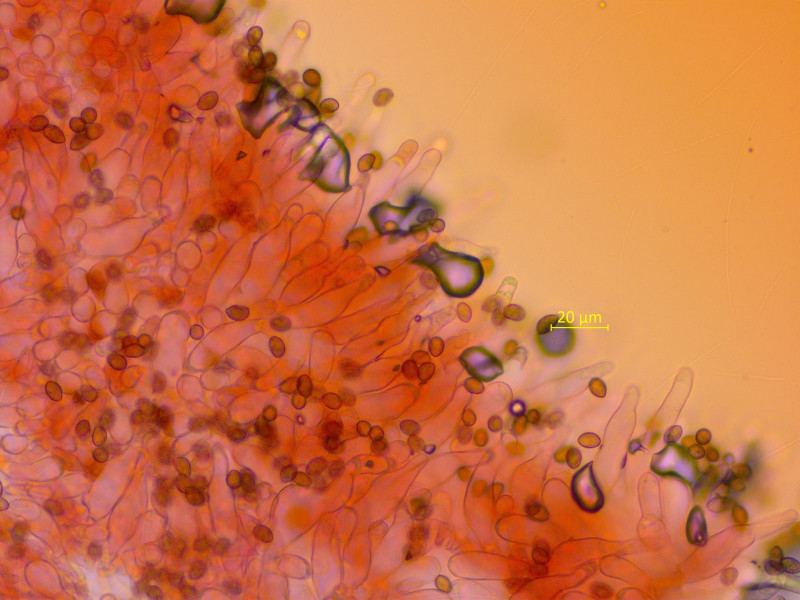
Kaulozystiden gab es (reichlich) im oberen Stieldrittel, unten nichts mehr.
7:

So eine schöne Gruppe Trichterlinge sollte doch bestimmbar sein? Weit gefehlt.
Am ehestens passt Infundibulicybe subsalmonea, nur der Habitus mit den trichterigen Hüten stört.
KOH auf dem Hut übrigens negativ.
Leider sind diese Trichterlinge auch genetisch schändlich vernachlässigt, weshalb eine Sequenzierung keine Erleuchtung bringen wird.
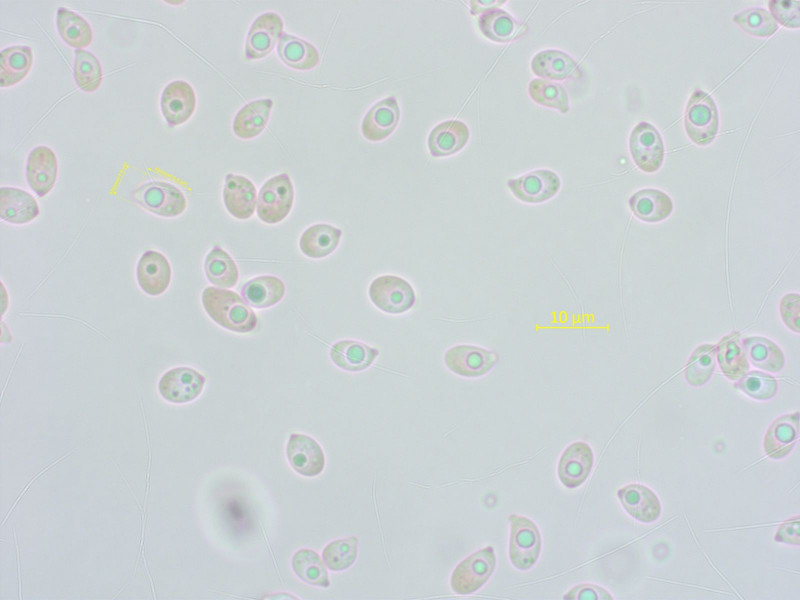
Die Sporen sagen in der Gattung wenig aus.
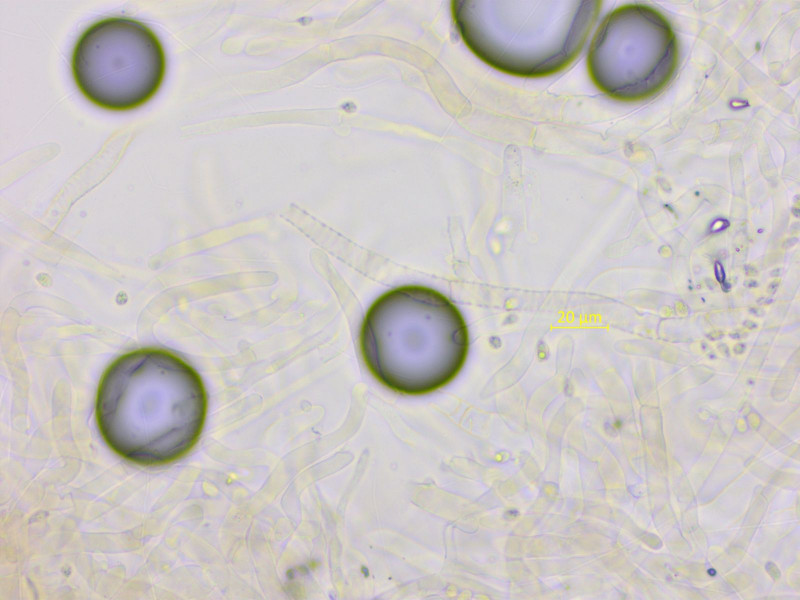
Wichtig ist das HDS-Pigment, das stellenweise deutlich inkrustierend ist.
8:

Eine Gruppe roter Becherchen auf frischem Sand. Könnte ich mich Melastiza carbonicola richtig liegen?
Wie ich gelesen habe, kommt die Art trotz ihres Namens auch auf sandigen Böden vor, nicht nur auf Brandstellen.
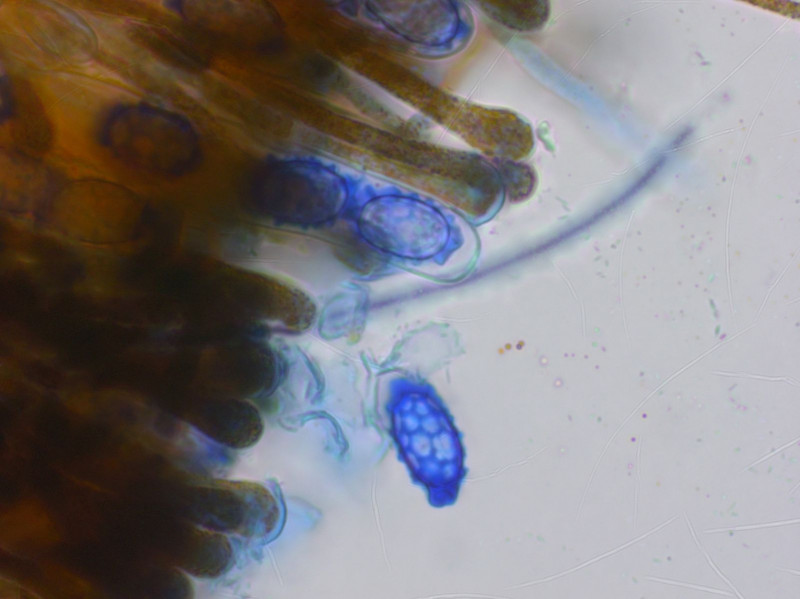
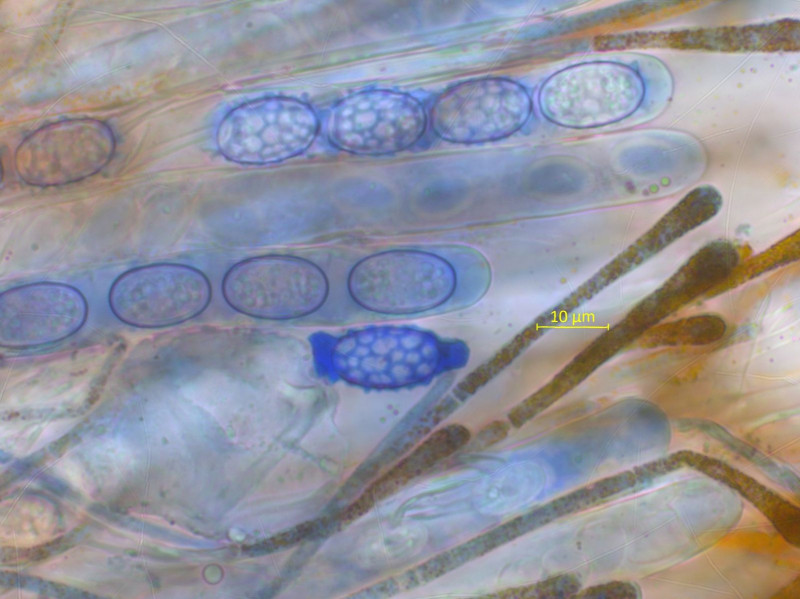
Die Sporen sind schön in Baumwollblau. Ein ziemlich regelmässiges Netz, nur an den Enden grössere Auswüchse.
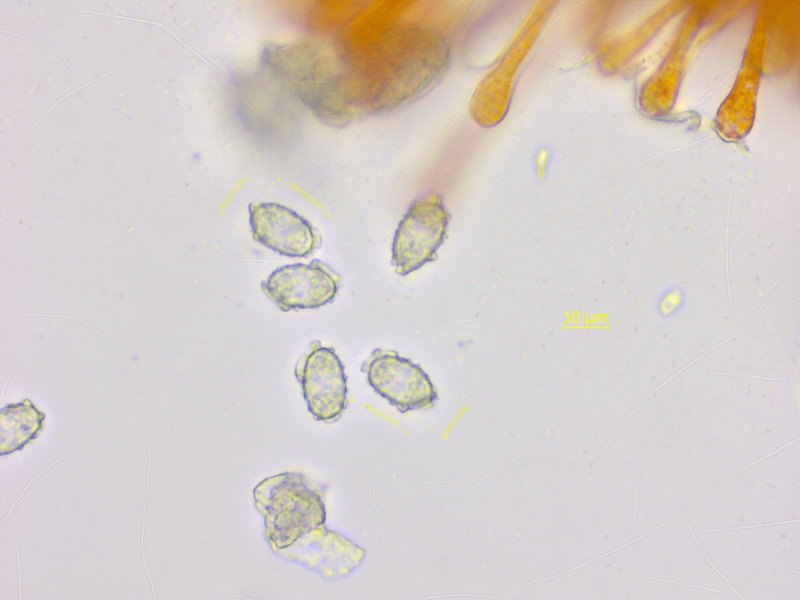
Brav nach Schulbuch hier nochmal in Wasser gemessen, etwa 14-15 x 9.10 µm.

Paraphysen
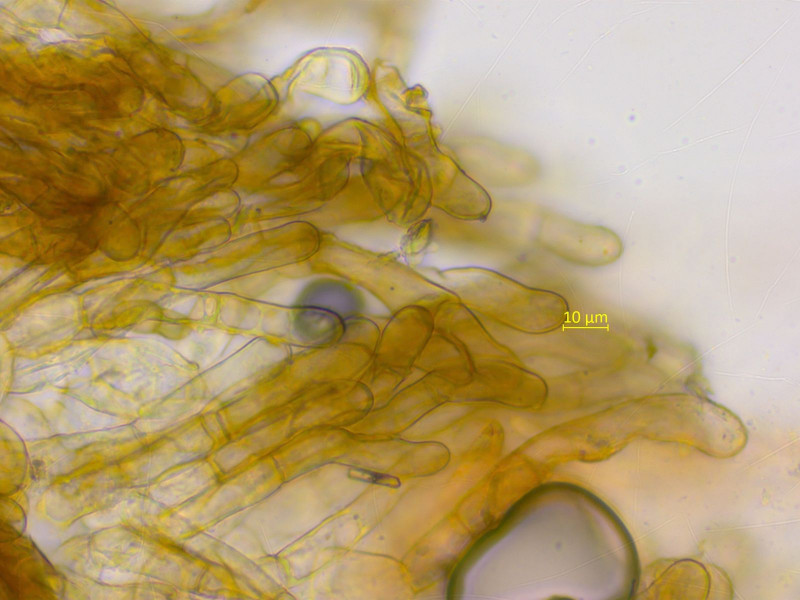
Haare am Rand
Die folgenden Sachen stammen aus einem anderen Gebiet, auch mit Kalk, ca. 2500m.
Hauptsächlich Salix reticulata, herbacea, retusa.
Ausserdem gab es riesige Wiesenpilz-Flächen, leider noch wenig ertragreich.
9:

Ein Samthäubchen auf altem Kuhdung. Da kommt schon mal nicht sooo viel in Frage, ich komme auf Conocybe nitrophila.
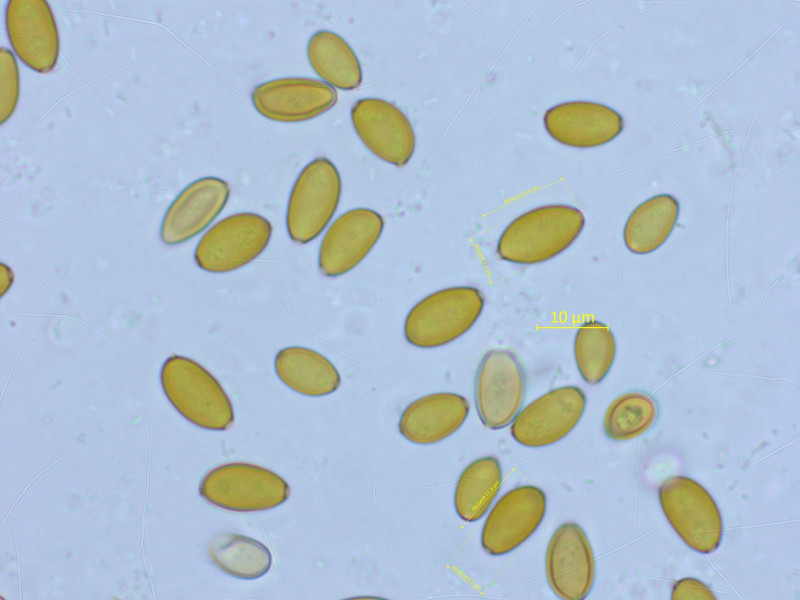
Sporen um 11-12 x 6-7 µm.
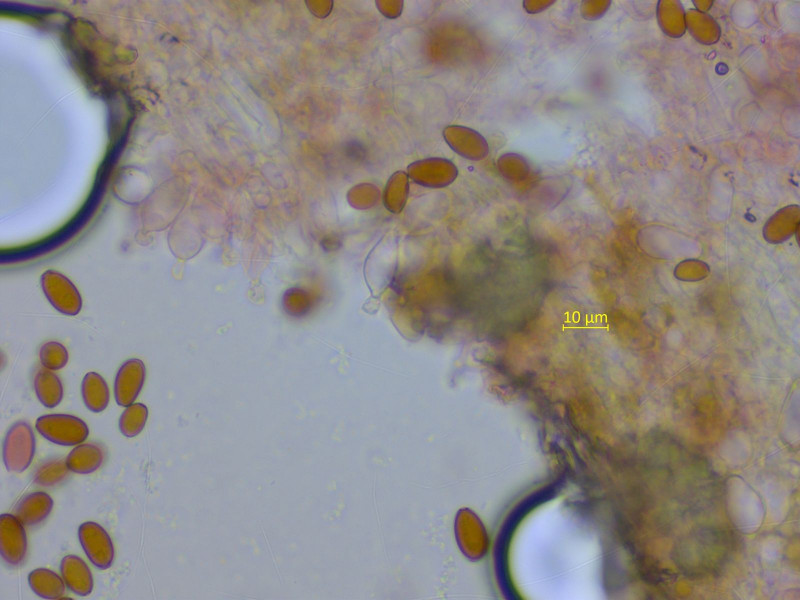
Cheilozystiden wie sie halt sind...
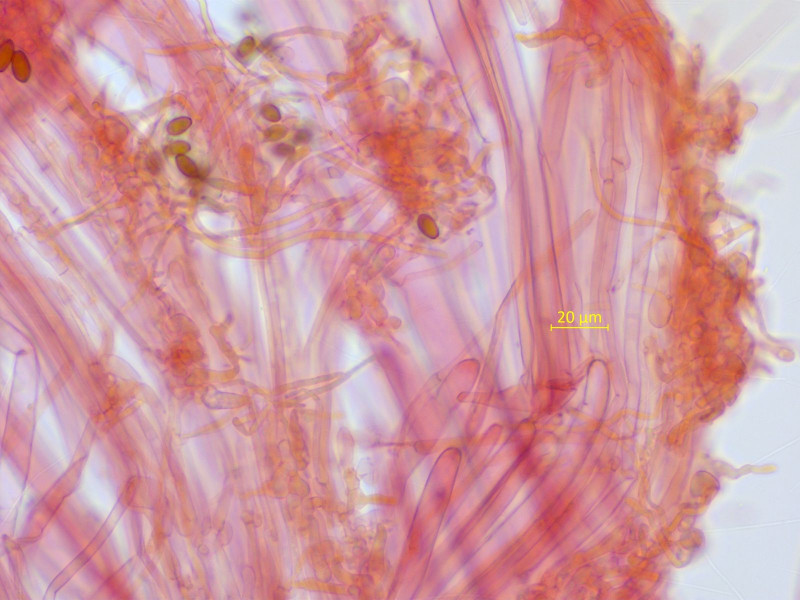
Stiel ohne lecythiforme Zystiden, nur polymorphe Elemente und Haare.
10:

Einfach schön, nicht mitgenommen. Aber es sollte Cortinarius alpinus sein.
11:

In den Bergen auch leicht zu erkennen: Cortinarius subtorvus.
12:

Leider nicht mehr taufrisch, aber diese kleine Gruppe brauner Rötlinge machte mich neugierig. Hut bis 20 mm breit.
Vielleicht einfach Entoloma conferendum? Oder doch nicht?
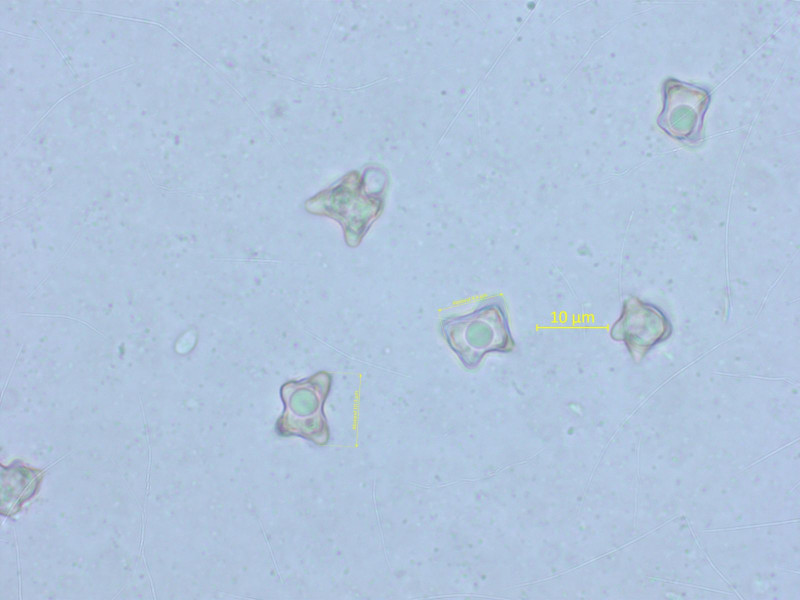
Sofort war klar, dass er kreuzförmige Sporen hat. Die sind aber für Entoloma conferendum fast alle zu gross, 9.5-11.5 µm lang.
Damit könnte es auch das ähnliche Entoloma milthalerae sein. Oder auch nicht, und es ist nur ein untypisches conferendum.
13:

Entoloma porphyrogriseum ist ja wirklich nicht selten, aber immer wieder schön.
14:

Noch eine Galerina, dieses Mal die häufige Galerina vittiformis f. bispora.
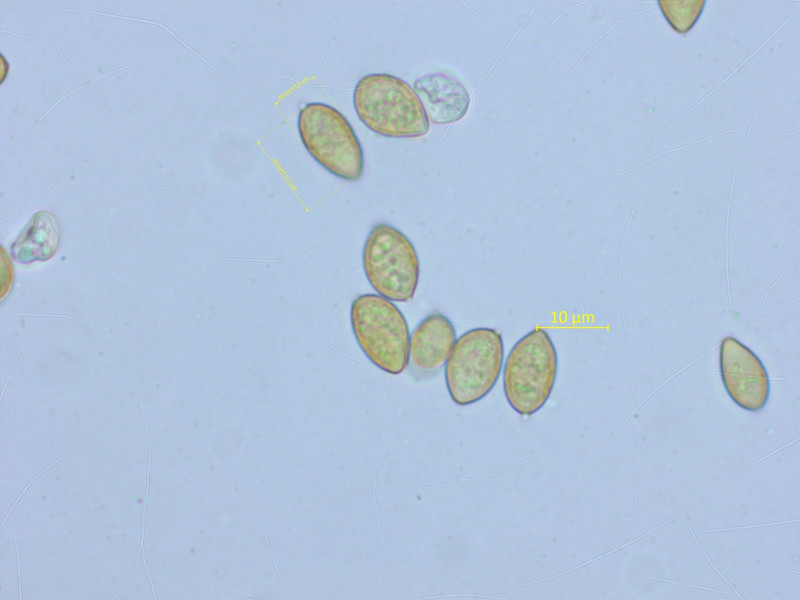
Auch hier sind die Sporen fast glatt, aber etwas grösser als bei der Kollektion weiter oben.
Basidien 2- oder 1-sporig, Schnallen vorhanden.
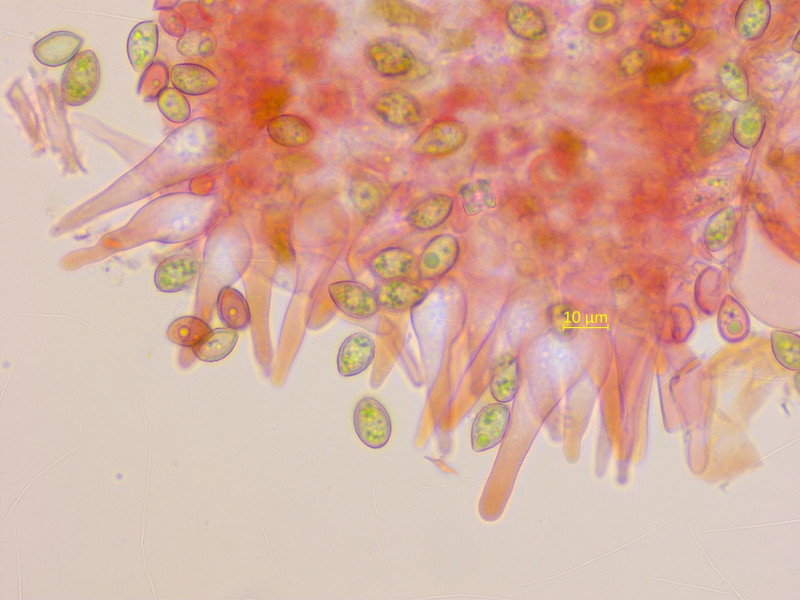
Die Zystiden sind (meistens) schlanker spindelig.
15:

Dieses Pilzchen lässt sich sehr einfach nach seinem Standort mitten in den Kratzdisteln bestimmen:
Phloeomana ochrogaleata (früher Hemimycena).
Wo es viele Kratzdisteln gibt, ist die Art häufig. Aber es braucht Nerven, um ohne Gartenhandschuhe an sie ran zu kommen.
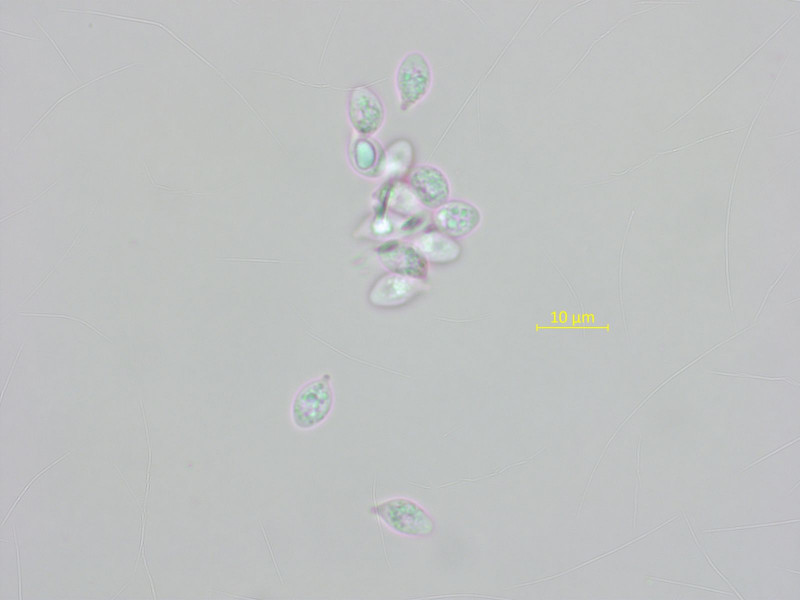
Sporen oft angedeutet zitroform mit kräfitgem Apikulus.
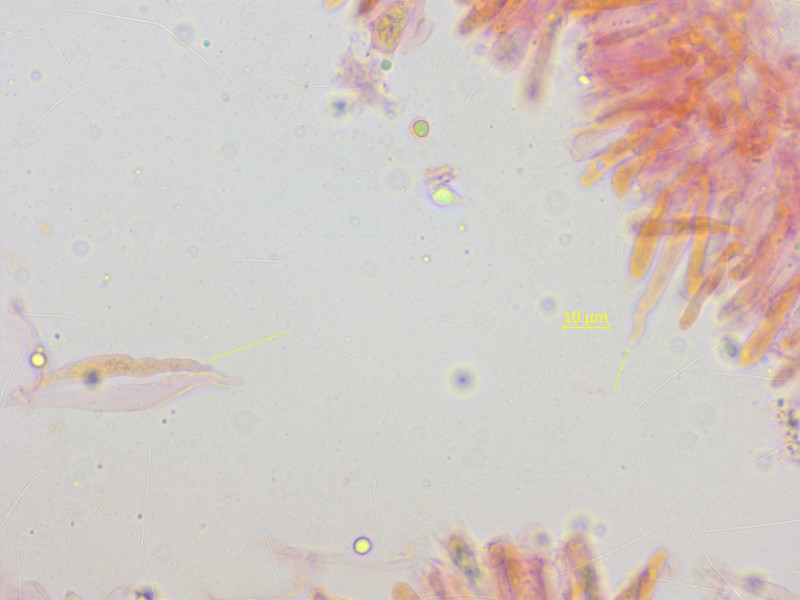
Zystiden schlank, mit wellig-spitzem Apex.
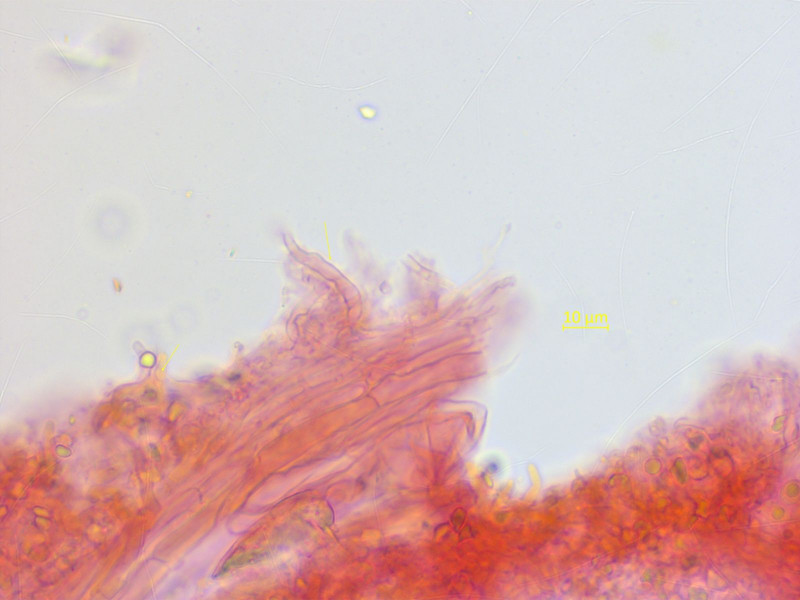
Die HDS ist schwierig zu mikroskopieren, aber man kann die typischen Auswüchse mit etwas gutem Willen sehen.
Es folgt dann noch eine Wagenladung Risspilze. Später...
LG Raphael


