Hallo zusammen
Am Mittwoch habe ich eine kleine Wanderung in ein nahegelegenes, sehr abgeschiedenes Gebirgstal gemacht.

Der Aufstieg am frühen Morgen führte mich über herrliche Rötlings- und Saftlingswiesen (zwischen 2200 and 2350m).
Aber weil ich noch viel weiter laufen musste, konnte ich dort nicht viel Zeit verbringen. Naja immerhin:
1:

Dieser Rötling ist ein schreckliches Chamäleon: Entoloma caesiocinctum.
Von dunkelbraun über blau bis rosabraun kann der so ziemlich jede Farbe.
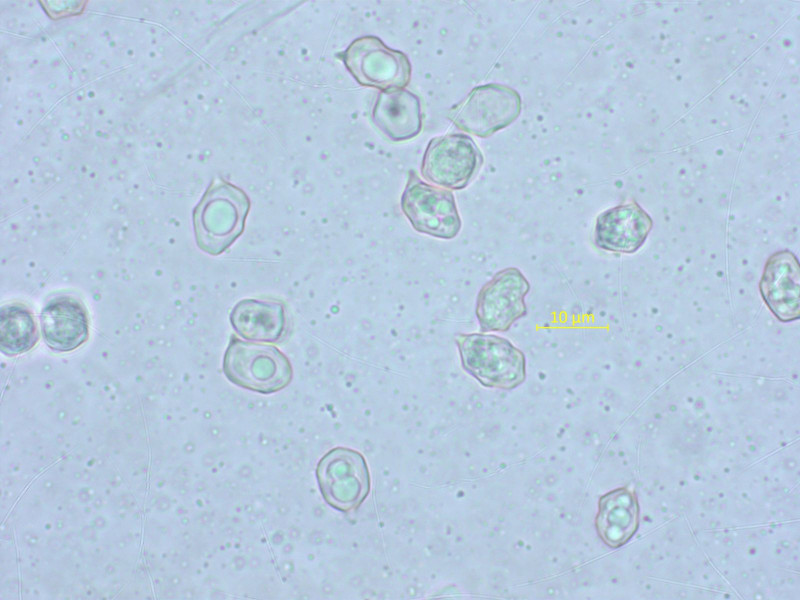
Die Sporen haben keine Auffälligkeiten.
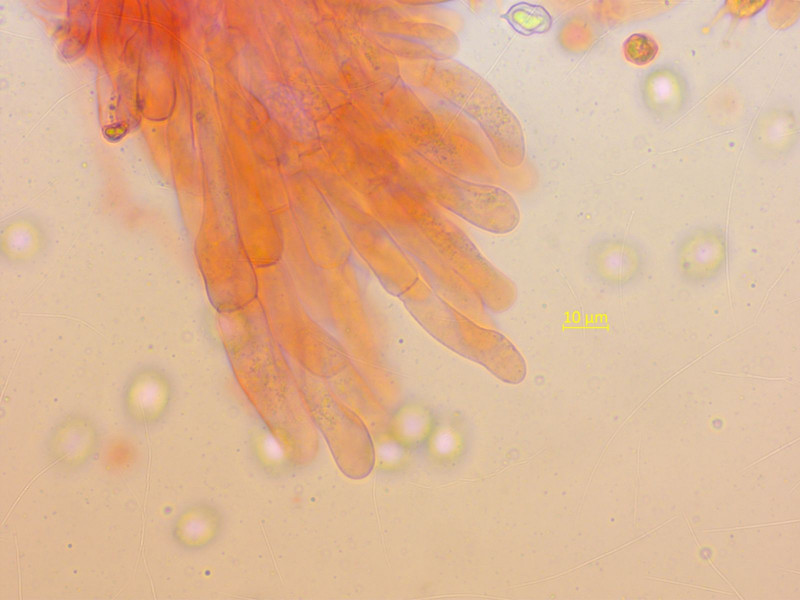
Lamellenschneide mit Zystiden vom carneogriseum-Typ.
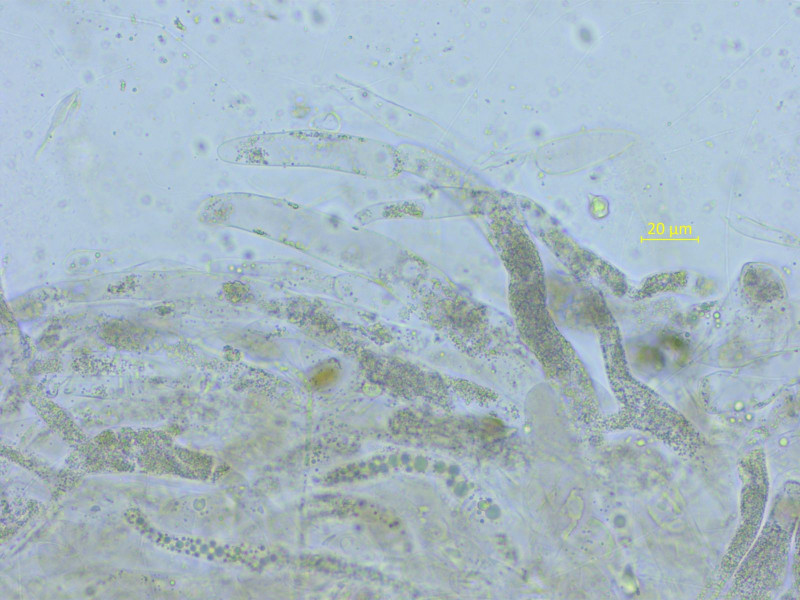
Die HDS und ihre Pigmentierung muss man auch beachten. Hier körnig und graubraun.
Aufgrund der enormen Variabilität dieser Art sehe ich mich im Moment nicht in der Lage, das als sichere Bestimmung zu betrachten.
Hier zum Vergleich zwei sequenzierte Kollektionen von letztem Jahr:

(2024 als E. carneogriseum bestimmt)

(2024 ohne Bestimmung). Ich wäre nie auf die Idee gekommen, dass diese beiden Kollektionen dieselbe Art sind.
2:

Auf der gleichen Wiese. Nun könnte man den Verdacht haben, dass es die gleiche Art ist.
Aber ich komme auf einen anderen Namen (ohne Gewähr): Entoloma montanum.
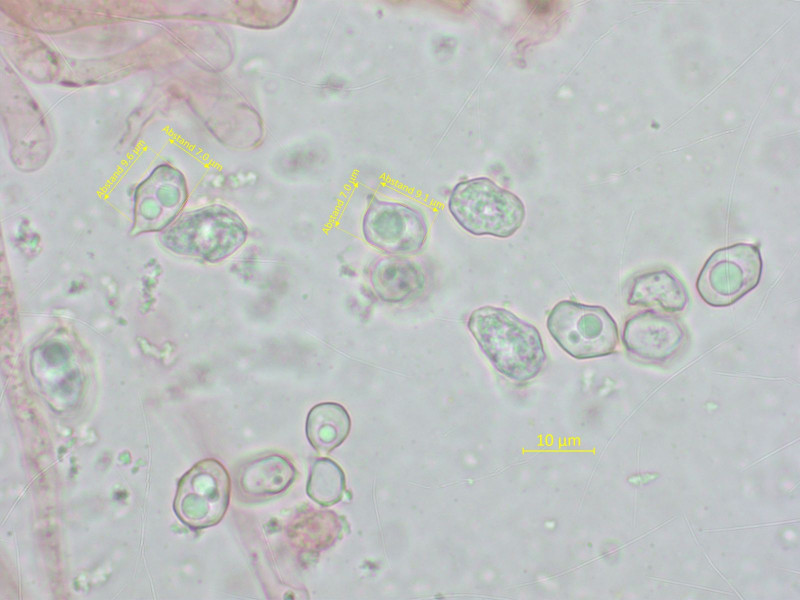
Die Sporen sind wieder ohne auffallende Merkmale.
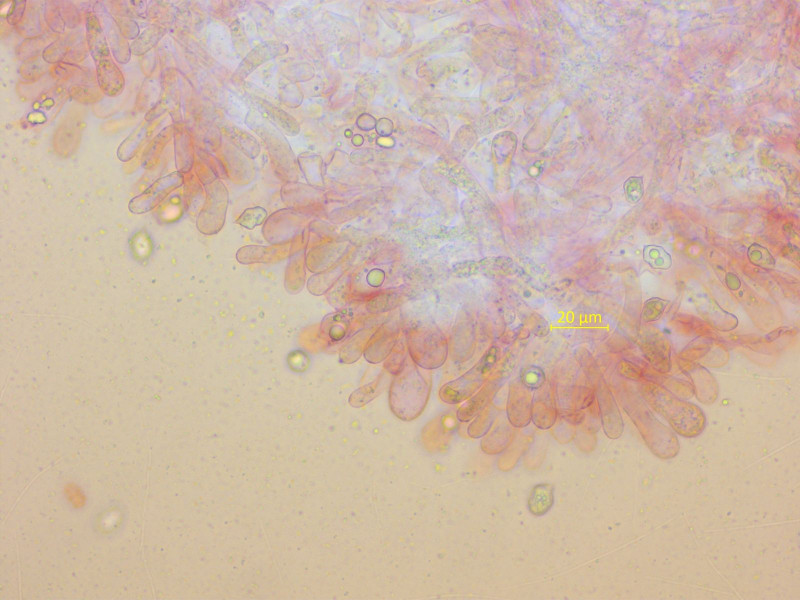
Die Cheilozystiden sind oft deutlich breiter-keulig und wachsen aus dem Subhymenium, also vom poliopus-Typ.
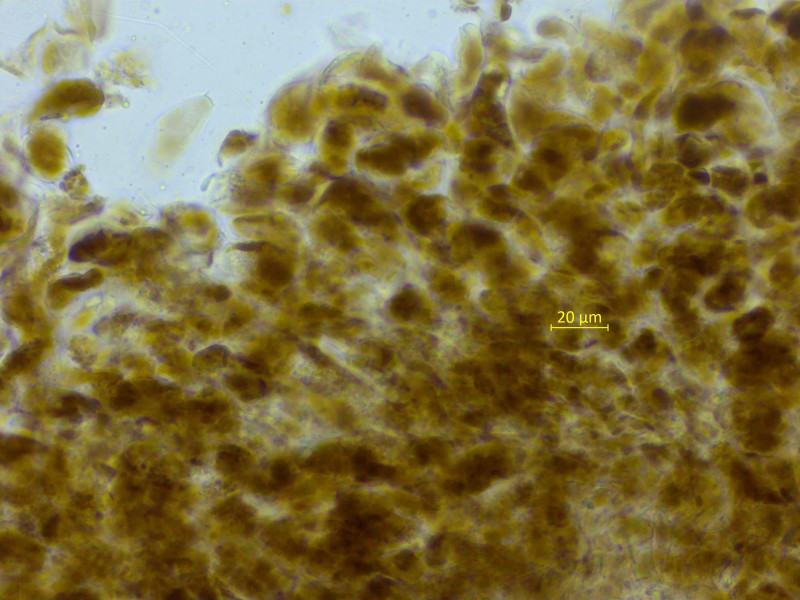
Die HDS sieht auch völlig anders aus. Hier diffus-klumpig und viel kräftiger braun.
3:

Gliophorus psittacinus kennt ihr alle.
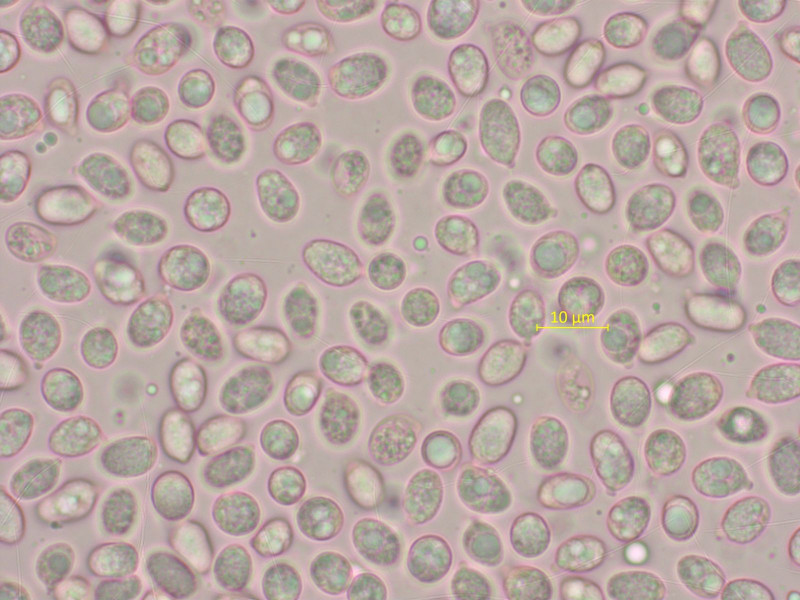
Sporen im Abwurf
4:

Tricholoma hemisulphureum ist wohl in der Höhe recht verbreitet, man findet ihn aber auch in tieferen Regionen.
Er stinkt wie ein normaler Schwefelritterling, hat aber viel weniger freudige Farben.
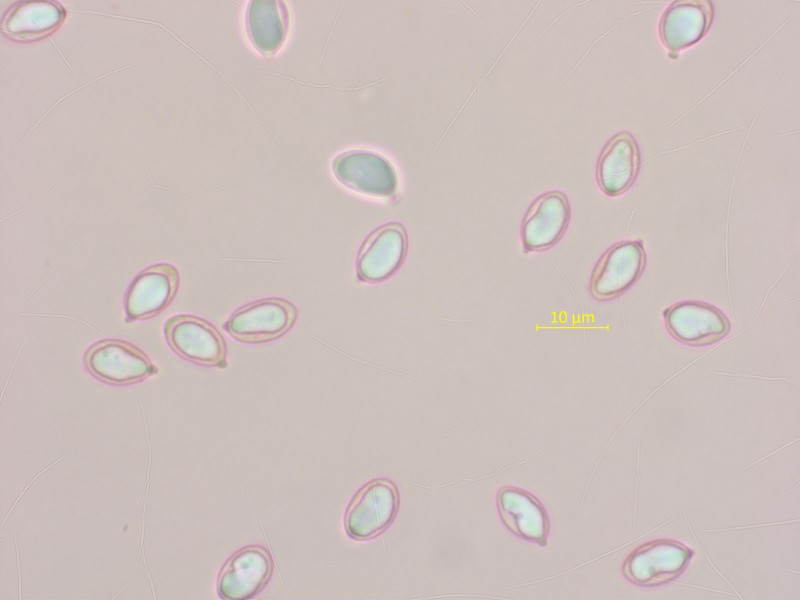
5:

An diesem Rötling beisse ich mir die Zähne aus. Letztes Jahr hatte ich eine ähnliche Kollektion als E. griseocyaneum (= E. scabropellis) bestimmt.
Aber irgendwie gefällt mir das nicht. Selbst die jüngsten Exemplare hatten in beiden Kollektionen keinerlei Blautöne an den Stielen.
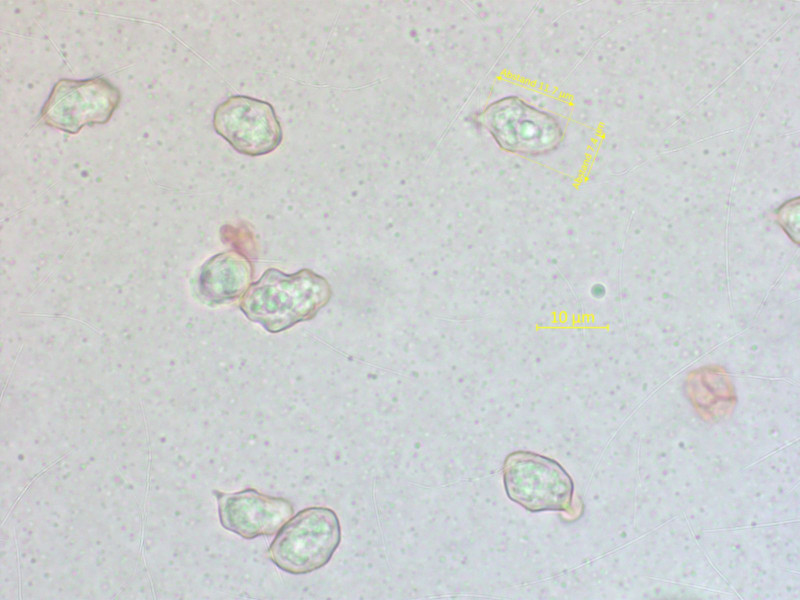
Die Sporen sind in der Tendenz fast knotig, so dass das vielleicht ganz woanders hin gehört.
Ich warte erstmal auf das kurz bevorstehende Paper zum undulatosporum-Clade.
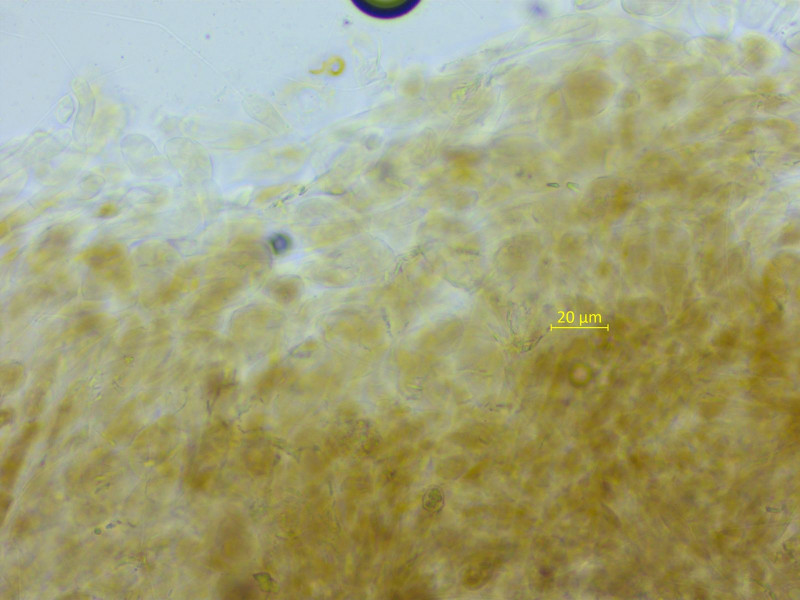
HDS mit braunen, intrazellulärem Pigment. Basidien übrigens viersporig, keine Schnallen, keine Zystiden.
6:

Ein Cortinarius aus den Anomali, die sind im Moment kaum bestimmbar.
Ich habe irgendwann aufgegeben und ihn als Cortinarius cf. eppsomiensis var. alpicola abgelegt.
In ein paar Monaten weiss ich vielleicht mehr.
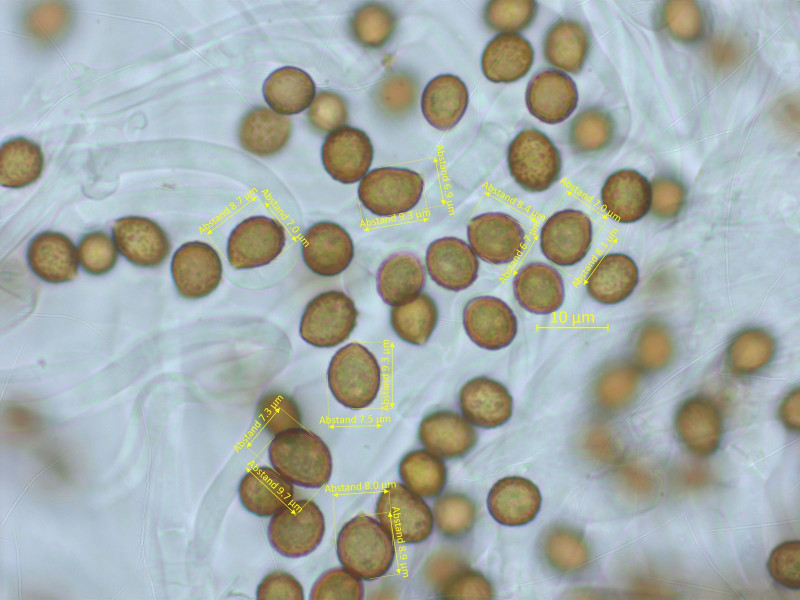
Sporen:

Das hier war das eigentliche Ziel, ein wunderbares Habitat, das nur von wenigen Wanderern, Schafen und Wölfen besucht wird.
7:

Dieser Trichterling heisst nicht ohne Grund "Stinkender Almen-Trichterling". Clitocybe festivoides ist wirklich ein unangenehmer Zeitgenosse.
8:

Diese dunkle Telamonia ist vermutlich recht häufig: Cortinarius inops. Aber ob das stimmt - wir werden sehen.
9:

Der hier könnte spannender sein, ich habe ihn mal vorläufig Cortinarius cucumisporus genannt.
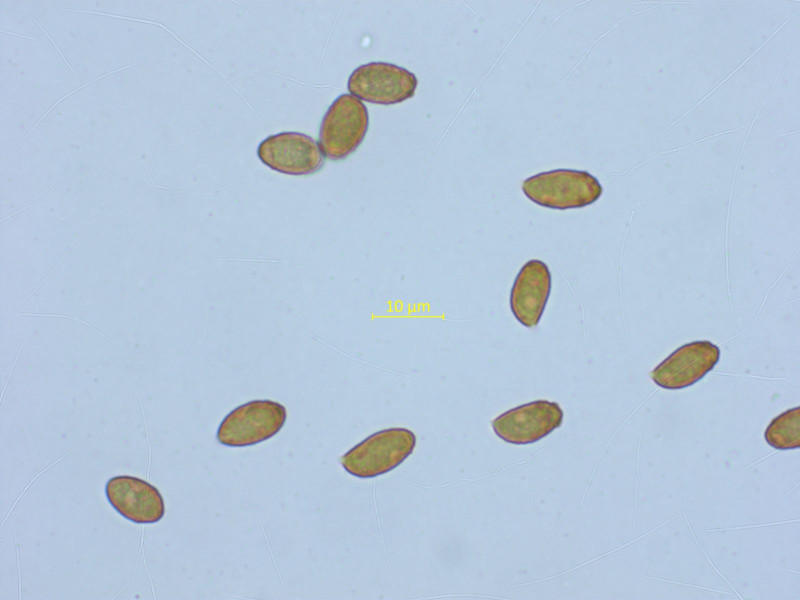
Die Sporen sind - wenn sie richtig liegen - auffallend fusiform, was typisch für diese Art ist.
10:

Über Helvella corium habe ich mich sehr gefreut, ich suche schon lange eine schöne Kollektion.
11:

Dieser dunkle Trichterling ist unverkennbar, Infundibulicybe lateritia.
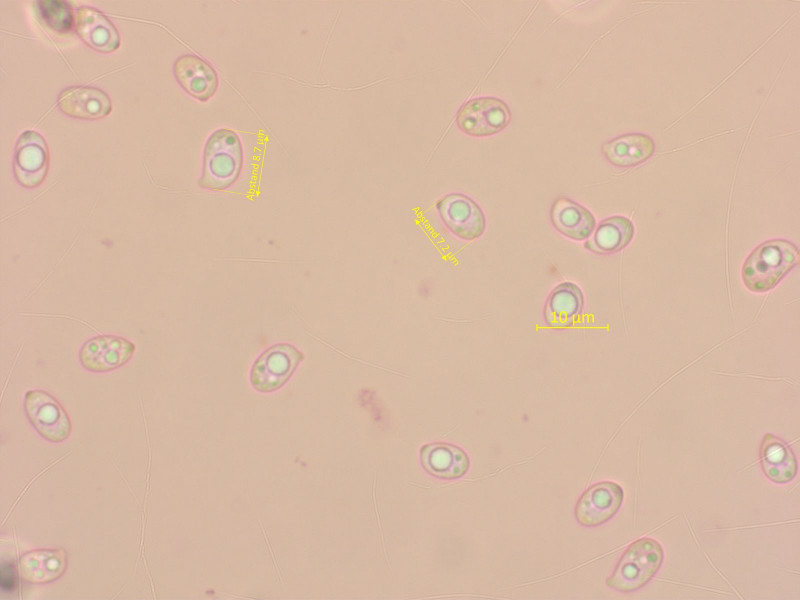
Sporen für die Gattung recht gross.
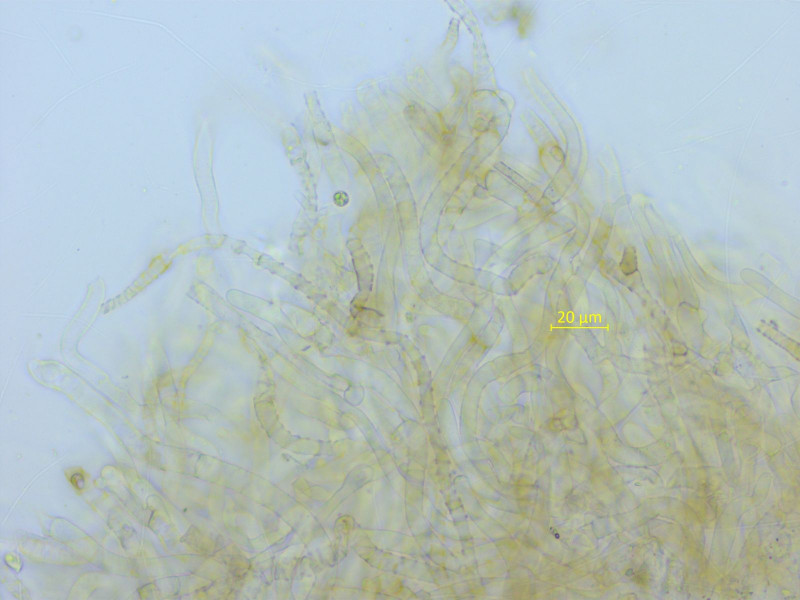
HDS-Pigment an vielen Hyphen inkrustierend.
12:

Ein Nabeling, dem ich sogar einen Namen geben konnte: Arrhenia favrei.
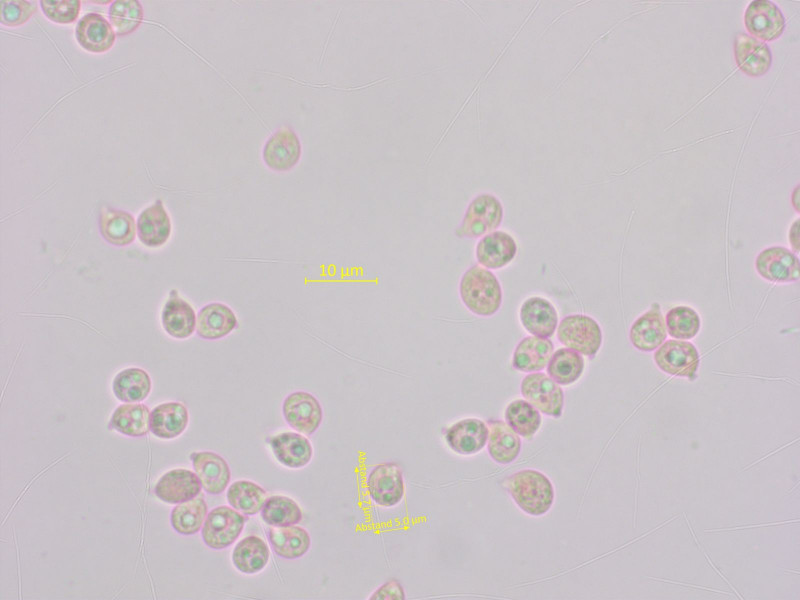
Die Sporen sind subglobos, von viersporigen Basidien.
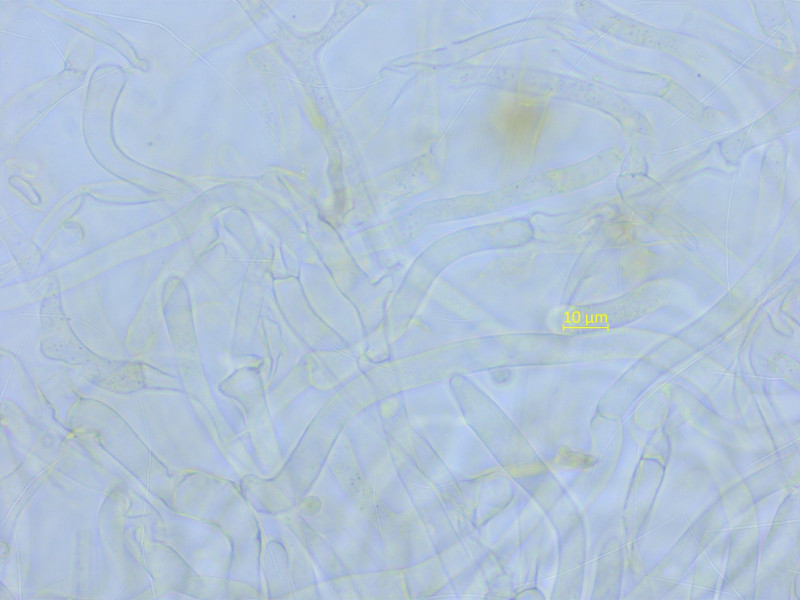
Die HDS ist rein intrazellulär pigmentiert, mit Schnallen, und das Lamellentrama ist bidirektionell.
Nun noch einige Risspilze, Ditte
Leider haben sie etwas Feuchtigkeit abbekommen, ich versuche es trotzdem mal.
Meine anfängliche Sammelfreude wurde gedämpft, weil ich gleich dreimal Inocybe canescens mitgenommen habe.
Die zeige ich hier jetzt nicht.
Habitat für alle: Auf Kalk bei Salix herbacea.
13:

Mallocybe arthrocystis (so vermute ich) gab es in grossen Mengen.

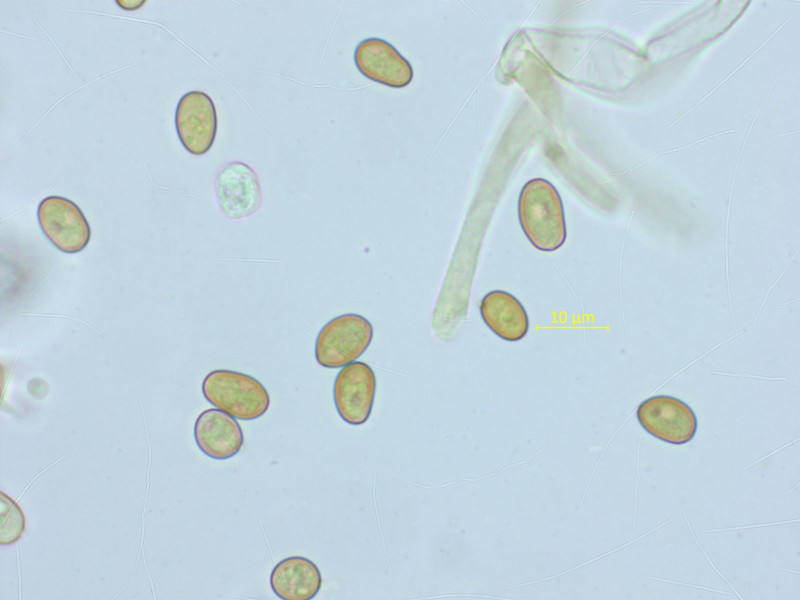
Sporen: 8.4-9.4-10.9 x 5.1-5.9-6.9 µm, Q = 1.33-1.59-1.92 (n=20)
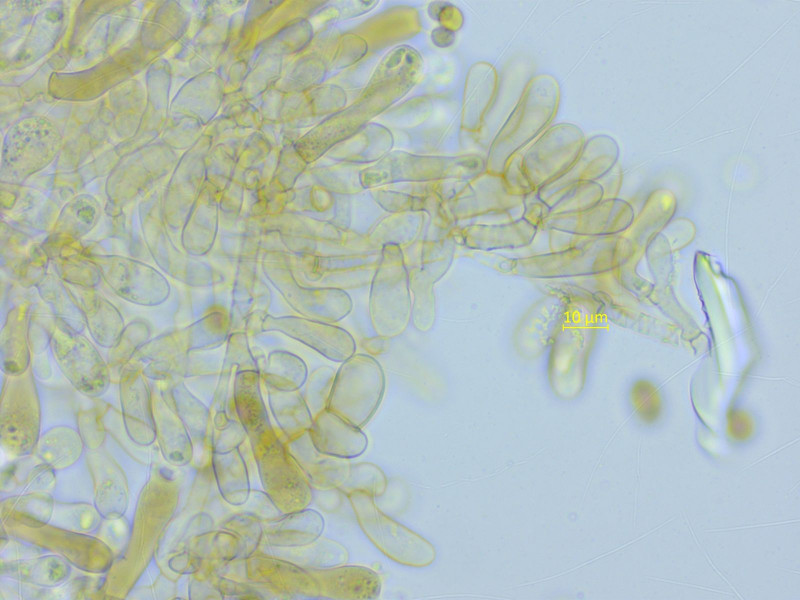
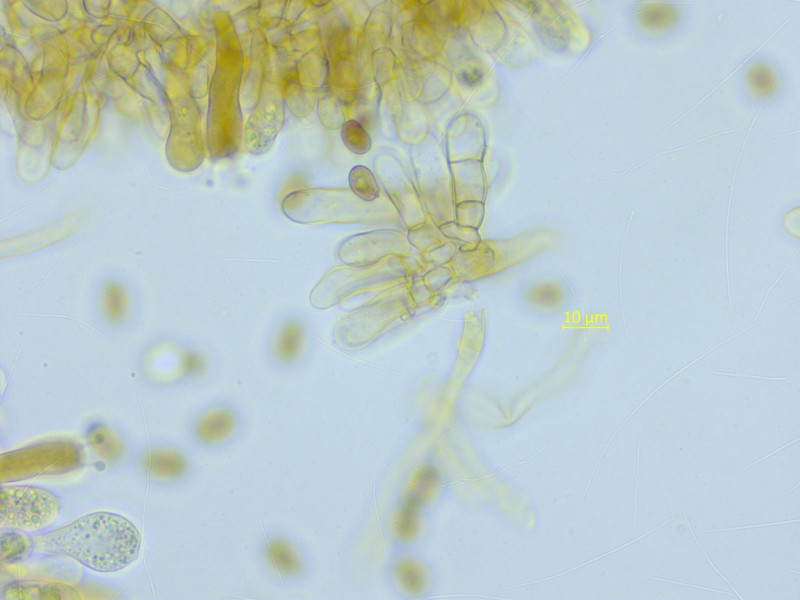
Zystiden recht variabel, stellenweise deutlich verkettet.
14:

Noch eine Mallocybe, mit recht viel Velum. In der Nähe habe ich schon zwei sequenzierte Kollektionen von Mallocybe leucoloma.
Ich vermute, das hier ist sie wieder. Mikroskopisch ist sie allerdings sehr ähnlich wie die vermutliche arthrocystis.

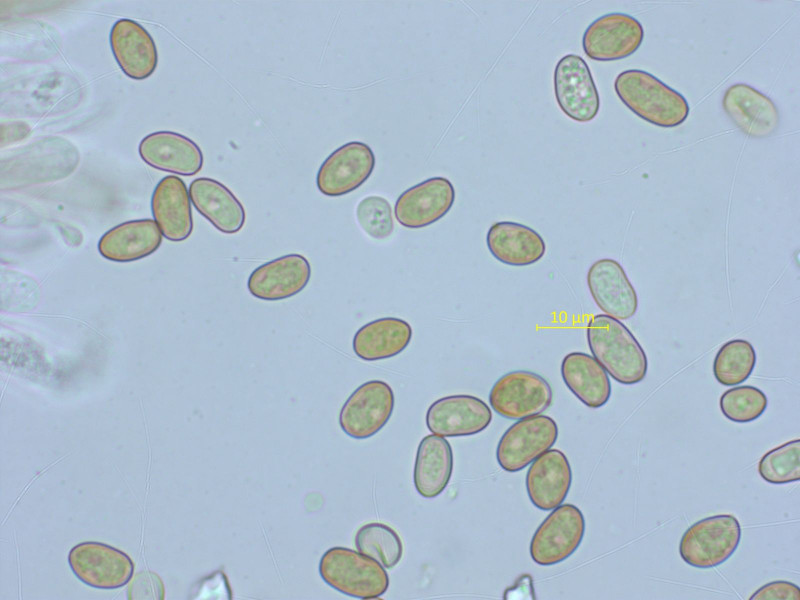
Sporen: 7.5-9.0-10.2 x 5.4-5.9-6.9 µm, Q = 1.34-1.53-1.72 (n=20)
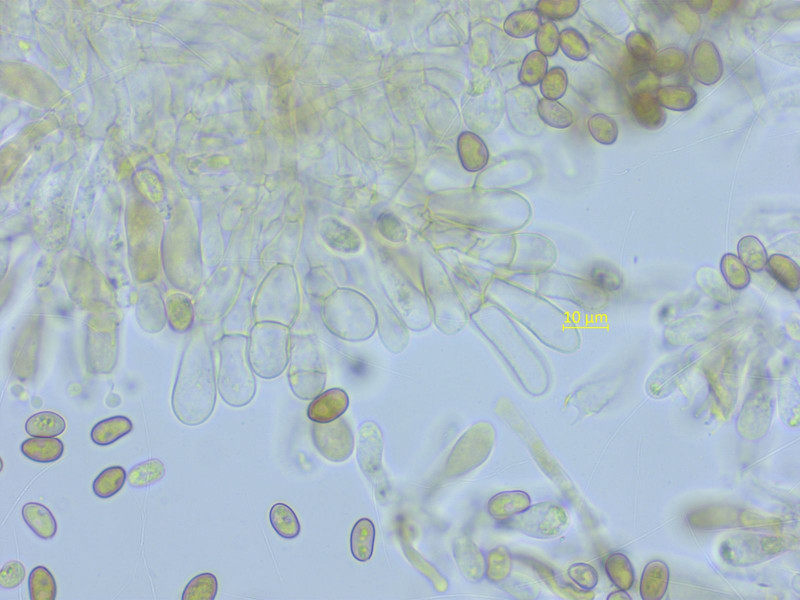
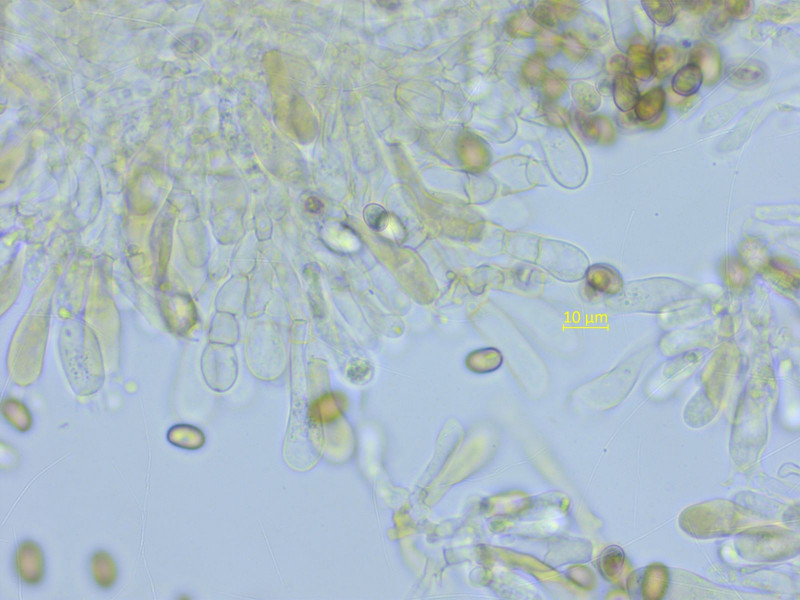
Zystiden teils einzeln, teils verkettet.
15:

Hier komme ich auf keinen plausiblen Namen. Geruch schwach, nicht spermatisch.

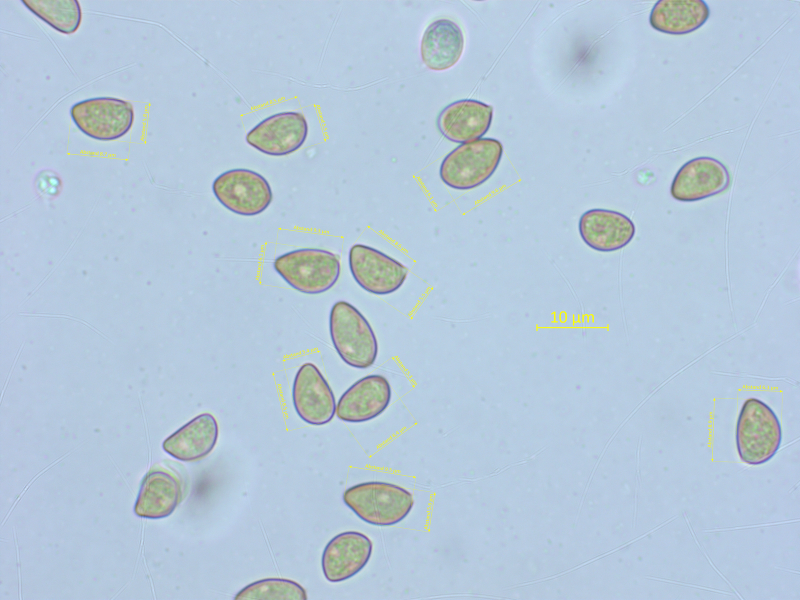
Sporen: 8.2-8.8-9.7 x 5.3-5.7-6.3 µm, Q = 1.35-1.54-1.75 (n=20)
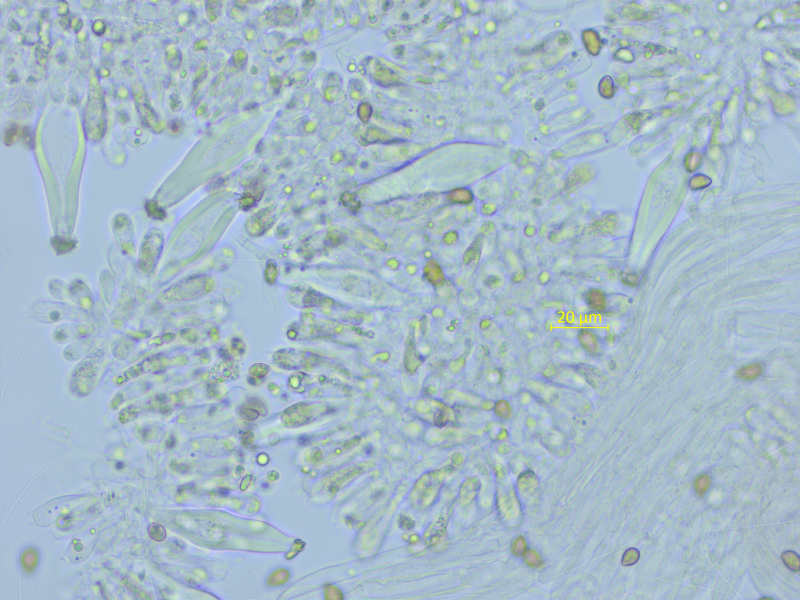
Pleurozystiden sehr dickwandig (bis 6 µm!), 54-59-65 x 14-15-17 µm.
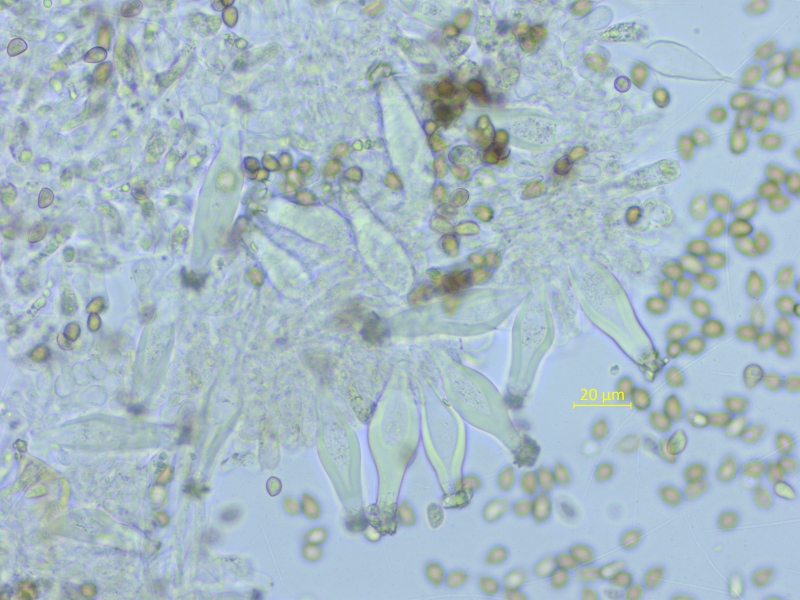
Cheilozystiden ähnlich.
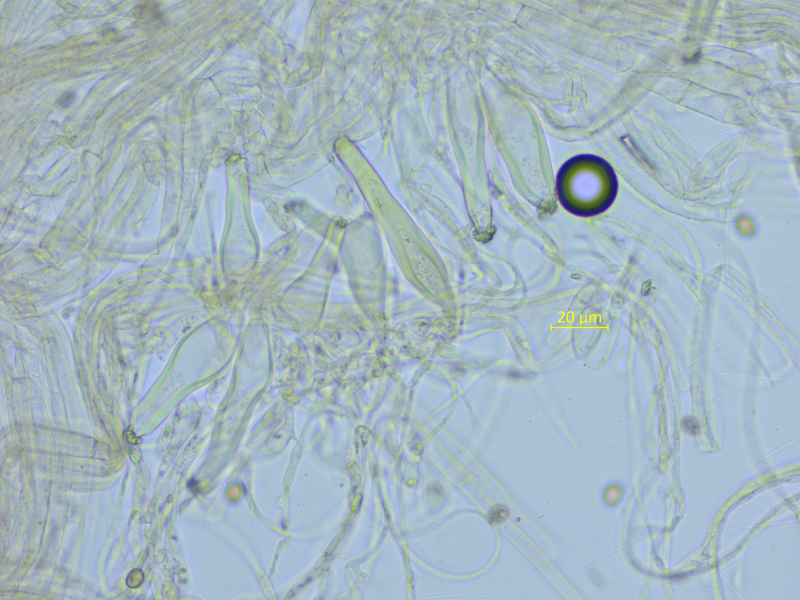
Kaulozystiden überall reichlich vorhanden.
So, das war's. Bitte korrigiert mich, wenn etwas nicht stimmt.
LG Raphael


