Servus zusammen,
danke Martin für den tollen Bericht! Viel kann ich da nicht hinzufügen. Es war schön euch mal in live zu treffen, das Wetter war viel besser als angesagt und befürchtet (auf der Hinfahrt kam ich in mehrere kräftige Regengüsse) - aber auf dem Gleichberg hatten wir bis Mittag eitel Sonnenschein.
Und so stapften wir umgeben von lecker Bärlauchduft den alten Vulkanstock empor. Je höher wir kamen, umso bunter wurde die Felsflechtengesellschaft da die Steine exponierter lagen und der im Wald vorherrschende Moosbewuchs zurück ging. Gleichsam verlangsamte sich unsere Wandergeschwindigkeit auf einen Kriechgang. Ähnlich unserer vierbeinigen Begleitung steckten wir unsere Nasen (mit Einschlaglupe davor) dicht an jeden Felsen am Wegrand.

Im Wald gab es außer dem von mir nicht abgelichteten Bärenlauch noch weitere hübsche Gewächse:
So etwa Leberblümchen (Hepatica nobilis)

und Märzenbecher (Leucojum vernum):

Etwas Kalk muss im Boden vorhanden gewesen sein, da sind natürlich auch (Wein)bergschnecken nicht weit (Helix psychedelica):

Sehr gefreut haben wir uns über einige Schuppenwurzen (Lathraea squamaria)- hauptberuflich Vollschmarotzer zB. an Hasel/Erle oder in unserem Fall Buche.

Nun aber zu den Flechten im Wald:
Pertusaria pertusa hatte Martin ja bereits ausführlich dargestellt da spare ich mir die Mikros:

Ein epiphytisches Moos mit stark verdrillten Blättchen wuchs daneben, ich wusste ich hatte es schon mal in einem Buch gesehen und dass es im urbanem Raum aufgrund der Luftverschmutzung selten ist, aber sein Name fiel mir nicht mehr ein. Zum Glück hab ich es zu Hause schnell wieder gefunden, es handelt sich um Ulota crispa aus der Ordnung der Orthotrichales. Natürlich musste ich gleich mal durchwuscheln, waren aber zufällig keine Moosbecher drin 

Die wohl von den Kelten oder irgendwelchen anderen Menschen in die Blockhalde gemauerten Rinnen beherbergten einen bunten Flechtenteppich (hier u.a. mit Rhizocarpon, Opegrapha, Lecidea)

Ich habe mir aus der Menge nur zwei herausgesucht um Bestimmungsversuche zu wagen (man möchte sich als Anfänger ja nicht zu sehr frustrieren)
Diese felderig aufgerissene graue Krustenflechte mit sehr großen (bis etwa 3mm) schwarzen lecanorinen Apothecien (also mit lagerfarbenem Apothecienrand) sollte Tephromela atra sein. KOH gelb.


Trotz der Größe der Apos schwierig zu schneiden. Konsistenz wie altes Bitumen. In KOH eingeweicht besser, aber dann keine Strukturen mehr.
Also nochmal ohne versucht: Hymenium dunkel violett. Mit Lugol etwas Blaufärbung.
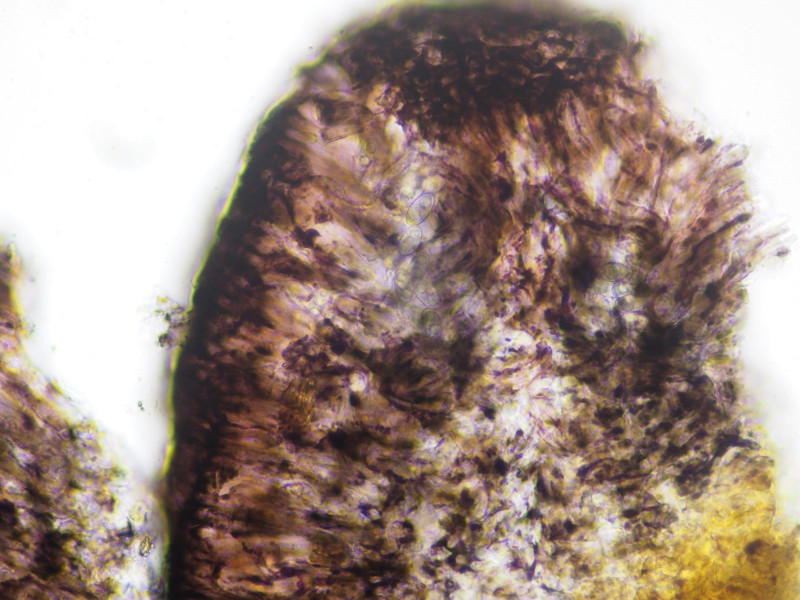
Sporen: (11.7) 12.2 - 13.2 (13.7) × (6.1) 6.2 - 6.76 (6.8) µm Q = (1.8) 1.9 - 2 (2.1) ; N = 8
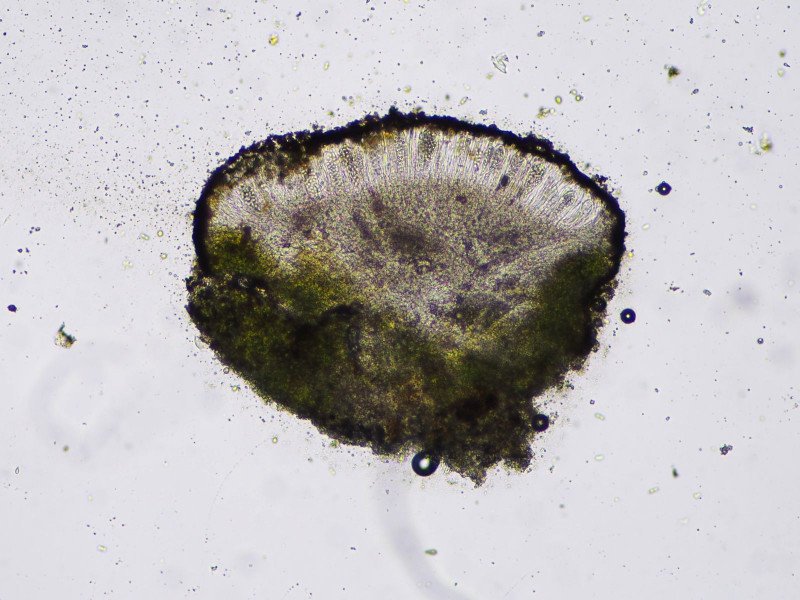
Außerdem nahm ich mir noch ein paar winzige gelbe Pünktchen mit:

Diese im Sonnenschein wunderbar sattgelben Apothecien maßen etwa 0,2-0,5mm.
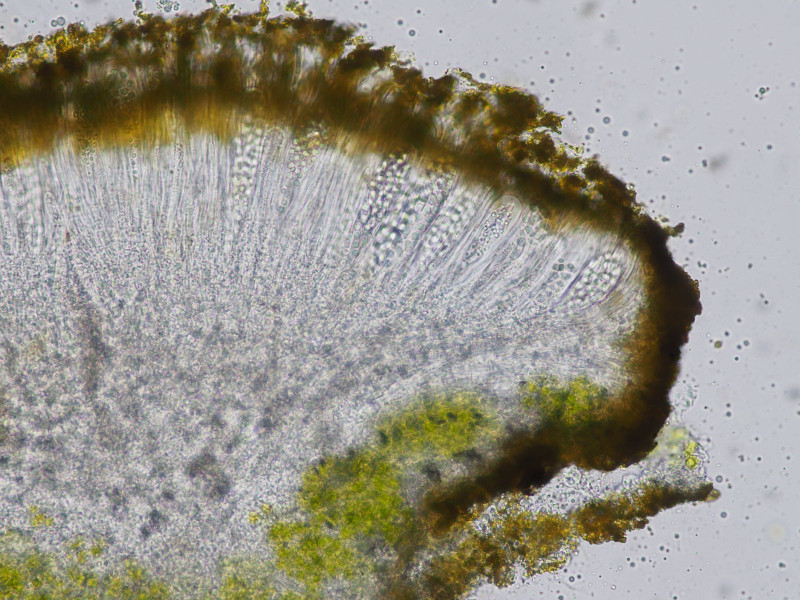
nochmal beschattet:

Es zeigt sich keine Reaktion auf KOH, daher scheidet Caloplaca aus und wir haben es mit Candellaria zu tun.
Hier kommen vor allem C. aurella und vitellina in Frage. Für C. aurella wird basisches, kalkhaltiges Substrat, C.vitellina saures Silikatgestein als Substrat angegeben.
Nun wird die Geschichte vom Anfang wieder relevant- ist der Basalt am Gleichberg basisch genug für aurella oder zu sauer? Ich tippe auf eher sauer, das ist aber nur mein Bauchgefühl.
Um es spannend zu halten- Martin hatte zwar Säure für einen Test auf Kalk dabei- soweit ich weiss aber dann doch das Gestein nicht mehr betüpfelt weil der Magen geknurrt hat und wir zur Vesper wieder abgestiegen sind.
Kommentar: (siehe Diskussion unten) Es ist kompliziert. Man muss zwischen sauer/basisch und kalkhaltig unterscheiden. Das habe ich hier vermischt. Magmatische Gesteine können sauer oder basisch sein, sie enthalten zumeist keinen Kalk, können es aber doch (Karbonatlinsen, Karbonatite). Ein Test auf Kalk wäre also doch nicht unsinnig und könnte im Zweifel Klarheit bringen.
Lugol färbt das Hymenium blau:
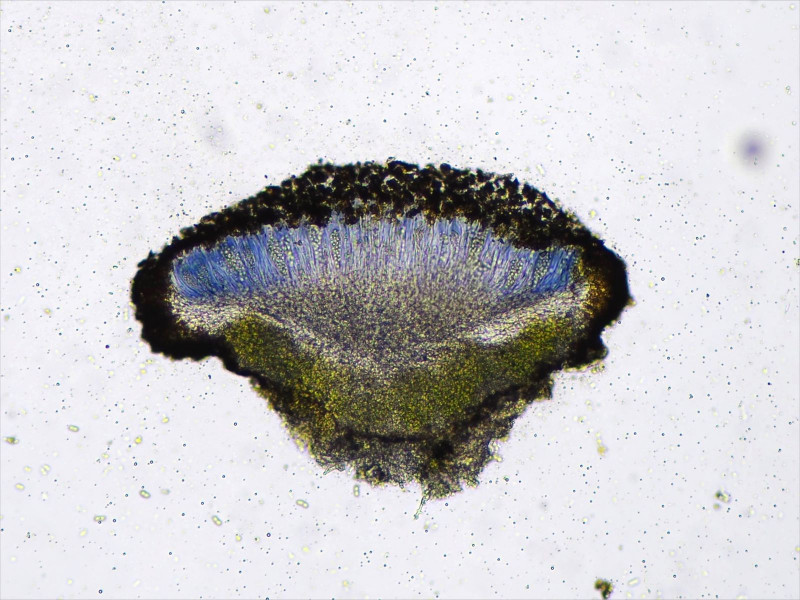


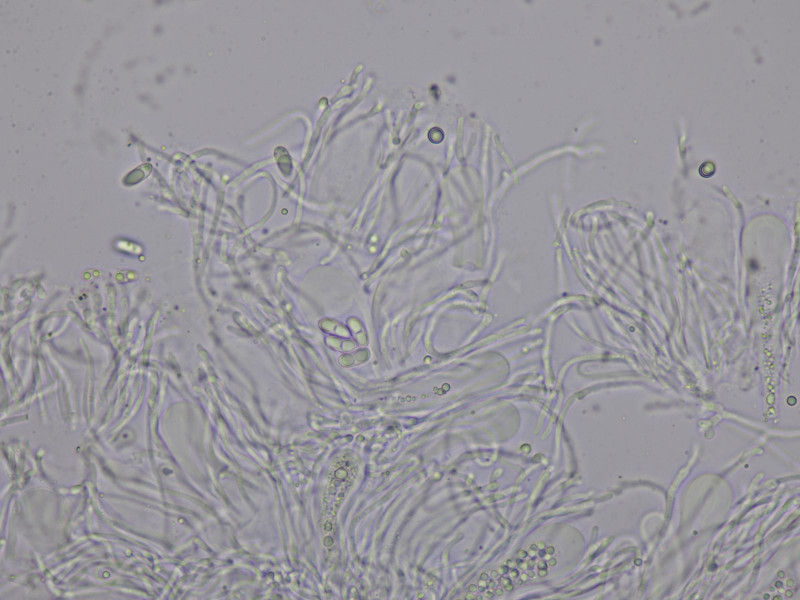
Algen chlorococcoid

Die Sporen messen 11 - 12.3 × 4.44 - 5.25 µm Q = 2.1 - 2.6 ; N = 4 und es sitzen eindeutig mehr als 8 im Ascus.
Damit lässt sich hier Candellaria vitellina bestätigen.
Die Sporen enthalten zwei große Öltropfen sodass es mir schwer fällt die wirkliche Anzahl zu schätzen, sind es 16 oder gar noch mehr? In der Literatur sind 12-24 angegeben.
Das wars von meiner Seite, ich hoffe ihr hattet auch Spaß dabei virtuell mitzukommen,
ich freue mich schon auf das nächste Treffen 
scheinbar wächst die Gemeinschaft der Flechtenfreunde hier im Forum ja- es kommt mir vor als erschienen fast die Hälfte der aktuellen Beiträge im einschlägigen Unterforum 
Viele Grüße
Ingo
![]()


