... kann man durchaus auch zu diesen Zeiten fündig werden. Auf eher kalkhaltigen Böden und Laubwald fanden sich insbesondere im und am Bachlauf viele Sachen. Hier mal die bestimmten:
01 Delicatula integrella - der weiße Adernabeling





02 Mycena renati - der gelbstielige Nitrathelmling

03 Paragalactinia succosa (Berk.) Van Vooren - der gelbmilchende Becherling




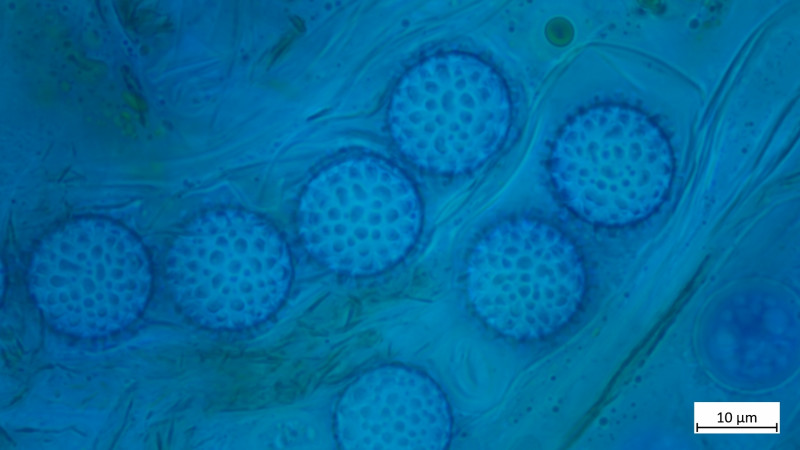
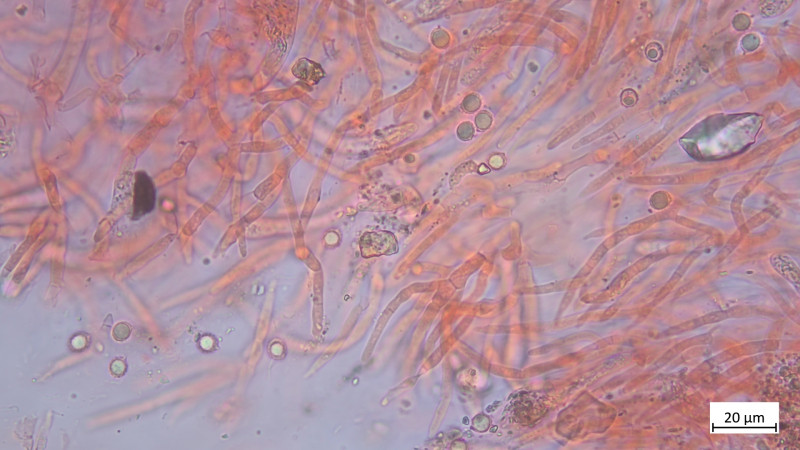
Sporen in BWB

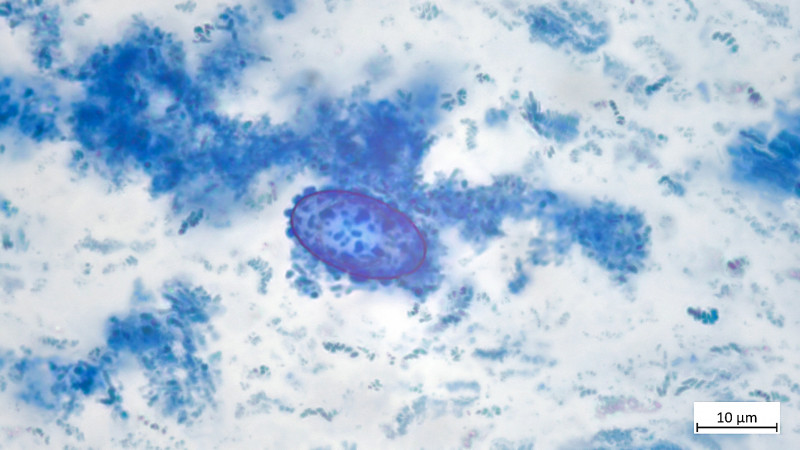
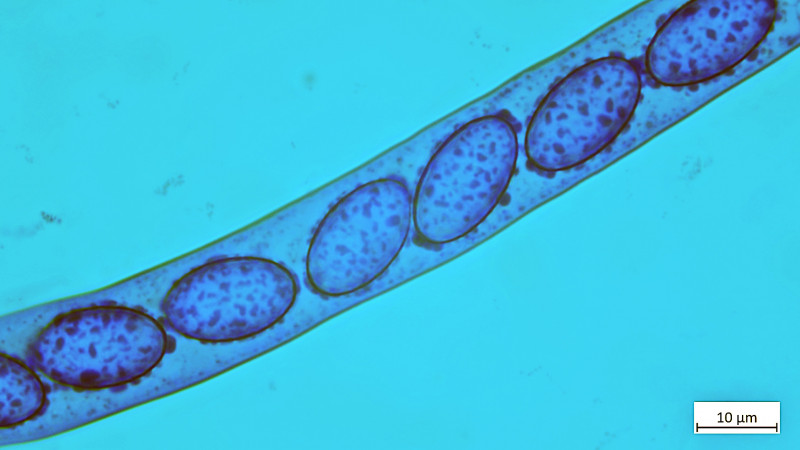
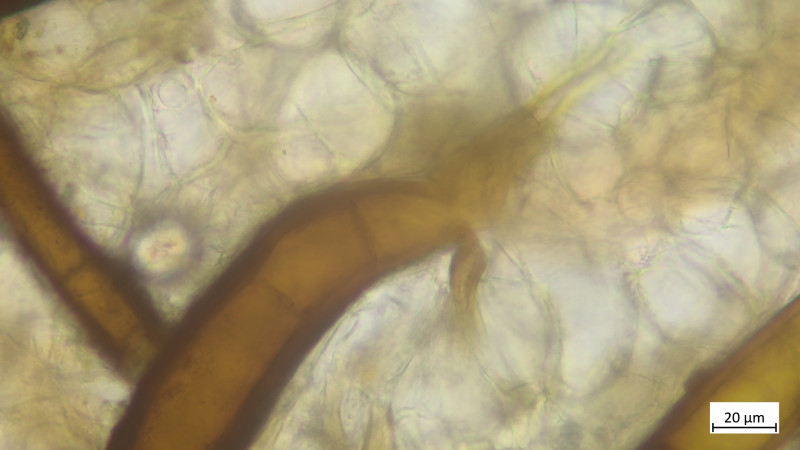
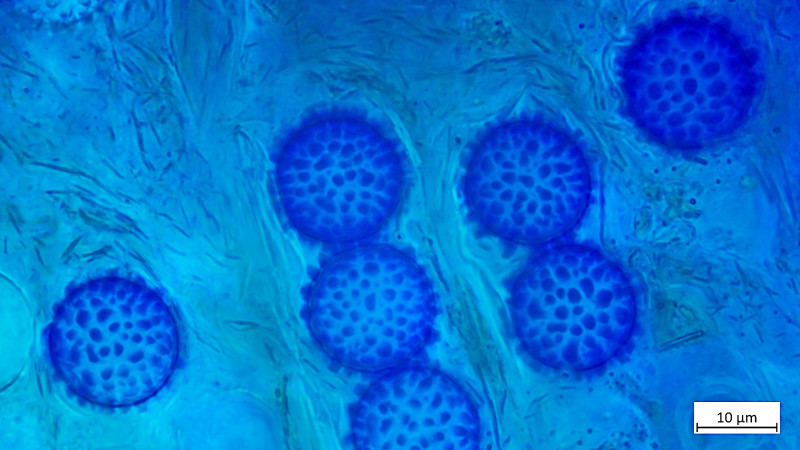
04 Scutellinia trechispora (cf) - der sternsporige Schildborstling (Erstfund für mich - endlich mal was anderes als crinita)



Haare durchaus lang mit Haaren >1200µm, zudem zumindest teils verzweigt gewurzelt


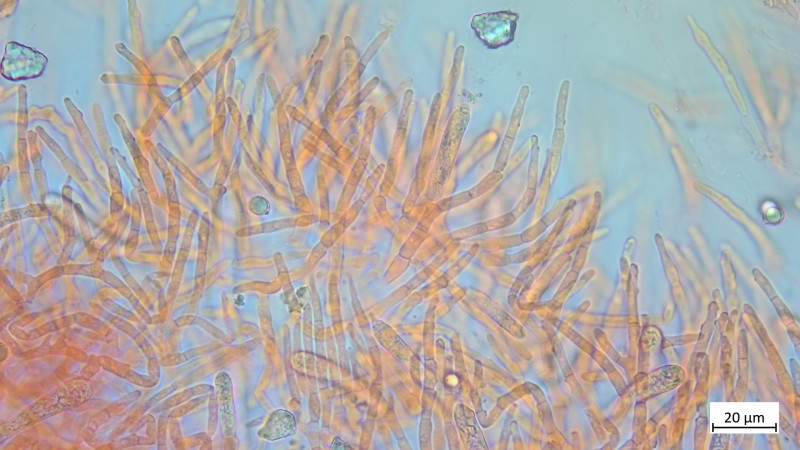
Sporen in BWB ca. 16x16:


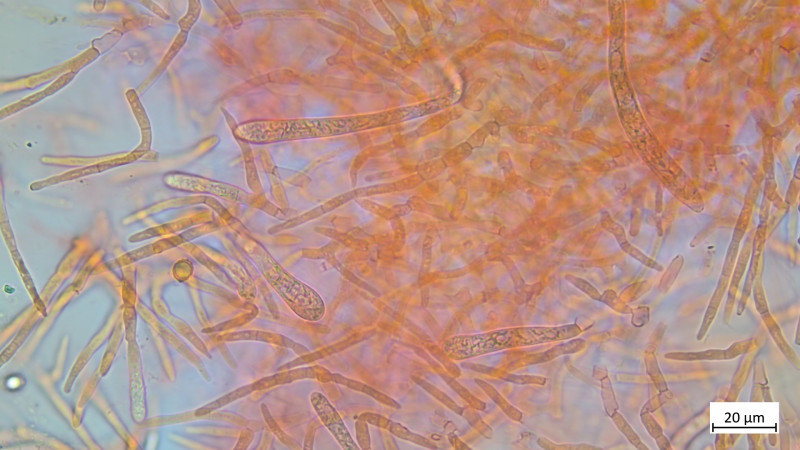
Paraphysen keulig und septiert:
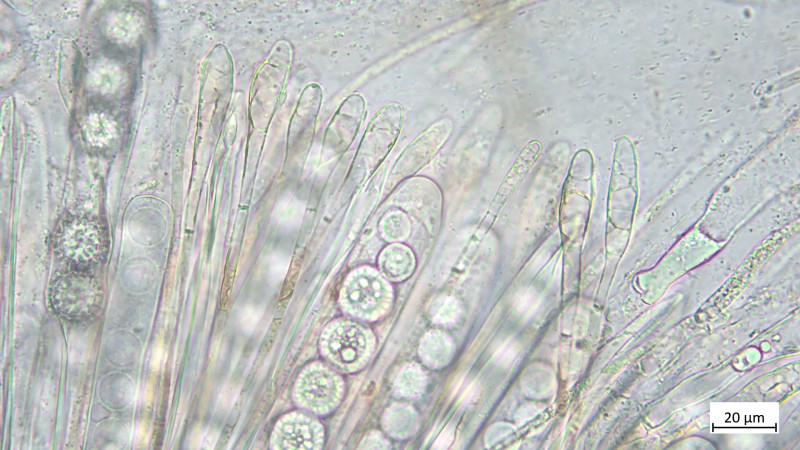
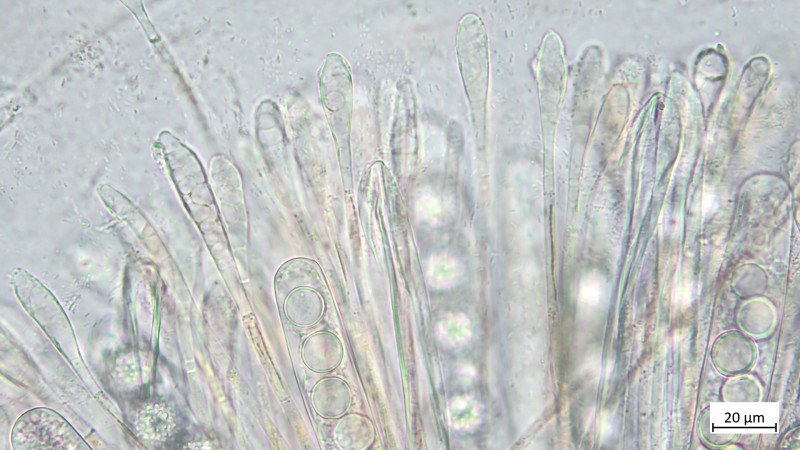
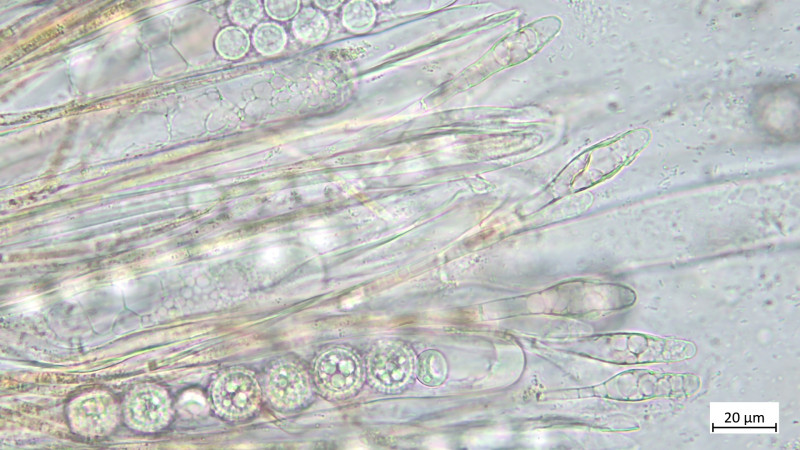
05 Cudoniella clavus - der Wasserkreisling


06 Bolbitius pluteoides - der dachpilzartige Mistpilz



HDS
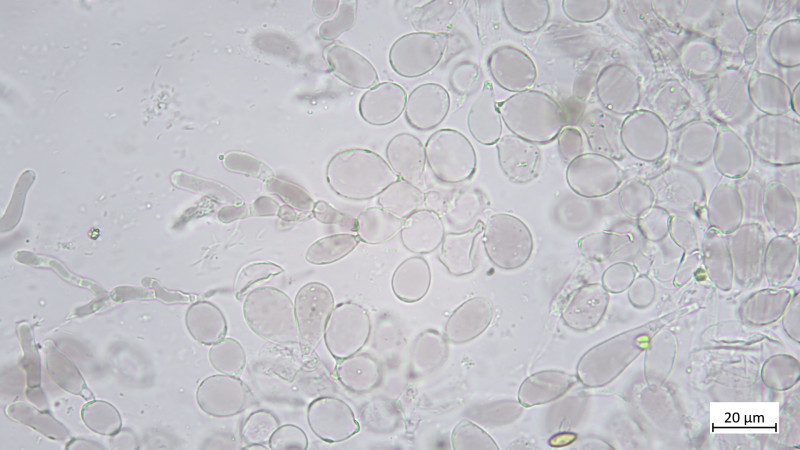
Cheilos
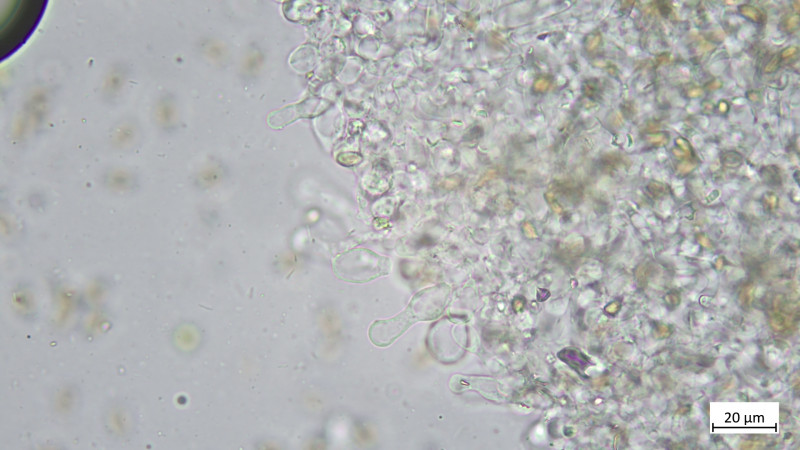
Sporen
diesen hatte ich bereits angefragt und mir konnte geholfen werden - danke an Harald  , die komplette Mikrodoku daher unter der Anfrage: Gelöst: Bolbitius pluteoides (Pholiotina oder doch was anderes ... bräuchte mal Hilfe)
, die komplette Mikrodoku daher unter der Anfrage: Gelöst: Bolbitius pluteoides (Pholiotina oder doch was anderes ... bräuchte mal Hilfe)
Dann noch vermutlich 07 Panaeolus Papilionaceus - der behangene Düngerling (nicht weiter untersucht):


Ansonsten gab es im Wald bei der Trockenheit nicht viel. Dann machte ich noch einen Abstecher zu einer bekannten "Eichhasenstelle".
Der kommt immer zuverlässig Ende Juni an verschiedensten Stellen bei uns. Wegen der Trockenheit erwartete ich nicht viel und wurde überrascht - er nimmts halt von Baum vermute ich mal:
08 Polyporus umbellatus - der Eichhase



und etwas entfernt in ganz anderer Färbung:


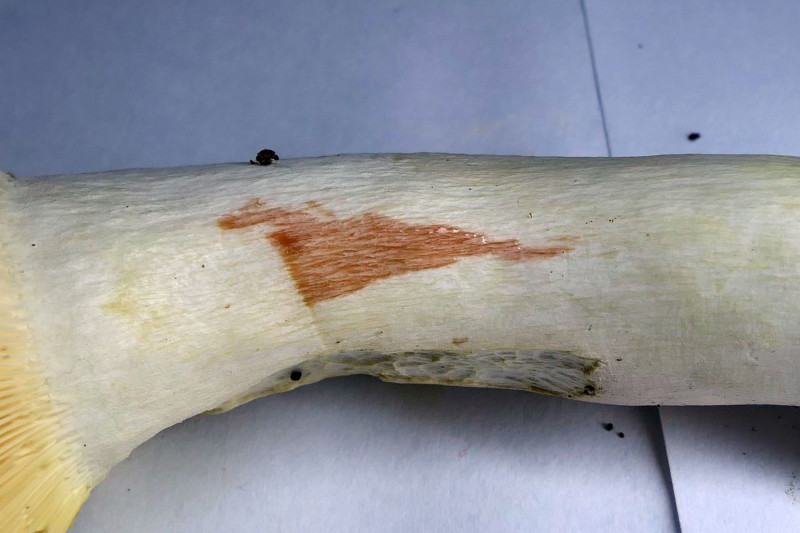
Dann fand ich noch etwas aus dem Grisea-Aggregat. Nicht so einfach mit der Bestimmung. Unter Buchen (Eichen deutlich entfernt) und mit Sporenpulver IIa-b lege ich das jetzt mal unter
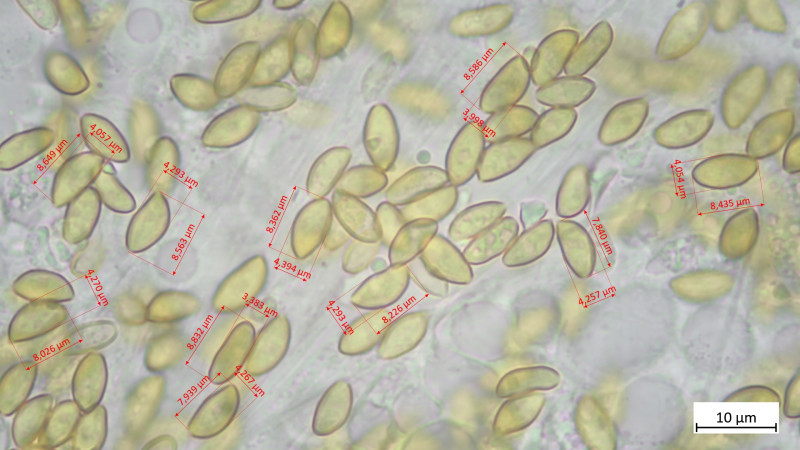
09 Russula ionochlora - der Papageientäubling ab, wobei mir die Sporen dazu nicht so richtig gefallen wollen. Geschmack mild, maximal in Lamellen kurz ganz leichte Schärfe. Was meint ihr dazu.
09 Russula grisea (danke Oehrling)


FeSO4 nach 3 Minuten:
Sporen:
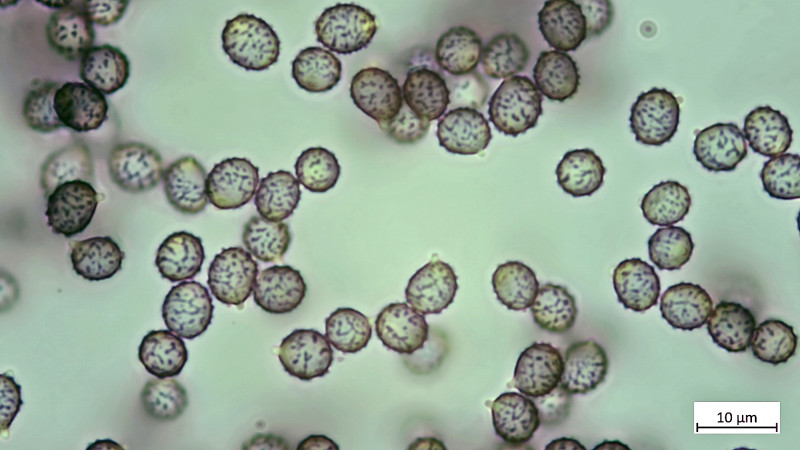
HDS in Kongorot / NH3
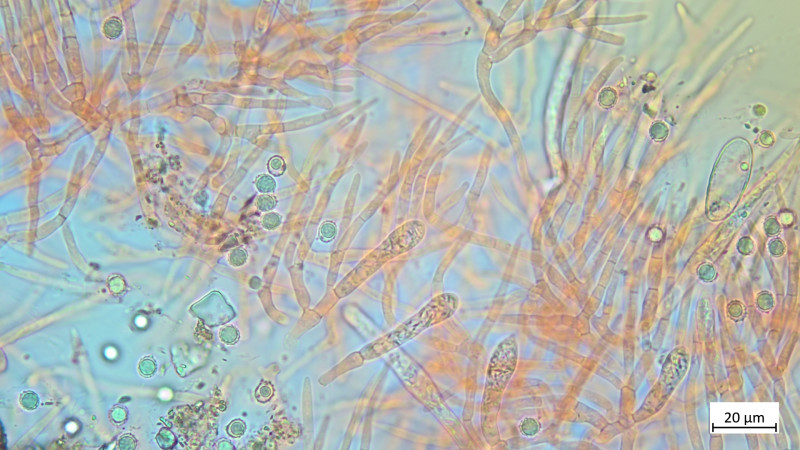
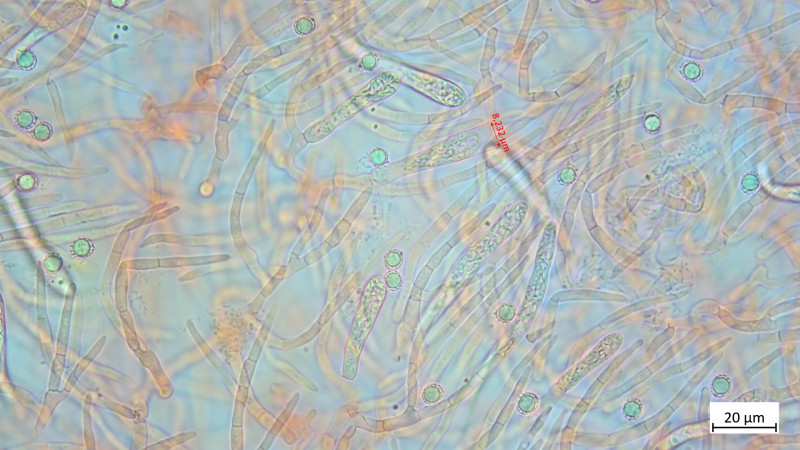

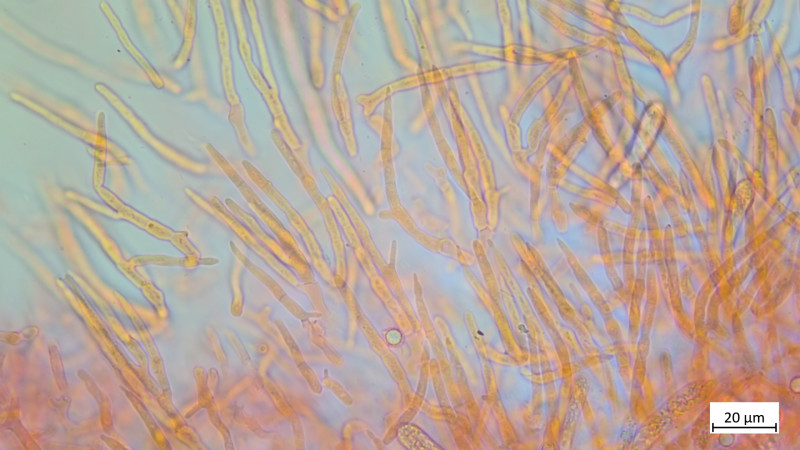


Außerdem gab es noch ein Blausieb, dem ist die Wärme wohl nicht bekommen:

Also,ich denke in den Bachläufen gibts noch einiges zu entdecken. Natürlich würde ich mich auch freuen, wenn es bald mal wieder größeres zu finden gäbe ...
LG Sebastian


