Hallo zusammen,
am Samstag ging es beim APR-Wochenende in Hilchenbach mal zu einem uns noch unbekannten Gebiet: Das NSG Heiden und Magerrasen bei Trupbach. Ein ehemaliger Truppenübungsplatz der Belgier auf saurem Boden. Da dieser Tage ja die Wiesenpilze eher wachsen als ihre Kollegen aus dem Wald, machten wir uns einige Hoffnung auf interessante Funde..... und wurden dann auch nicht enttäuscht.
1. Panaeolus papilionaceus



2. Lepista panaeolus

3. Hygrocybe miniata

4. Mycena olivaceomarginata

5. Clavulina laeticolor

6. Eine blaustielige Entoloma. Die Hüte erscheinen auch bei den ganze jungen Fruchtkörpern ohne Blauton zu sein. Der Hut ist faserig bis feinschuppig und nicht durchscheinend gerieft. Die Huthaut hat intrazelluläres Pigment, die Basidien sind 4-sporig ohne Basalschnalle. Zystiden sind keine vorhanden. Wenn ich dann mit FE5a oder Funga nordica schlüssel, laufe ich mit dem polierten Stiel leider immer ins Leere.


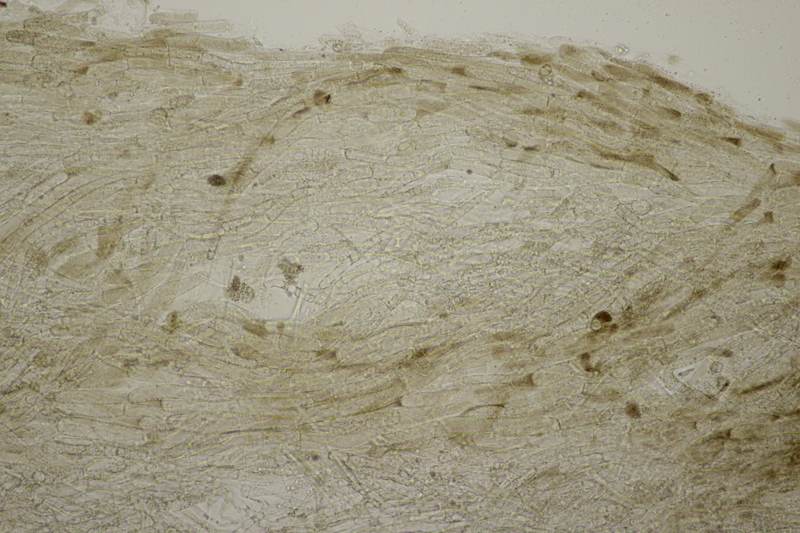




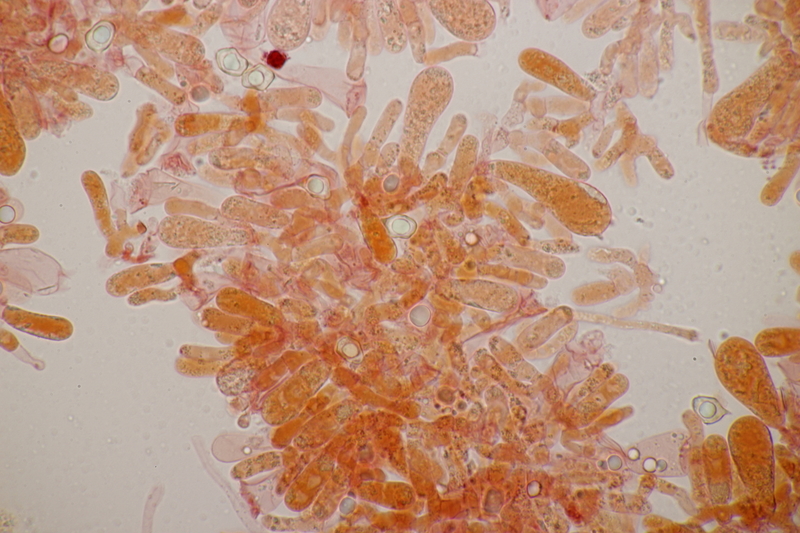

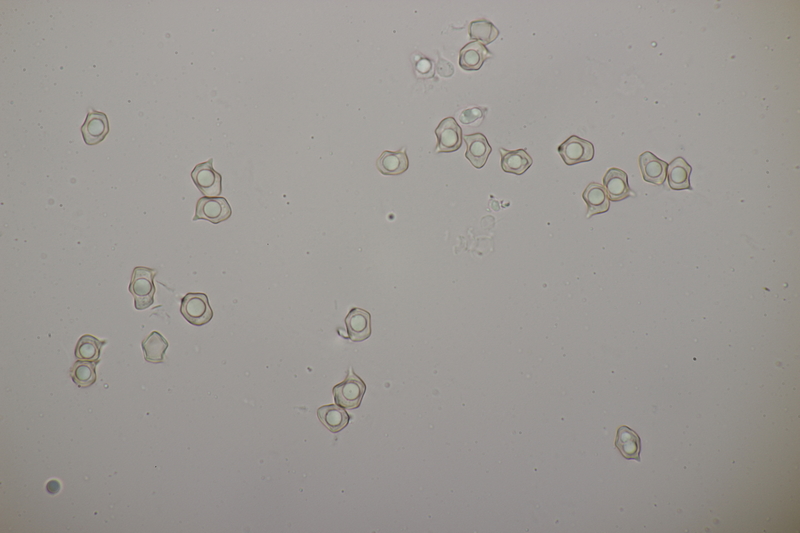
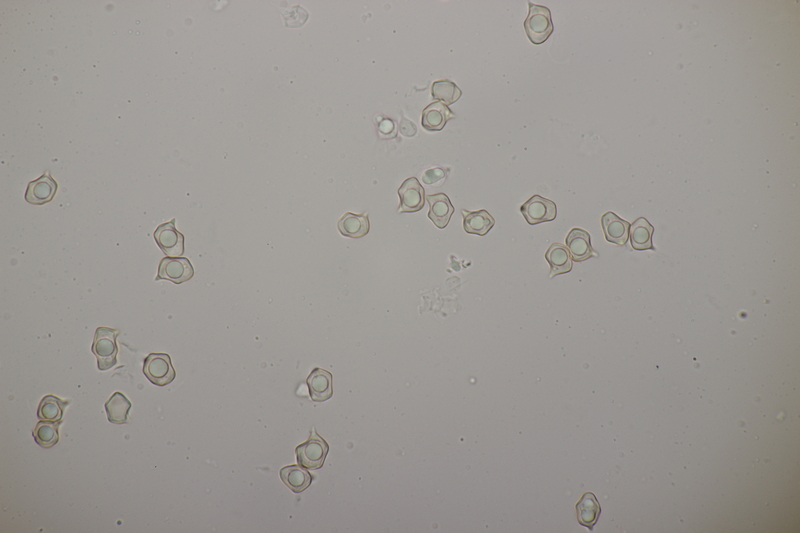
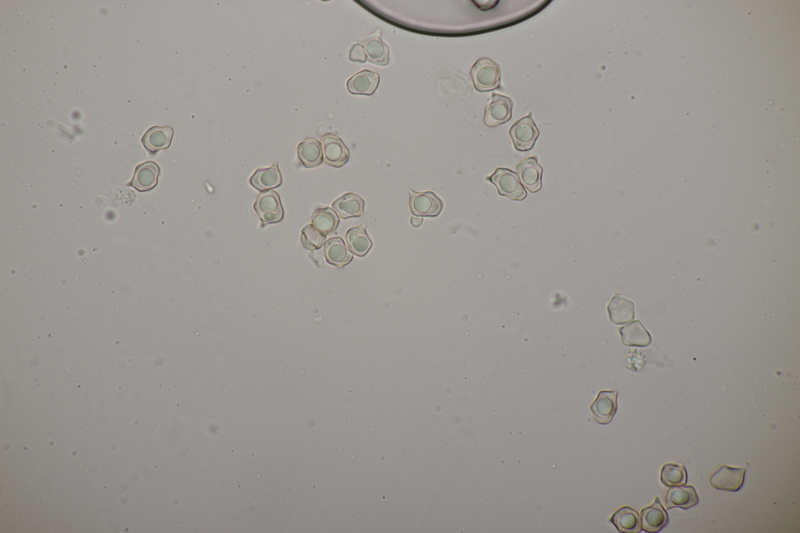

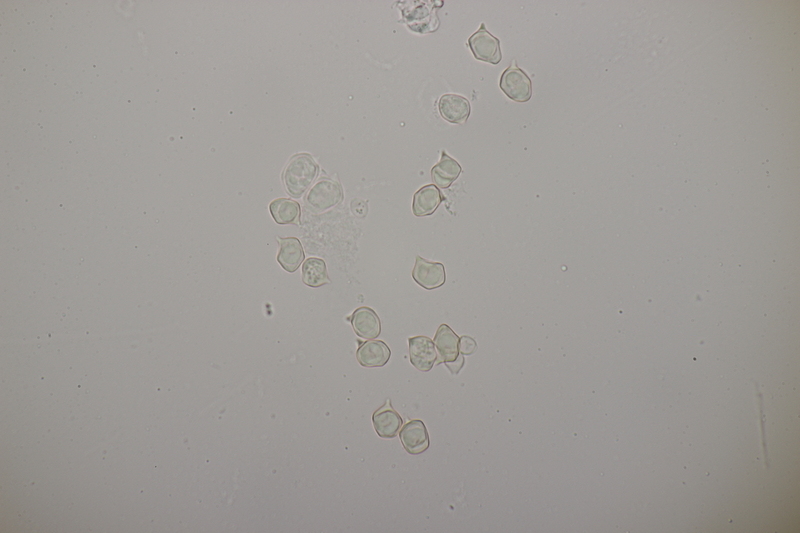
7. Cuphophyllus virgineus

8. Weitere gelbe Keulchen, die allerdings sporenlos waren und deshalb unbestimmt bleiben müssen.

9. Clavaria fragilis


10. Wenn man im Gras kniet und nach kleinen Keulchen sucht, findet man manchmal auch rosa Zuckerwatte: Laetisaria fuciformis

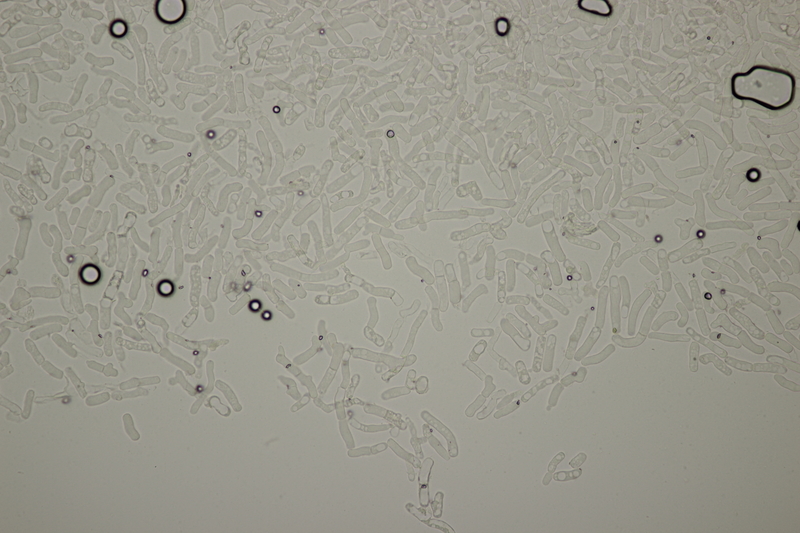
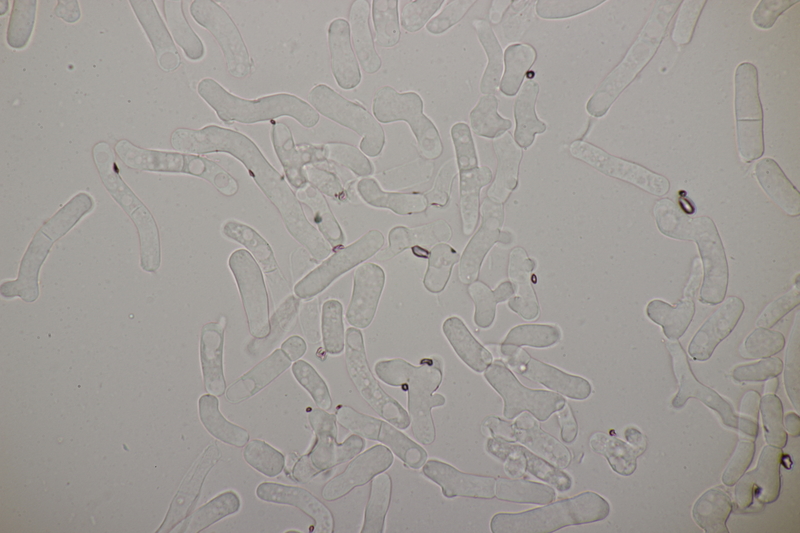


11. Eine Hygrocybe, die es leider nicht unters Mikro geschafft hat.

12. Entoloma conferendum

13. Dibaeis baeomyces





14. Entoloma jubatum oder: Ceci n'est pas une Conocybe








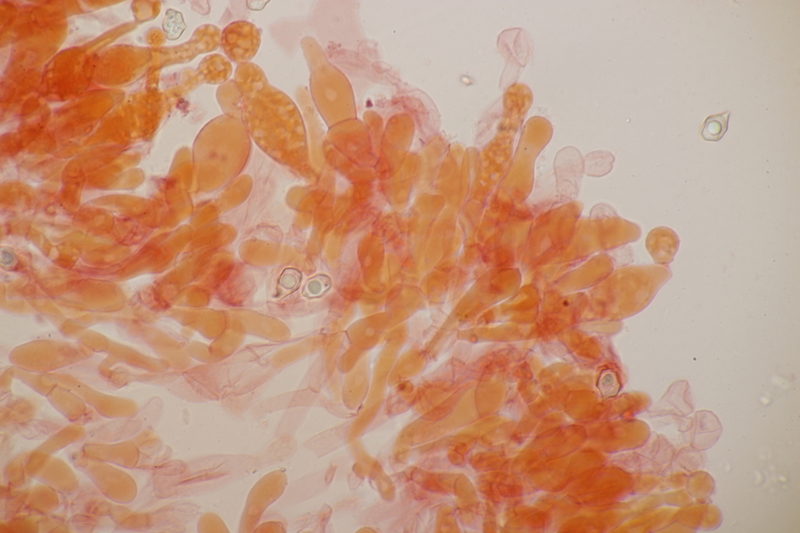


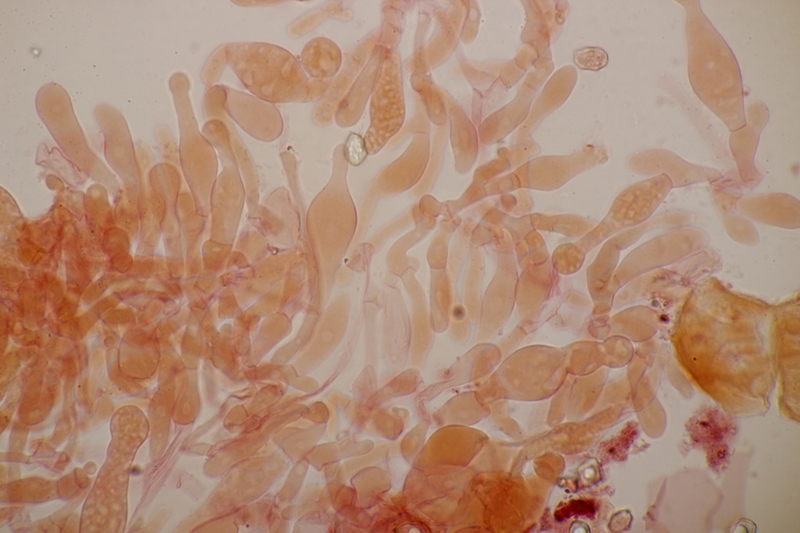
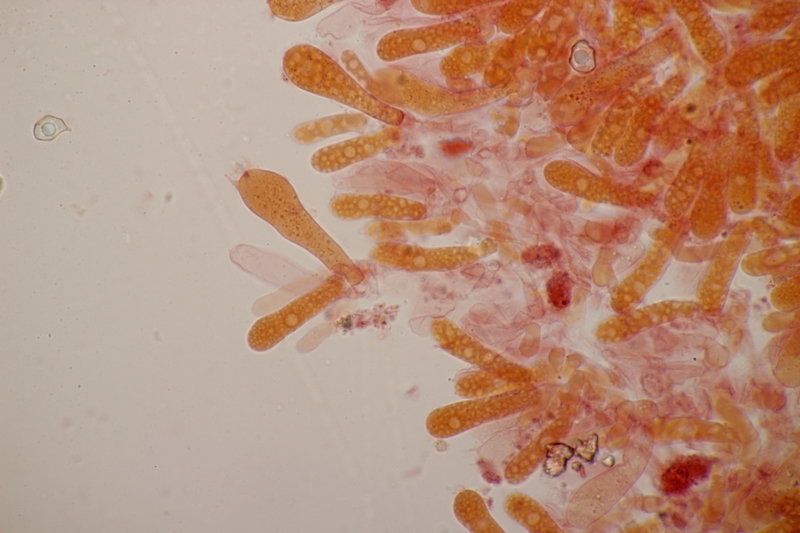

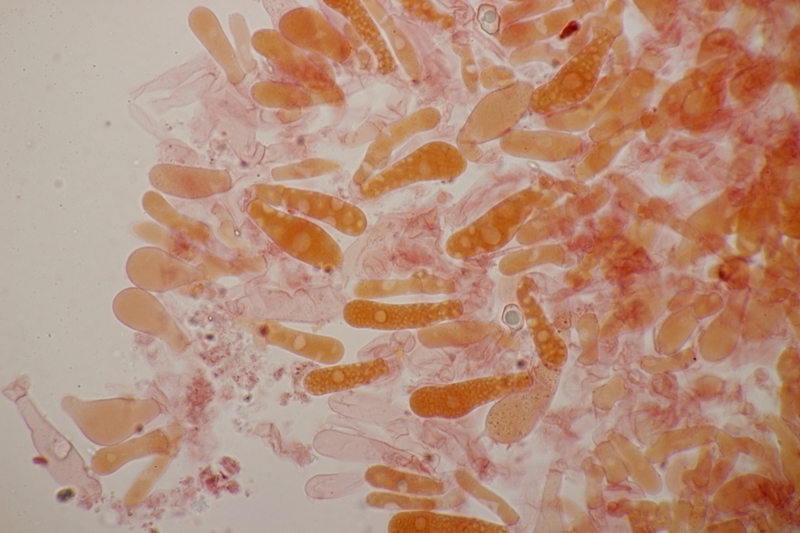

15. Dermoloma cuneifolium

16. Clathrus archieri war in allen Alterstadien reichlich vorhanden. Sehr schön auch das Hexenei mit dem typischen violetten Basalmycel.







17. Hier hatten wir im Feld auf besseres gehofft, da die Fruchtkörper recht klein waren. Aber am Ende "nur" Aleuria aurantia






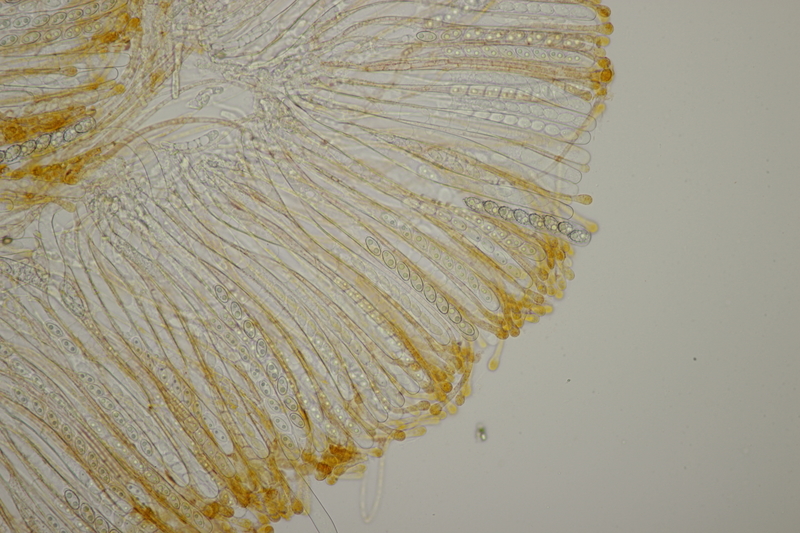

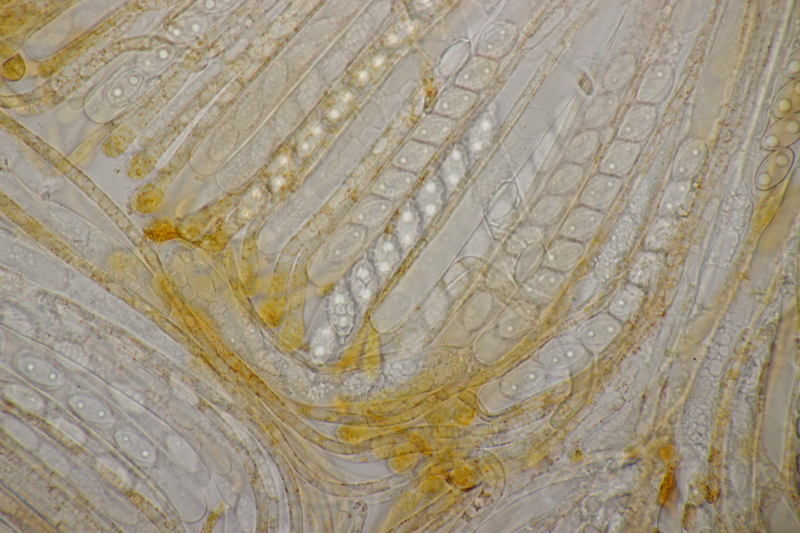


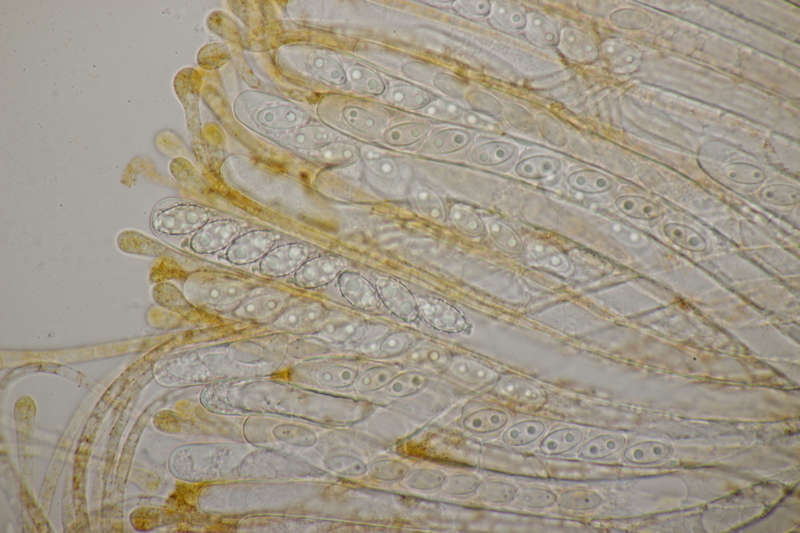

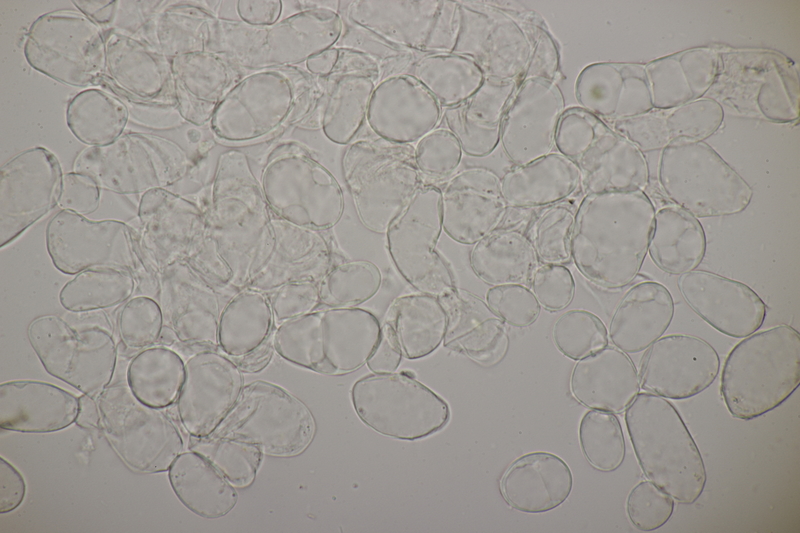

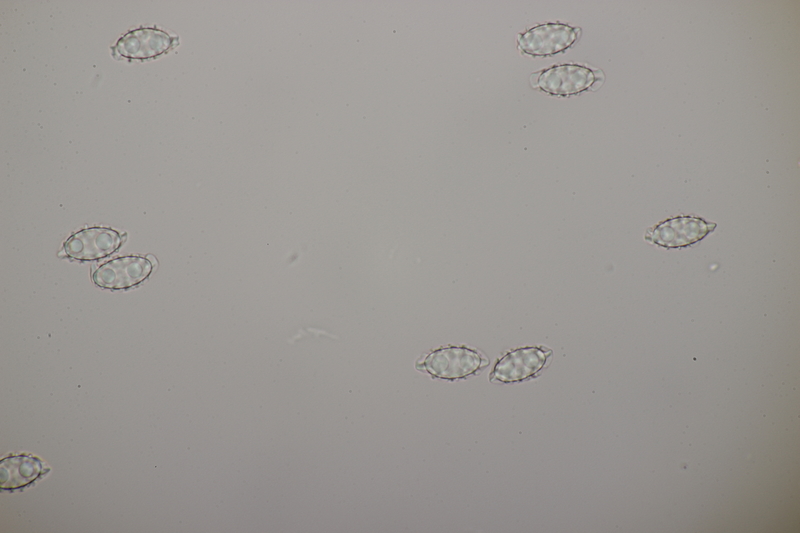
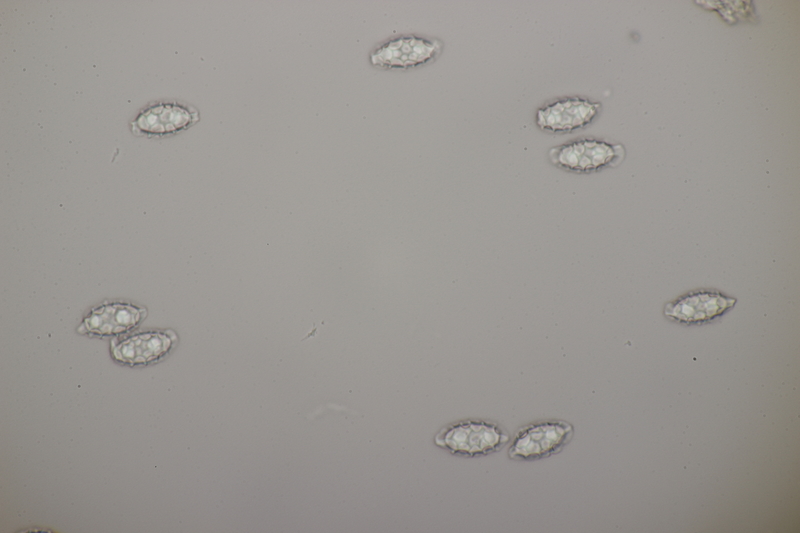

18. Dann gab es da noch kleine Bovisten mit einem Durchmesser von <1 cm. Im Feld hatte ich gehofft, daß das Bovista pusilla würde. Aber da paßt das Capillitium nicht, das vom Lycoperdon-Typ ist, keine Septen hat und viele Poren aufweist. Die Sporen messen 4.0-5.2 µm, im Mittel 4.4 µm, sind schwach warzig und haben kein Pedicel. Da bleiben dann nicht mehr viele Bovista-Arten im Rennen: B. paludosa und Bryoperdon acuminatum sind habitatsmäßig raus. B. aestivalis s.l. sollte kleinere Sporen und eine Subgleba haben und B. furfuracea sollte vereinzelt Septen im Capillitium haben. Hat da jemand eine Idee zu?


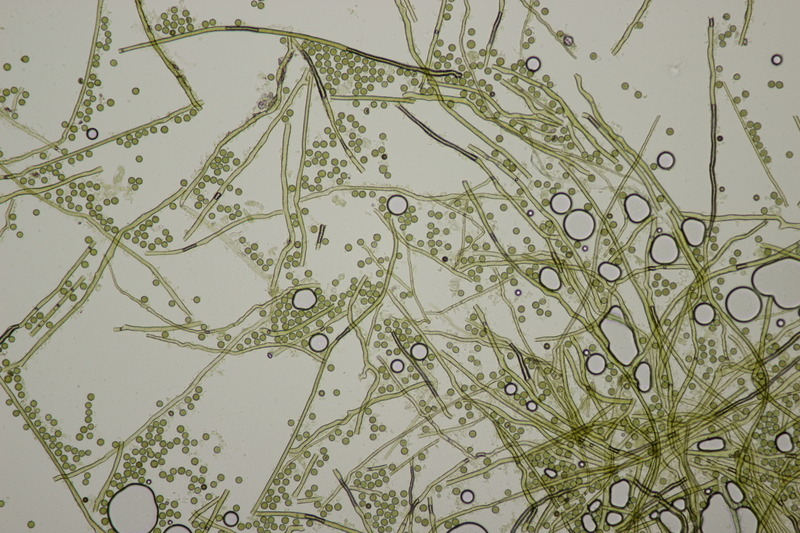

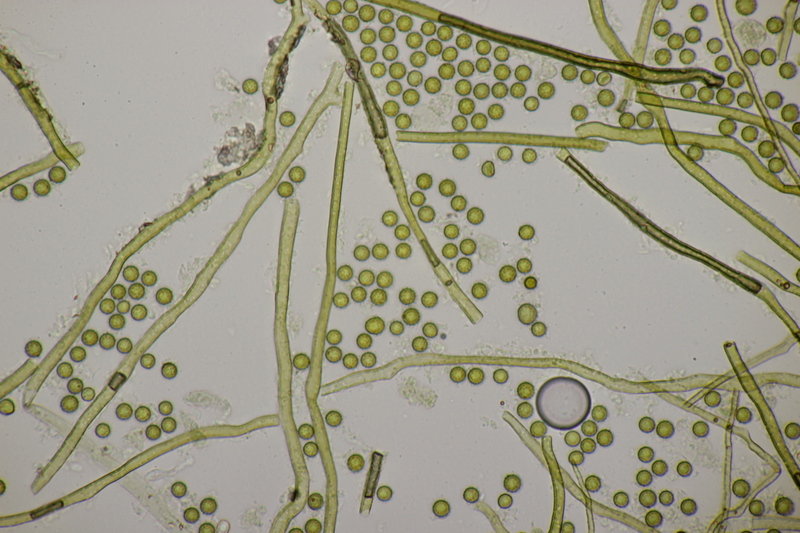

Björn


