Moin Drosophila,
ich werde deinen text mal etwas zerpflücken um besser drauf einzugehen.
Außerdem eine anwendungsbezogene Beschreibung: wozu einen Dünnschnitt und weshalb am Kryostaten.
anwendungsbezogen in der Mykologie? Nun warum nicht... so kann man großflächig material untersuchen oder auch bestimmte Strukturen und Aufbau zu erkennen, was händisch teilweise sehr schwierig zu erreichen ist.
In der Medizin:
Wie du schon schriebst für Forschung zum Nachweis labiler Antigene oder Stoffe die nach der allgemeinen Entwässerung durch Alkohol und xylol nicht mehr vorhanden sind (Fettnachweis)
In der Routine wird diese Technik zur Schnellschnitt Herstellung benutzt. Wenn der Patient noch offen auf dem OP Tisch liegt, können Absetzungsränder untersucht werden, um zu entscheiden ob der Tumor vollständig entfernt wurde oder ob nachgeschnitten werden muss.
Ich kann mir ehrlich gesagt nicht vorstellen, dass das Ergebnis hübsch wird.
Bilder füge ich ganz am ende ein! Und ehrlich gesagt... ich bin davon mehr als begeistert....
Die Probe einfach so wie du zeigst in DMSO einfrieren dauert so lange, dass dir unweigerlich riesige Eiskristalle deine Strukturen zerstören. Ich betreibe einigen Aufwand, um das zu vermeiden. Selbst die Probe in flüssigen Stickstoff werfen (-200 °C) reicht nicht. Wird zwar augenscheinlich sofort hart, es hatte sich aber kurz eine isoliernde Gasphase um die (warme) Probe gebildet. Dehalb muss man vorher noch durch ein anderes Medium wie z.B. Isopentan. Die lästige Hampelei besteht darin, dass man das auch in einem Gefäß mit Stickstoff kühlt, es aber schnell zu kalt oder zu warm wird. Wenn festgefroren, dann Mist.
also... ich kenne DMSO nur für die Haltbarmachung von DNA/RNA Proben zum lagern bei -80Grad. Wir verzichten auf diese schritte.
Das Gewebe wird einfach nativ ohne Vorbehandlung ins kryogel gelegt und dann gefroren.
Das Kryogel besteht aus Wasser, Polyvinyl alcohol,Polyethylene glycol,Kaliumformiat.
Wird die Probe zu stark runtergekühlt, ist sie meistens auch kaum schmiedbar, da sie sehr spröde wird. (so unsere Erfahrung)
Warum also nicht gleich fixieren und in Paraffin einbetten?
Habe ich natürlich auch schon ausprobiert, aber die Strukturen verändern sich durch die Entwässerung sehr stark! Teilweise verschwimmen die Kontraste. Egal wie wir es gemacht haben.
Momentan arbeite ich an einer PEG Methode ... angeschoben von Peter Reil.
Außderm wird das material zwar schmiedbar... bei 1-5µm, je dicker umso weniger schneidbar, da das Material sehr spröde wird.. ab 10µm hast du nur noch Brösel auf dem OT.
Wie dem auch sei, keine Anwendung für den Hobbymykologen.
Da stimme ich dir absolut zu... jedoch steht die Technik zur Verfügung...
Die REM wird auch gemacht, jedoch auch nichts für den Hobbymykologen 
Du kannst deine Kryoschnitte übrigens halbwegs fixieren, wenn du sie nach dem Trocknen 10 min in Isopropanol inkubierst. Dann verlierst du die Schnitte nicht so leicht beim anschließenden Färben 
Ja das habe ich probiert, aber auch hier gehen die Strukturen sofort kaputt. Paraphysen sind nur noch als kleiner strich zu erahnen, auch sind die Maße nicht mehr original, da hier häufig eine schrumpfung stattfindet.
-> Wir verwenden für die Immunhisto spezial Objektträger, seit dem wir diese Benutzen schwimmt nichts ab, oder verkocht und wir machen täglich ne ganze menge davon. Diese Objektträger nutzen wir teilweise auch für Knochengewebe und Methylmethacrylat (Technovit9100)Schnitte. Diese Objektrräger sind speziell beschichtet und haben eine sehr hohe Adhäsionskraft.
Ich kann mir ehrlich gesagt nicht vorstellen, dass das Ergebnis hübsch wird.
und los gehts  alle Bilder sind mit dieser Methode entstanden.
alle Bilder sind mit dieser Methode entstanden.
hier sieht man etwas gebrösel, das liegt an der Schnittdicke und auffällig auch am alter des Fruchtkörpers, je jünger desto besser schneidbar.
Das sind die Scans aus der Oben gemachten Methodenbilder
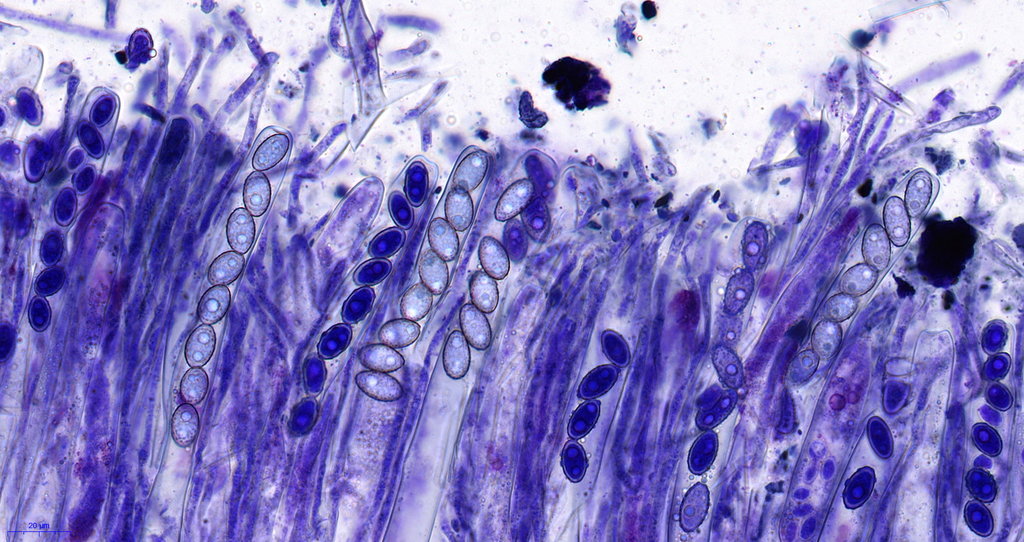
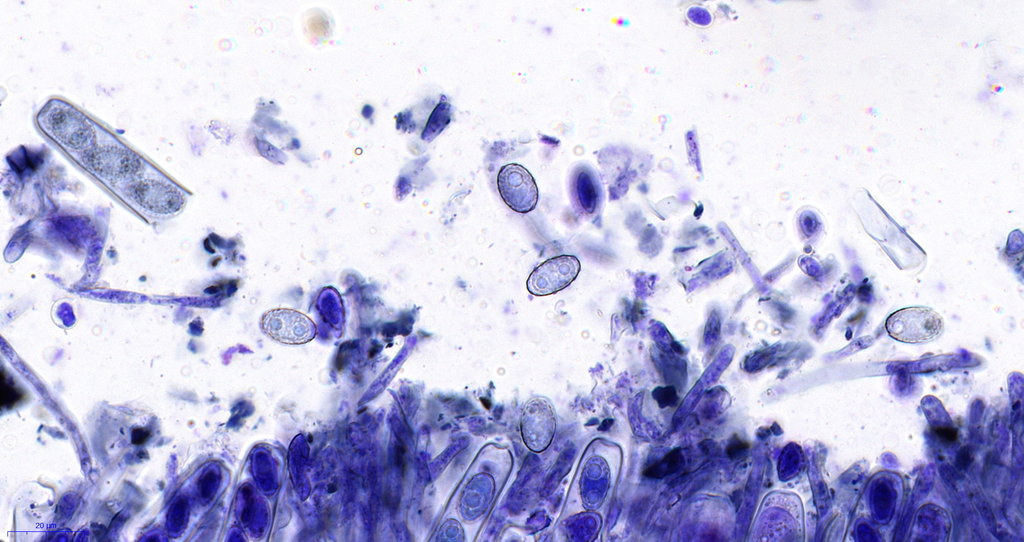
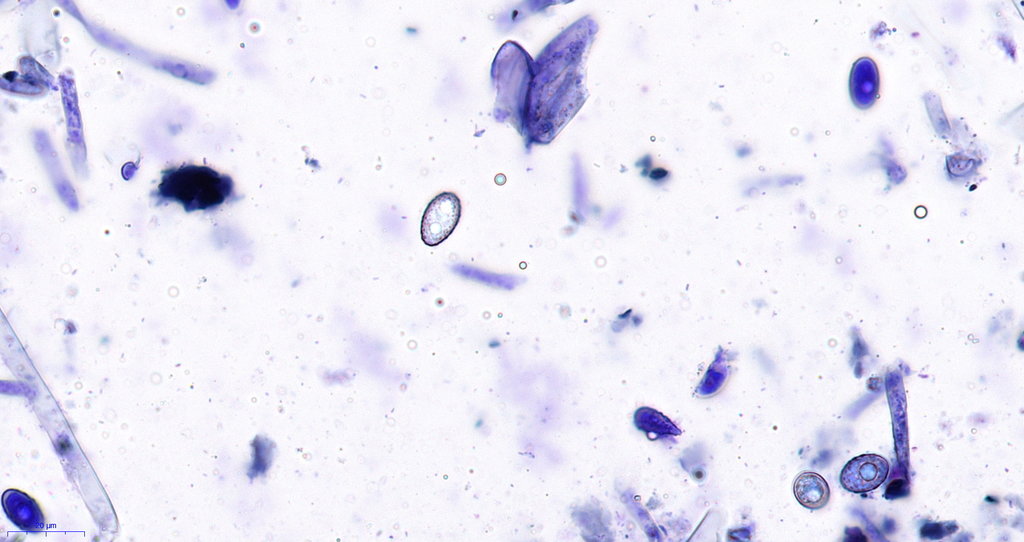
Hier die Jod Testung, hier ist das Kryogel nicht vollständig ausgewachsen worden und färbte sich bräunlich an

Und genau für solche Übersichtsbilder denke ich ist diese Methode interessant, sicherlich nicht für jeden... aber auch ausgetretene Pfade sollten mal verlassen werden
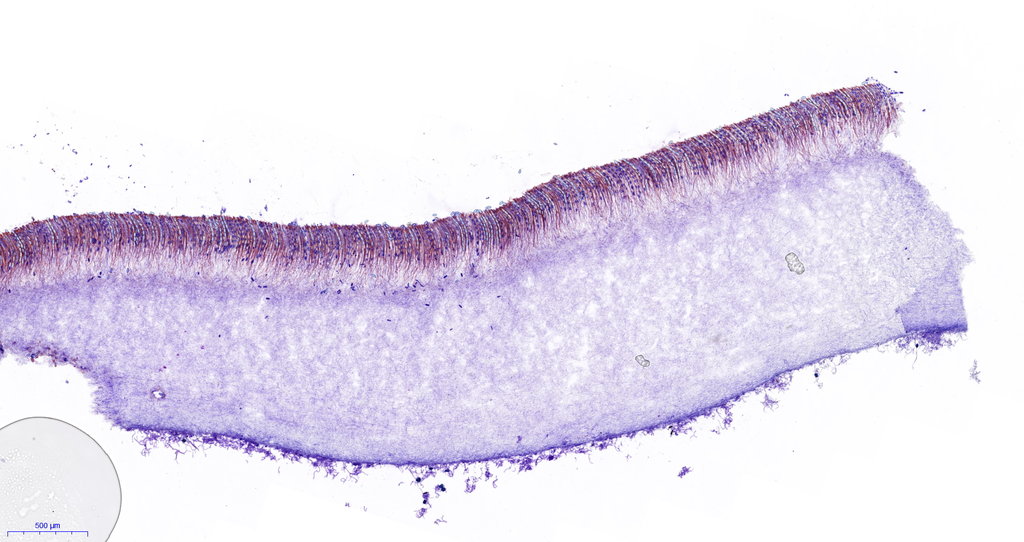


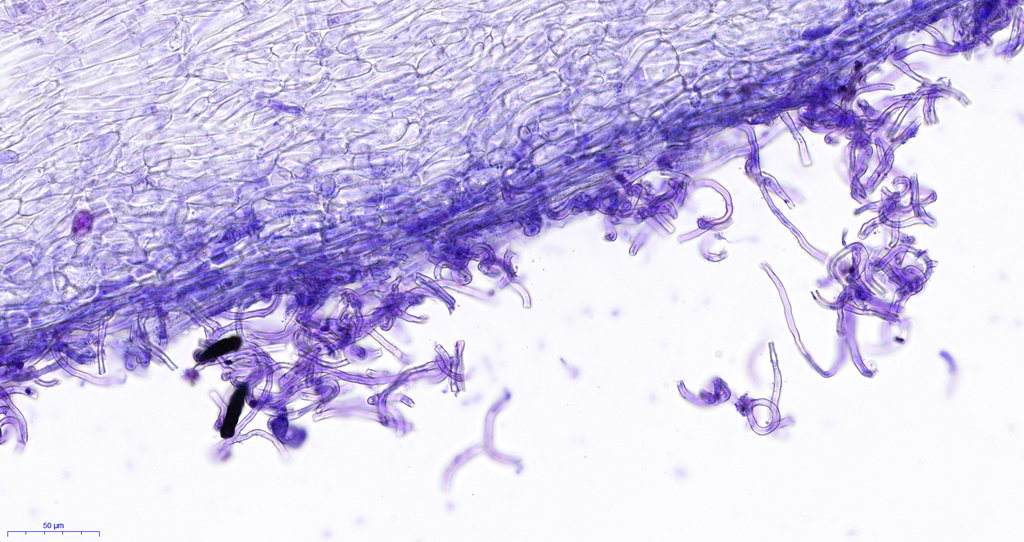

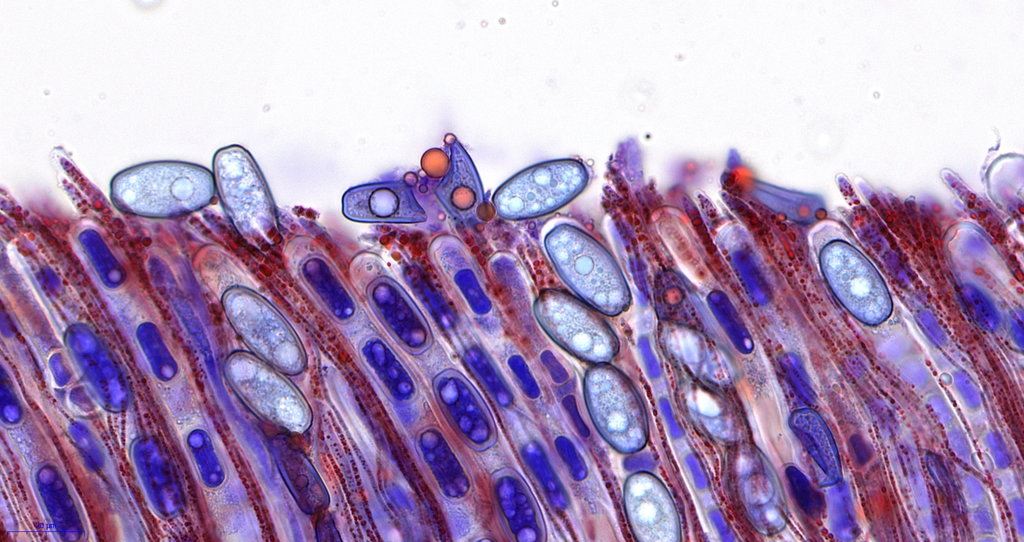
Es gibt noch viel zu verbessern 
Alex


