Hallo Wolfgang,
ich denke, es lässt sich durchaus einrichten, da nächstes WE nochmals hinzugehen.
Das war schon eine interessante Ecke.
Ich war noch nie dort und konnte einige Erstsichtungen machen - und es ist noch nicht mal weit weg.
Da lohnt sich ein weiterer Besuch allemal! 
À propos:
Es ist nicht so, dass ich nicht nach 4-sporigen Basidien gesucht hätte.
Nach dem ersten Überblick suche ich nach Basidien und Sporen.
Möglichst nach Sporen an Basidien, dann kann ich am ehesten davon ausgehen, dass sie zur Probe gehören; und habe zugleich eine Information über die Parallaxe der Sporen an der Basidie und damit über die Zuverlässigkeit der Messung dieser Sporen.
Wenn Basidien gefunden werden, fahre ich vorsichtig den Schärfebereich durch, um möglichst alle Sterigmen zu erkennen.
Die Sterigmen sind in unserem Fall ja recht prominent und kaum zu übersehen, da gibt's ja ganz andere Fälle...
Nun, die vermeintliche Spore in Bild 11 setzt sich weit in der Tiefe fort und gehört wohl zu einer Paraphyse oder Basidiole oder was auch immer, das kann man noch jetzt an der Bildunschärfe erahnen.
Ich habe, bevor ich ein Bild speichere, immer den Tiefenbereich durchgefahren und den Bildbereich nach Sporen abgesucht.
Wäre da nur eine Spore gewesen, hätte ich in diesem Fall auch ein Bild gemacht, um Daten zu sammeln.
Eine (!) frei schimmende Spore (rundum scharf umgrenzt), oder das, was ich dafür halten würde, habe ich tatsächlich gefunden.
Den Fund habe ich oben nicht weiter erwähnt, da unklar ist
- ob sie überhaupt zur Probe gehört (freischwimmend),
- dass in Wasser wahrscheinlich durch eine Parallaxe die Messung verfälscht ist (Länge verkürzt, da im Wasser gedreht),
- ob sie überhaupt reif und ausgewachsen ist,
- man bei einer Spore keine statistische Verteilung erhält,
Es gibt sicher noch mehr Punkte, mir fällt im Moment nichts weiter ein. 
Gemessen habe ich 3,5 x 5 µm², Messfehler bei < 0,5 µm, liegt also durchaus im Bereich der im Schlüssel erwähnten Sporenmaße.
Aber wie gesagt, der Dickenmessung glaube ich erheblich mehr als der Längenmessung, das Maß ist ziemlich sicher größer.
LG, Martin
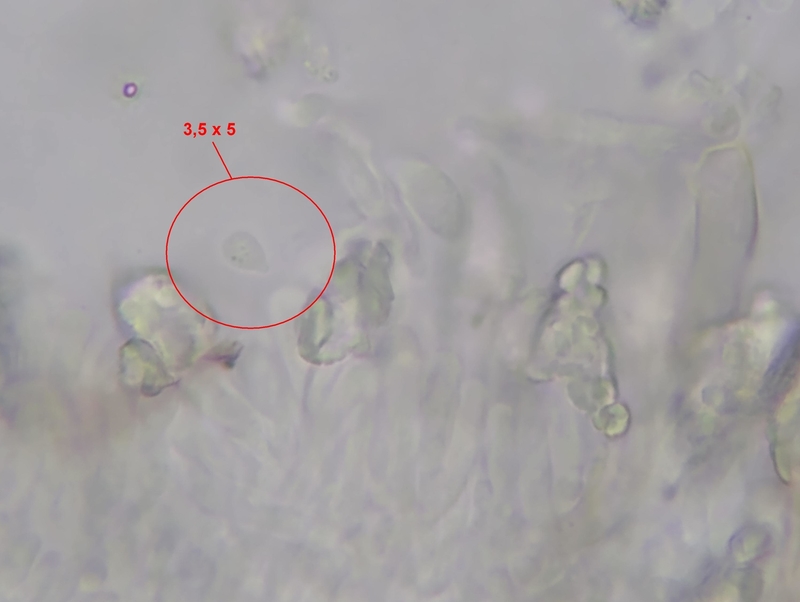
Sporenbild


