Hallo zusammen,
ich ärgere mich gerade mit einem Porling herum, den ich leider nicht richtig einkreisen kann.
Erstmals habe ich ihn am 3.1. am Waldrand (Buche, Ahorn, Hasel, ...), neben einen pittoresk verwahrlosten Apfelgärtchen, gesichtet.
Der Porling wächst etwa 1m über dem Boden seitlich auf der Rinde eines (vermutlich) Rotbuchen-Stämmchen (Bild 1).
Heute habe ich einen Fruchtkörper zur Analyse geerntet.
Der weiße Pilz besitzt ein irregulär-labyrinthisches Porenmuster und für mich auffällig orange, gallertig wirkende Hut-Vorderkanten.
Poren und Hutoberseite sind weiß, der Hut mit sehr kurzem Filz bedeckt. (Bild 2)
Der Pilz lässt sich leicht als ganzes vom Substrat abziehen, er wirkt dabei elastisch-gummiartig.
Er riecht würzig-pilzig.
An Poren zähle ich etwa etwa 3-6 / mm (Bild 4).
Im Querschnitt ist der Pilz an der dicksten Stelle etwa 2-3 mm dick, der Hut steht bis zu 6 mm vom Substrat ab..
Substratseitig exisitert eventuell eine dunklere, schwach bräunliche Schicht (Bild 3).
Der Kontext (Hutfleisch) am Querschnitt reagiert auf KOH schwach bräunlich, auf Lugol eher gar nicht.
Mikroskopische Merkmale:
Lange Zystiden (Bild 6)
Hyphen:
dünnwandig +
dickwandig + (Durchmesser um 3µm)
sehr dickwandig + (fast ohne Lumen) (Bilder 6-8)
Inkrustierungen -
Schnallen -
Kristalle -
Basidien 4-sporig (Bild 10/11)
neben Basidien keine Zystiden
Sporen sind allanthoid (wurst- bis bananenförmig), hyalin und inamyloid.
Sporen nach Probenquetschen im Wasser schwimmend gefunden mit etwa 4,0-5,5 x 1,5-2,0 µm² (Min-Max, N = 16) und plötzlich eine Spore 8,0 x 2,0 µm² !
Diese große Spore hat mich stutzig gemacht, weswegen ich einen Sporenabwurf gemacht habe:
Ergebnis des Sporenabwurfes:
6,4 - 7,3 - 8,1 x 1,4 - 1,6 - 1,9 µm² / Q = 4,5 / N = 22 (der Vollständigkeit halber noch Min-Max: 5 - 9 x 1,5 - 2,2)
In Lugol zeigen die Sporen eine fein-warzige Oberfläche (?) in Bild 9
Leider komme ich mit meinem Bestimmungsversuchen nicht weiter.
Ich vermute am ehesten vielleicht eine Antrodia, aber die Sporen sind mit weniger als 2 µm dafür wohl zu dünn.
Hat bitte jemand eventuell einen Tipp für mich?
LG, Martin
Bilder:

Bild 1 Fundort

Bild 2 Das Objekt
Die orangene, gellertig wirkende Stelle ist auch im Querschnitt erkennbar.
Im Querschnitt erkennt man eine bräunliche Schicht auf der Rückseite zum Substrat hin.

Bild 3 Querschnitt (Makro 2x; Weißabgleich passt nicht, Bild ist gelbstichig)

Bild 4b orangene Hutkante oben unscharf im Bild

Bild 4b Poren

Bild 5 (40x) Übersicht, Querschnitt durch Poren

Bild 6 (1000x) Zystiden (nicht in den Poren gefunden)
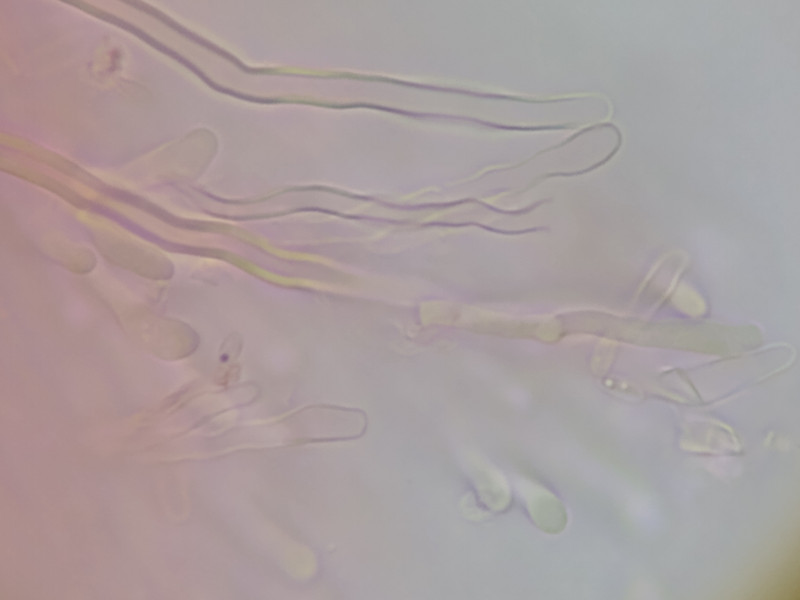
Bild 7 (1000x) dickwandige Hyphen

Bild 8 (1000x) sehr dickwandige Hyphe
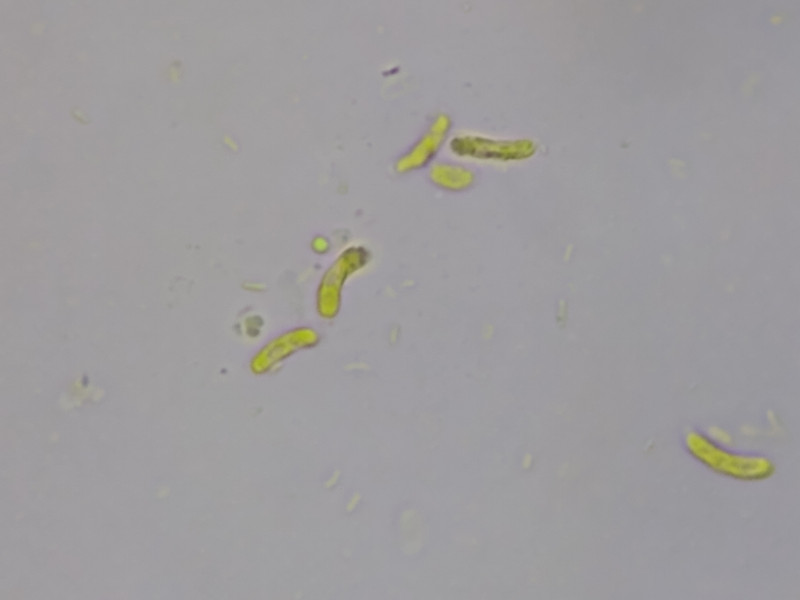
Bild 9 Sporen in verdünntem Lugol 1000x
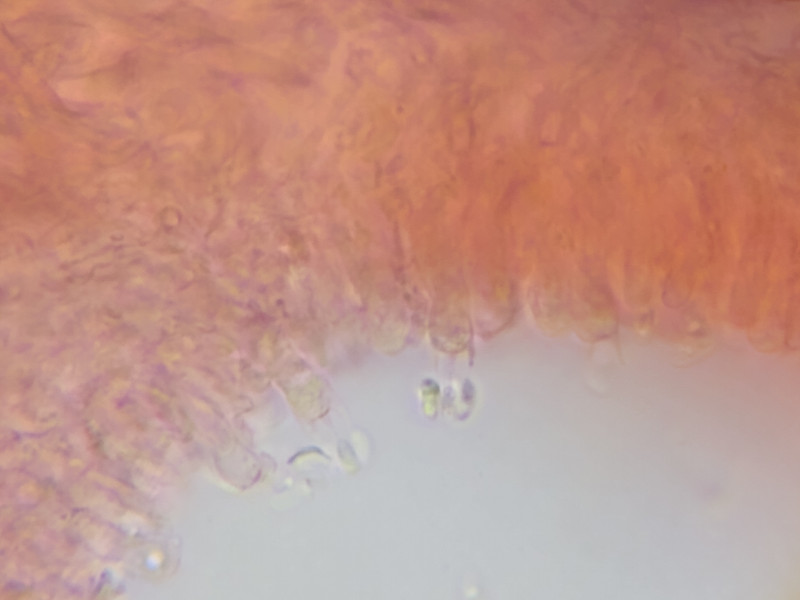
Bild 10 Bilck in Pore: Basidien mit Sporen 1000x in Kongo

Bild 11 Schräger Blick in Pore: viersporige Basidien in Aufsicht


