Hallo zusammen
Heute Mittag habe ich einen kurzen Ausflug in einen Auwald gemacht.
Hier ist es im Moment sehr trocken, entsprechend hatte ich wenig Hoffnung auf prächtige Pilzfunde.
In einem sandig-steinigen Bachbett, das seit einigen Monaten ausgetrocknet ist, fand ich dann aber diese kleinen braunen Pilze.
Frohlockend zog ich mit der Beute nach Hause, aber nach fast drei Stunden bin ich kaum weiter gekommen.


Hut deutlich faserig, etwas hygrophan.

Stielbasis weissfilzig, sonst mehlig oder feinfaserig

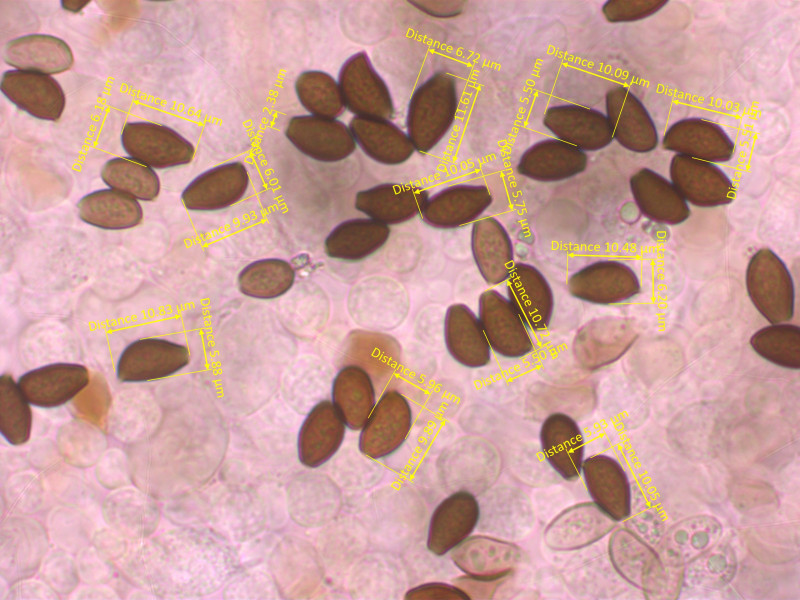
Sporen glatt oder allenfalls etwas rau, 10-11 x 5.5-6.7 µm, Q = 1.65-1.95
Dickwandig, mit deutlichem, meist zentralen Keimporus (KP bis fast 3 µm breit). Sporenform recht variabel.

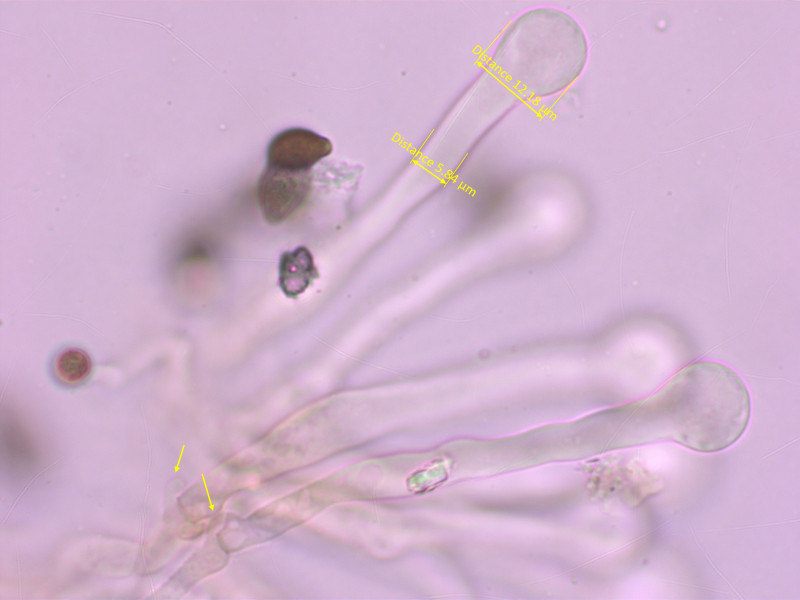
Cheilozystiden: In dichten Büscheln, lang und schlank mit auffallendem Kopf, dünnwandig.
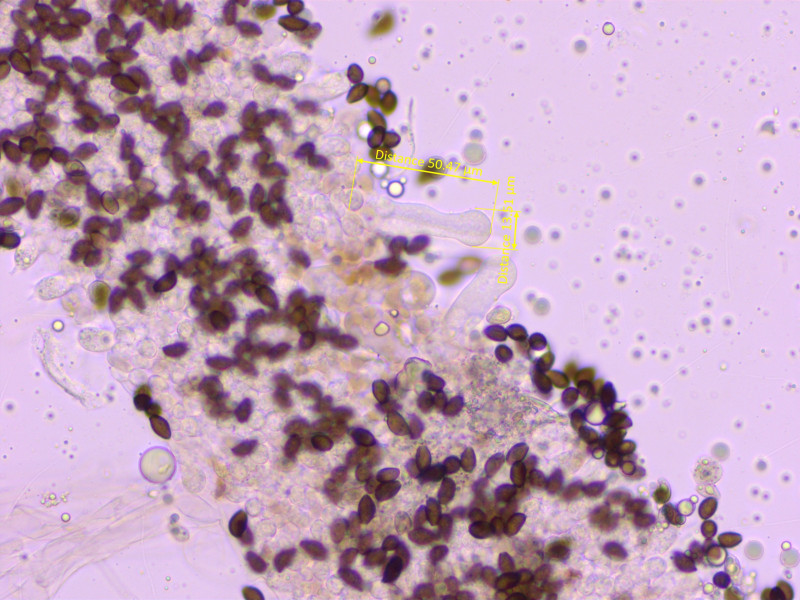
Pleurozystiden: Spärlich, dicker als die Cheilozystiden.
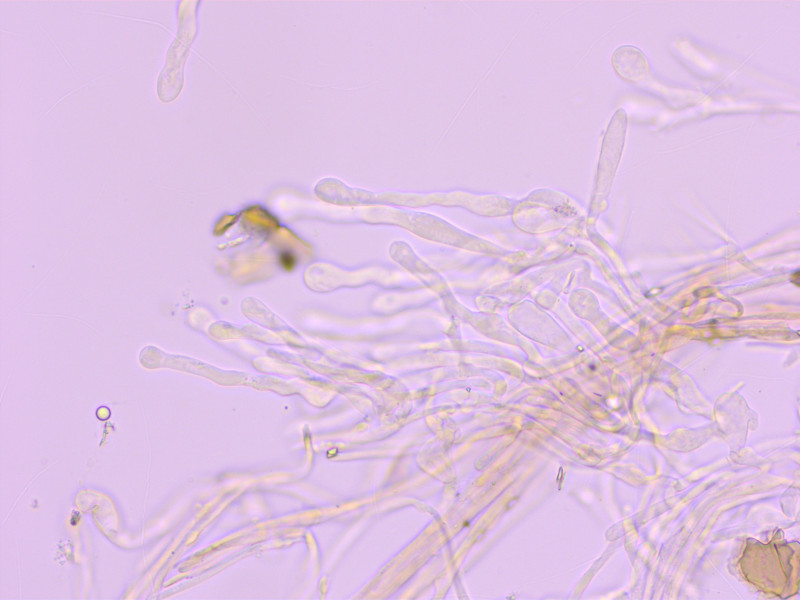
Kaulozystiden: Ähnlich den Cheilos, s
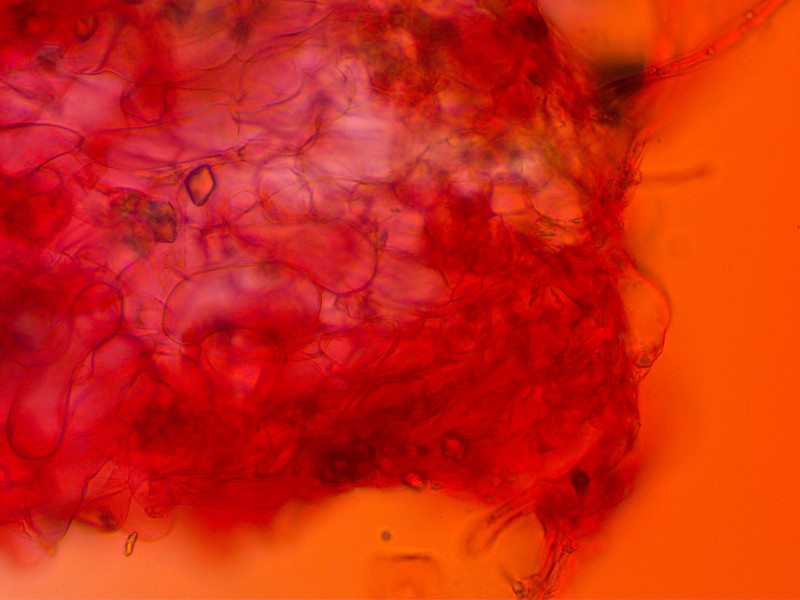
HDS: Da hatte ich Mühe einen anständigen Schnitt hinzukriegen, sie scheint aber zellig zu sein.
Oben aufliegend sind wohl Velumshyphen.

Velumsfasern vom Hutrand, mit Schnallen, schwach inkrustiert

Sporenpulver fast schwarz.
Unsere nette Putzfrau hat leider wenig Verständnis für meine Pilzmanie, deshalb hat sie den wertvollen Sporenabdruck praktisch vernichtet.
Die Hälfte des Abdrucks, die auf einem Objektträger lag, war nicht mehr zu gebrauchen.
Weitere Angaben:
- Geruch mehlig, Geschmack mild
- Keine Chrysozystiden
- Begleitflora: Erlen, Weiden, Kiefern, Fichten in einiger Entfernung
Ich nehme an, dass es eine Psathyrella ist. Aber ich finde keine, die passt. Alle mir zugänglichen Schlüssel (Melzer, Gröger, Moser, FN) laufen ins Leere oder ich biege irgendwo falsch ab.
Das grösste Problem sind die konstant schlank-kopfigen Cheilozystiden. Die passen irgendwie gar nicht in diese Gattung.
Lacrymaria velutina hätte solche Zystiden, aber dann müssten die Sporen grob warzig sein, und am Stiel fehlen jegliche Velumreste.
Hat jemand eine Idee?
Viele Grüsse
Raphael


