Hallo zusammen
Ich habe mich nun den ganzen Abend mit einem Helmling herumgeschlagen und kriege ihn nicht geknackt.
Vermutlich eine triviale Art und ich sehe einfach den Wald vor lauter Bäumen nicht.
Vielleicht kann mich hier jemand retten.
Standort: Auf pflanzlichen Abfällen, kleinen Stengeln ansitzend. Pflanzenart nicht ermittelbar.
Geruch: Deutlich nitrös, wie M. plumipes
Geschmack: Stark rettichartig, aber mild
Keine Schnallen im ganzen Fruchtkörper zu finden! Ich habe fast eine Stunde lang Schnallen gesucht.


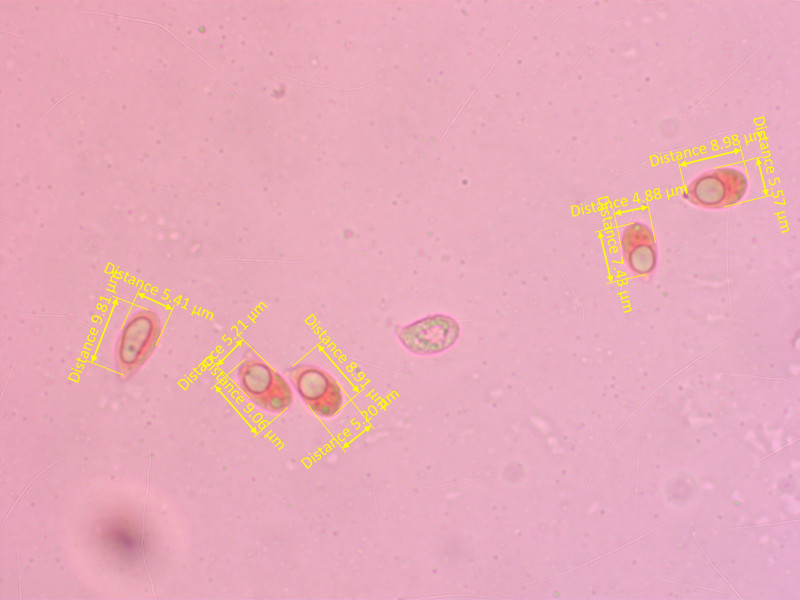
Sporen: Deutlich amyloid, 7.5-11 x 5-6.3 µm, Avg = 9.4 x 5.5 µm, Q = 1.5-1.9
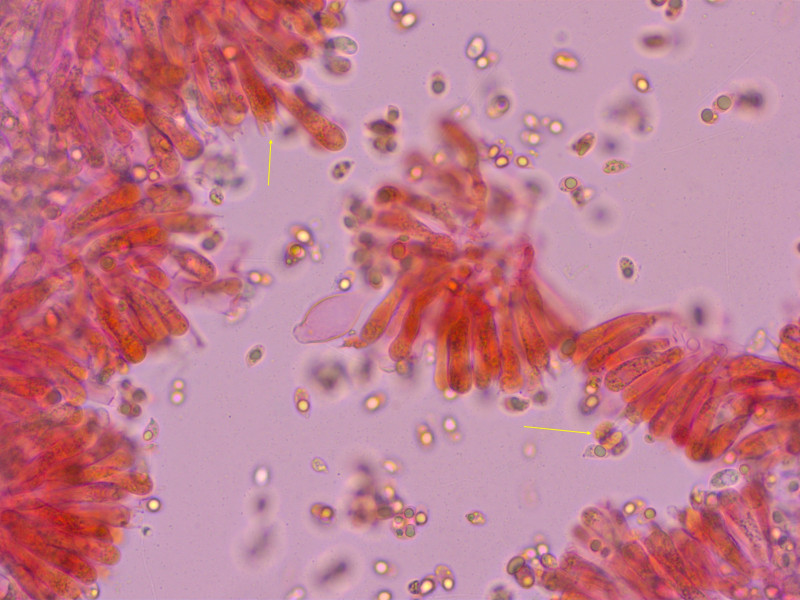
Basidien 4sporig, ich habe gründlich gesucht, konnte aber keine 2sporige entdecken.
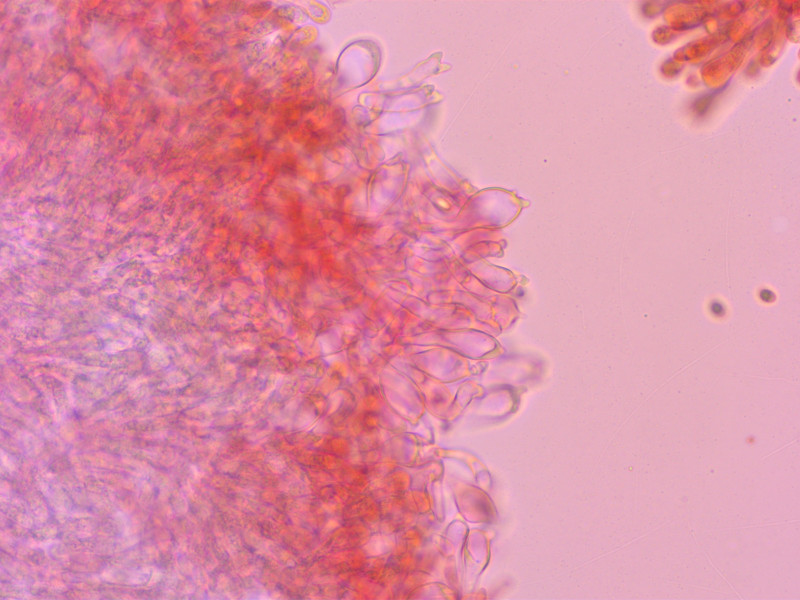
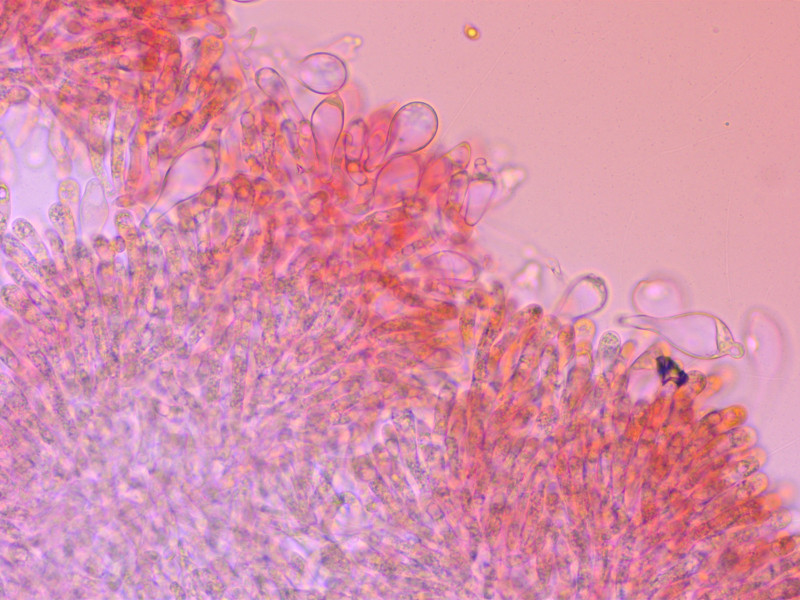
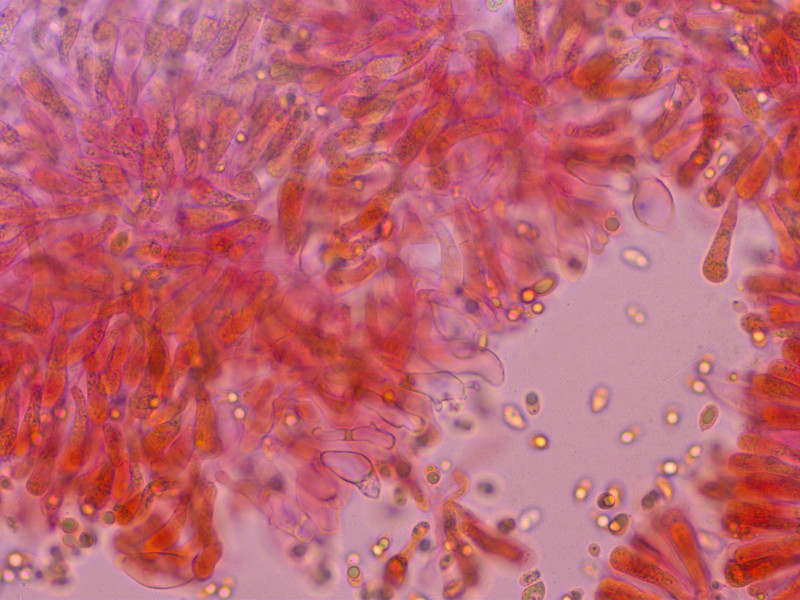
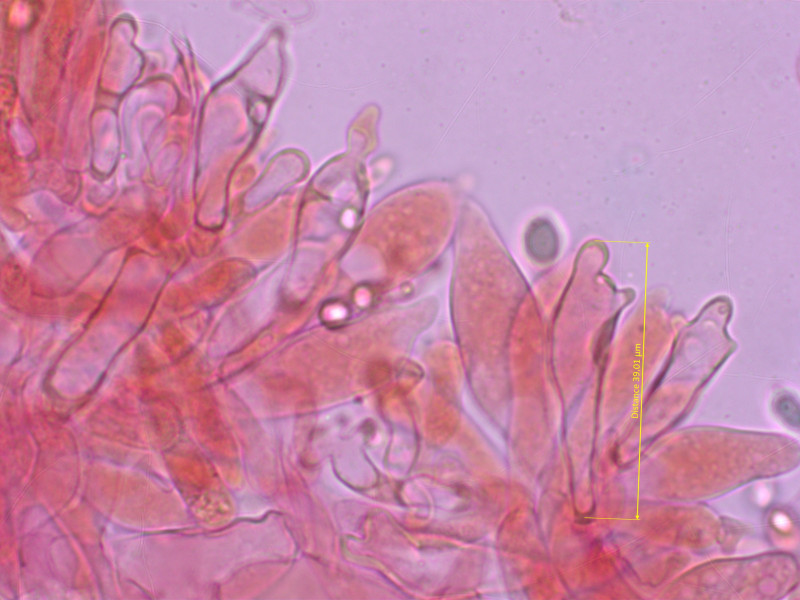
Cheilozystiden entsetzlich variabel, darum so viele Bilder. Bis etwa 40 µm lang.
Es gibt alles von keulig-glatt, oft aber auch mit kurzen fingerförmigen Auswüchsen, manchmal kopfig, oder schlank mit gegabeltem Apex.
Teilweise lichtbrechend.
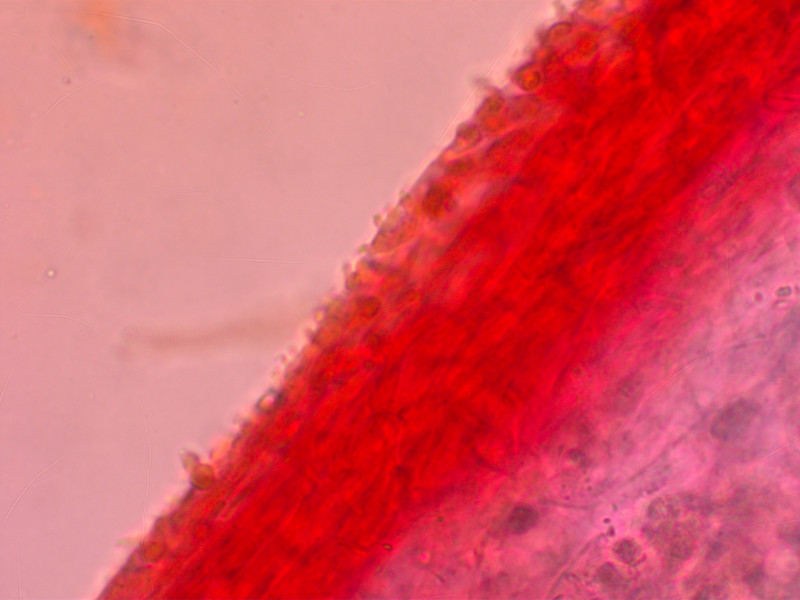
HDS mit sehr kleinen Auswüchsen

Stielhyphen ebenfalls mit Auswüchsen
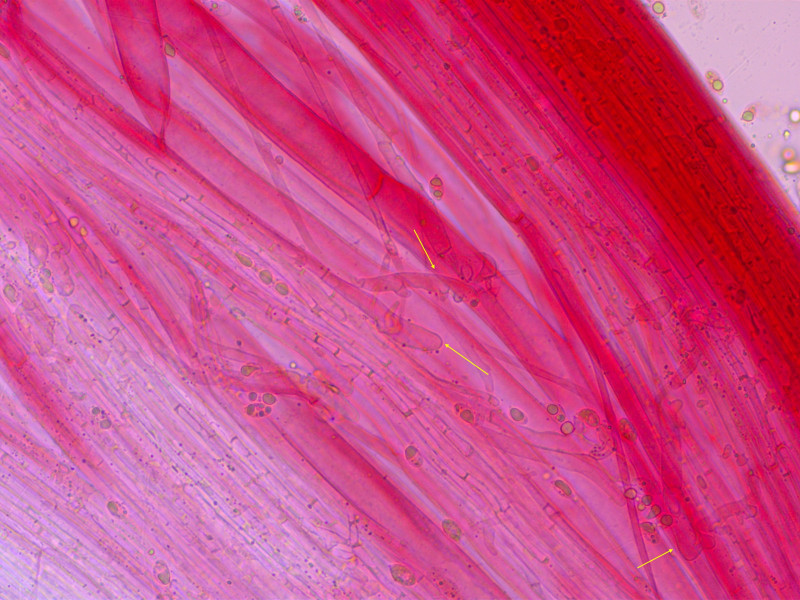
Kaulozystiden
Ich habe primär nach Aronsen & Laessoe (FNE 5) geschlüsselt. Aber bei jeder Art fast irgend etwas nicht:
- M. erubescens muss stark bitter sein, würde sonst gut passen finde ich
- M. silvae-nigrae muss 2sporig sein
- M. abramsii und M. leptocephala haben andere Zystiden und Schnallen
- M. tintinnabulum hat kleinere Sporen und Schnallen
- M. flos-nivium hat andere Zystiden
- M. austera ist dunkler gefärbt und hat regelmässigere Zystiden
usw.
Gruss Raphael


