Hallo zusammen
Diese Woche hatte ich Gelegenheit für ein paar Abstecher in die Berge. Dabei konnte ich den ein oder anderen Pilz finden, hier eine Auswahl.
Bitte korrigiert mich, wenn etwas nicht stimmt.
Am Sonntag gab es nur einen kleinen Spaziergang in Zinal. Leider wurde der Spaziergang viel kürzer als erwartet, weil ich sehr viel Zeit mit dem Eintüten von Pilzen verlor.
Dieses Bachufer mit Lärchen war voller Rötlinge und anderem schönen Zeugs.

1:

EinTrichterling, leider keine Traumkollektion. Der Stiel ist auffallend überfasert. Und die schmale weisse Zone am Stielapex ist auch wichtig.
Das passt gut zu der Gruppe um Clitocybe concava, am ehesten gefällt mir Clitocybe strigosa.
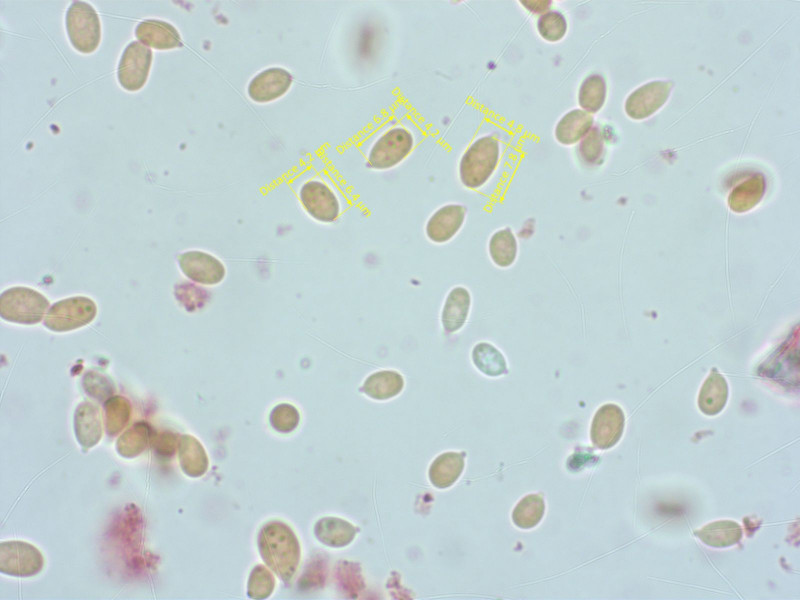
Die Sporen sind stets kürzer als 8 µm.
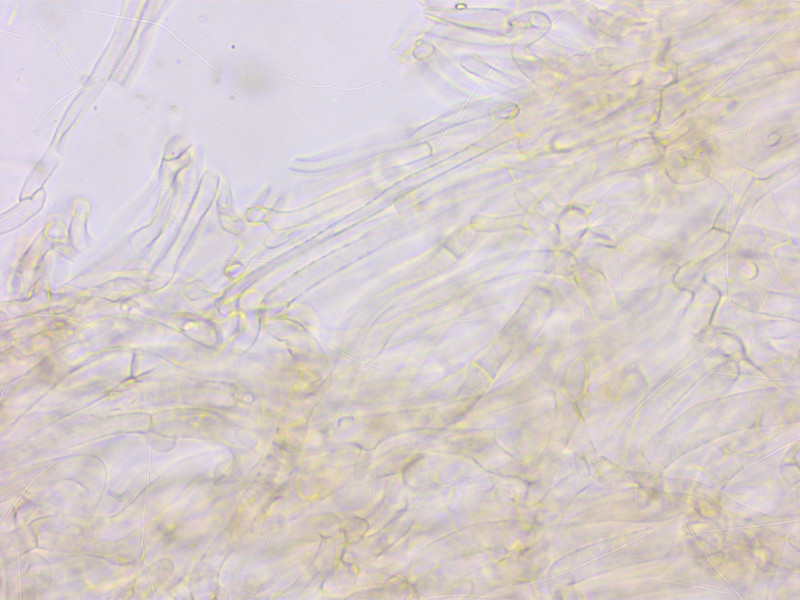
Die HDS ist gemischt intrazellulär und inkrustierend pigmentiert.
2:

Dieses wunderschöne Entoloma catalaunicum war mir eigentlich schon makroskopisch klar, aber musste natürlich abgesichert werden.
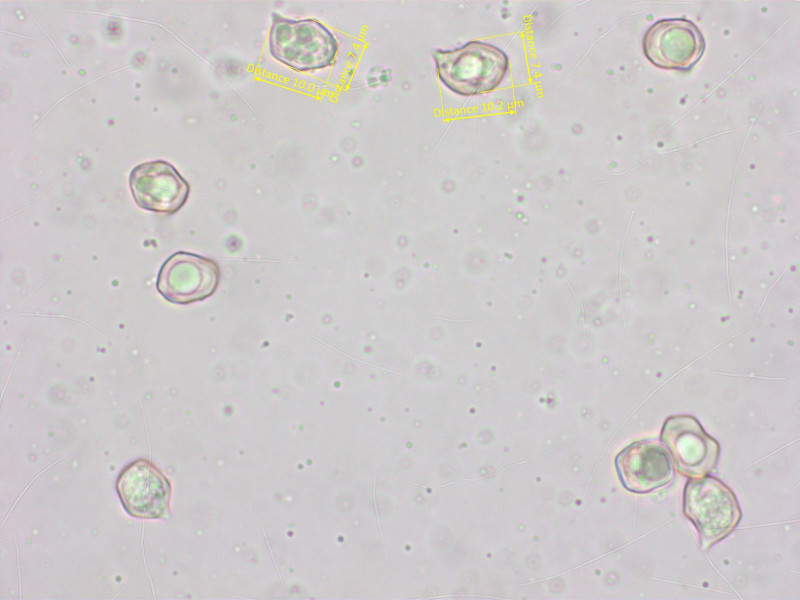
Sporen
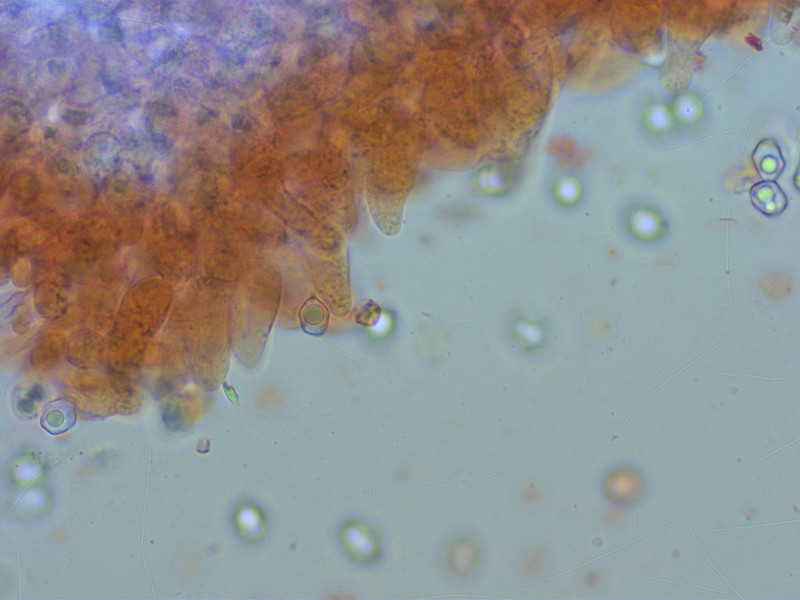
Cheilozystiden vom Rhynchocystidiatum-Typ
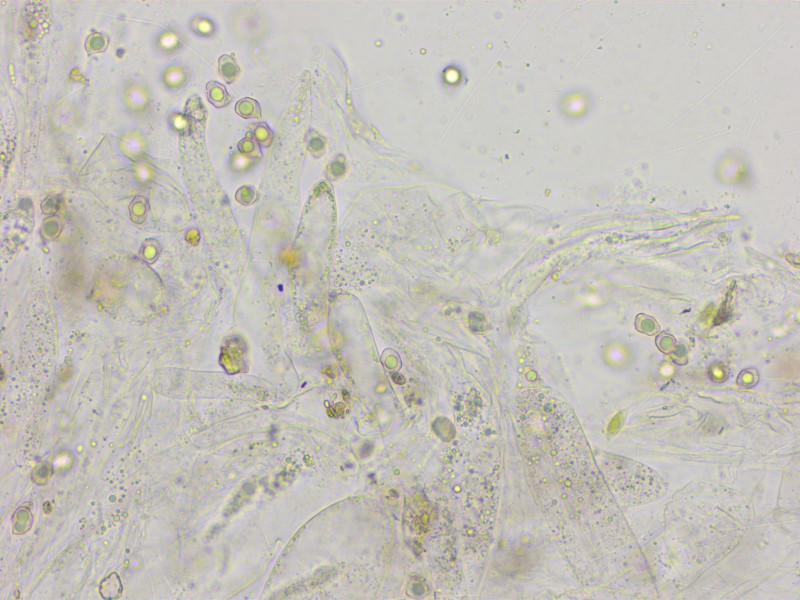
HDS blass intrazellulär-vakuolär pigmentiert.
3:

Entoloma porphyrogriseum stand hier in Unmengen herum.

Sporen wie üblich
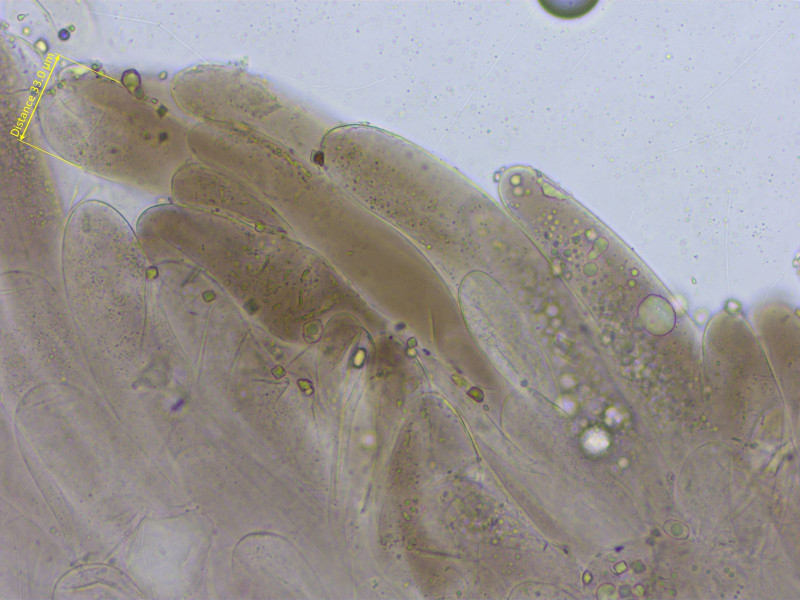
Schneide dicht gepackt mit spindeligen Cheilozystiden
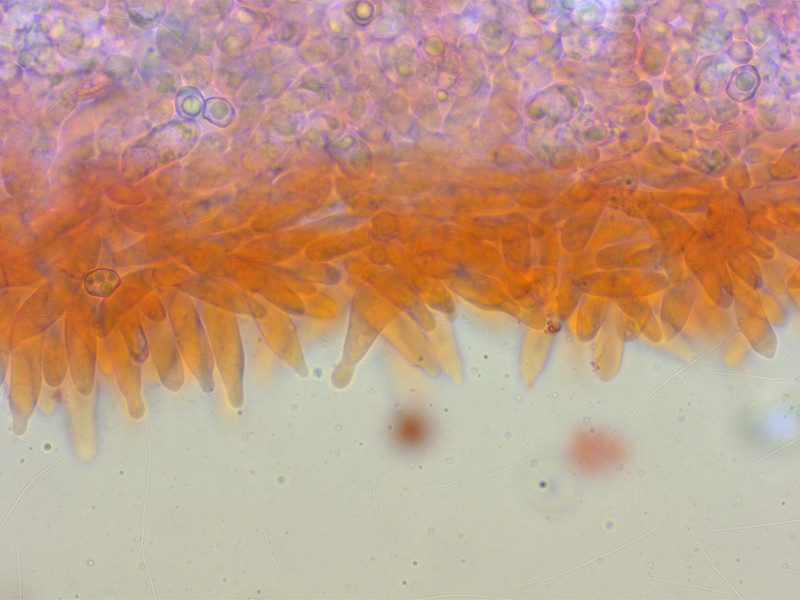
HDS mit dicken End-Elementen, dunkel intrazellulär pigmentiert.
4:

Nur zwei Stück, aber halbwegs bestimmbar: Entoloma sarcitulum.
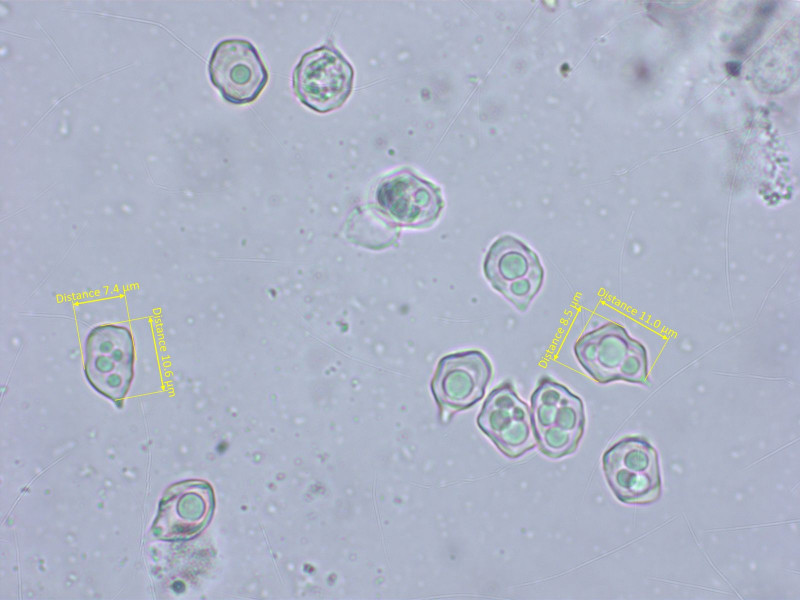
Die Sporen sehen aus wie immer
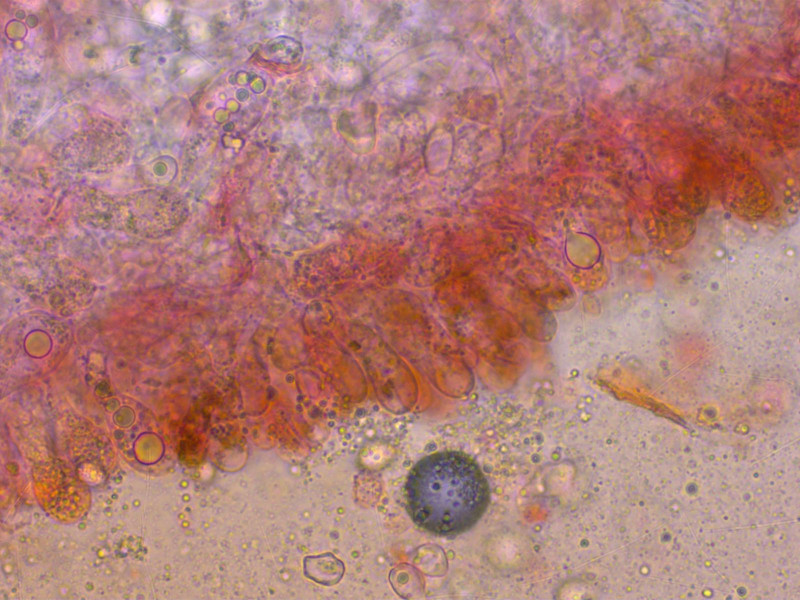
Von den eher spärlichen, keuligen Zystiden habe ich nur dieses Foto, für das ich mich jetzt schäme.

Die HDS ist diffus braun pigmentiert.
5:

Die hier haben mir lange Kopfzerbrechen bereitet.
Mit vielen Fragezeichen würde Entoloma sarcitulum var. spurcifolium einigermassen passen.
Auffallend war ein fruchtig-apfelartiger Geruch, was bei Rötlingen eher die Ausnahme ist.
Vielleicht hat jemand einen besseren Vorschlag?

Auf der Nahaufnahme kann man erkennen, dass die Lamellenschneide stellenweise braun ist.
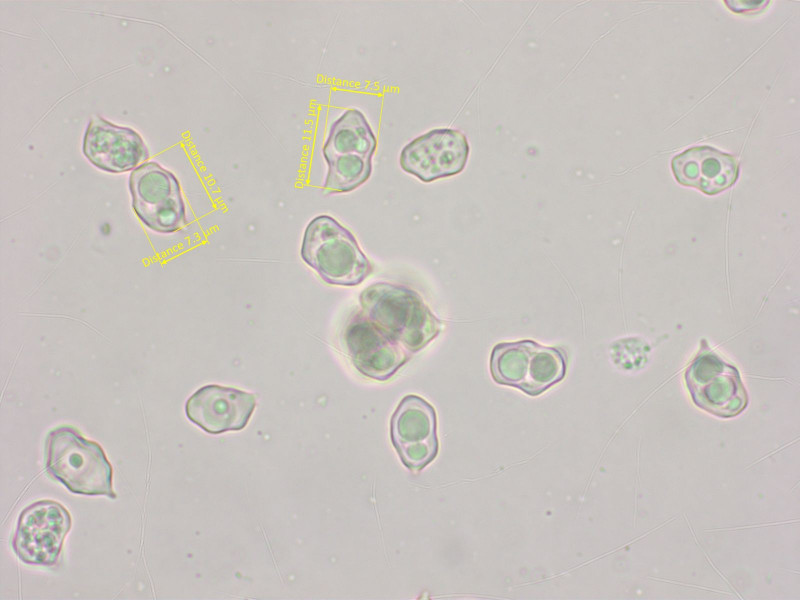
Die Sporen sind etwas länglicher als bei Nr. 4.

Cheilozystiden reichlich vorhanden und keulig
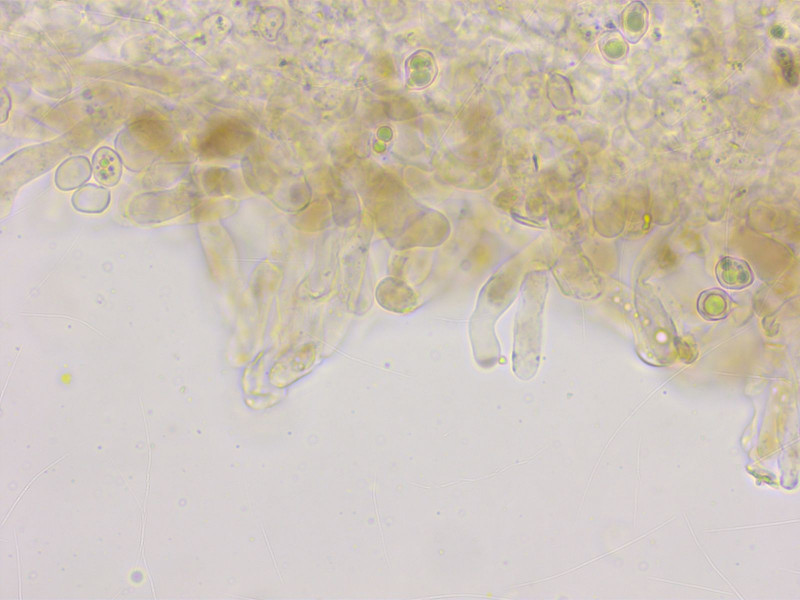
In KOH sieht man gut, dass die Zystiden braun pigmentiert sind.
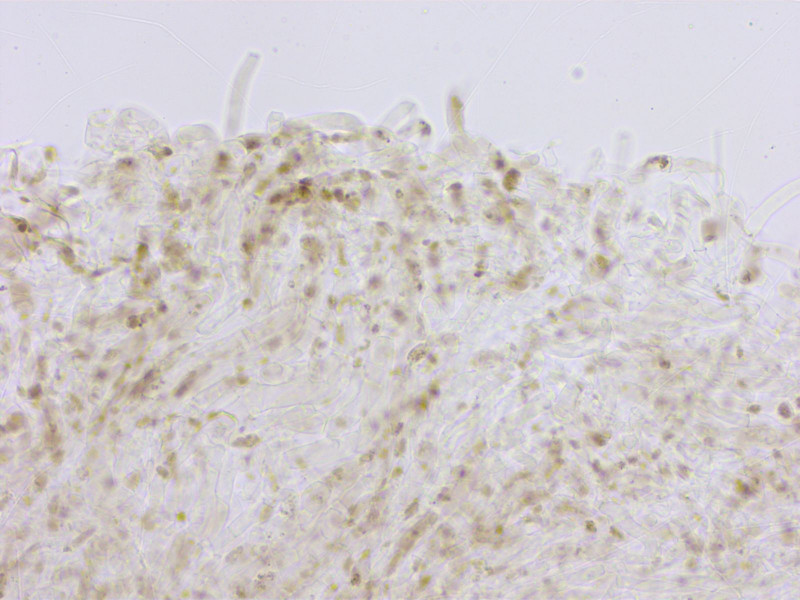
Die HDS ist viel spärlicher pigmentiert, mit locker verteilten "Klumpen".
6:

Ein einzelner Rötling, der mich interessierte weil er auf verkohltem Holz von einer Feuerstelle wuchs.
Es gibt ja dieses ominöse Entoloma carbonicola, aber das hier ist was anderes: Entoloma undatum.
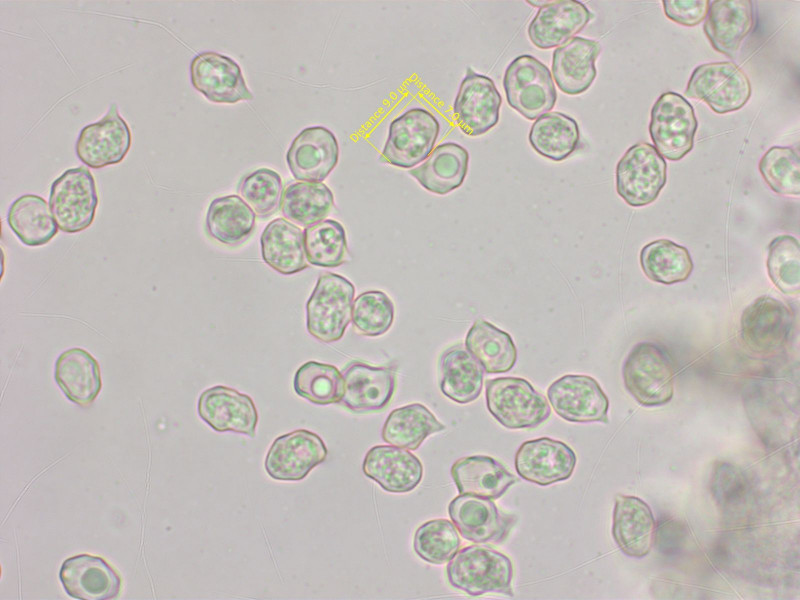
Sporen mit abgerundeten Ecken. Zystiden gab es keine, aber Schnallen hat er.
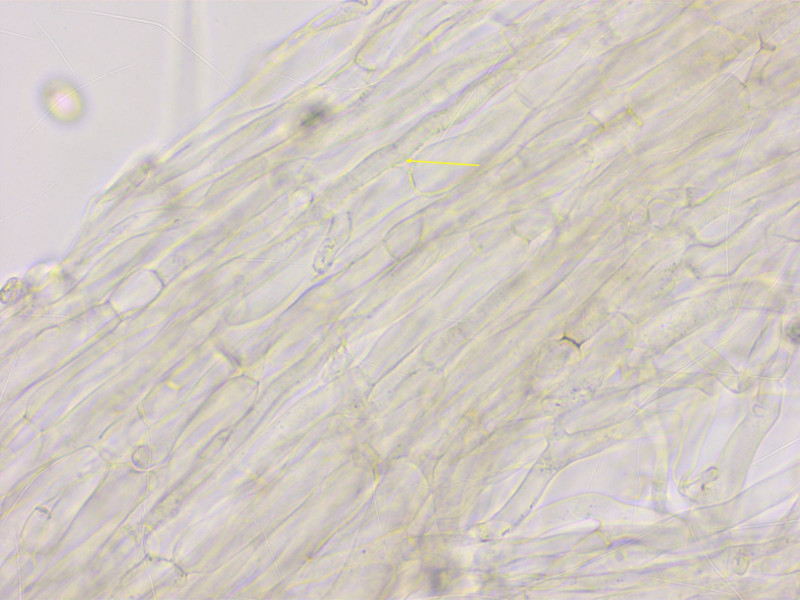
HDS eine blass pigmentierte Kutis, die dünneren Hyphen deutlich inkrustiert.
7:

Erstmal genug Rötlinge, es gibt ja noch andere Pilze. Das hier sollte Helvella fallax sein (H. atra ss. auct.)
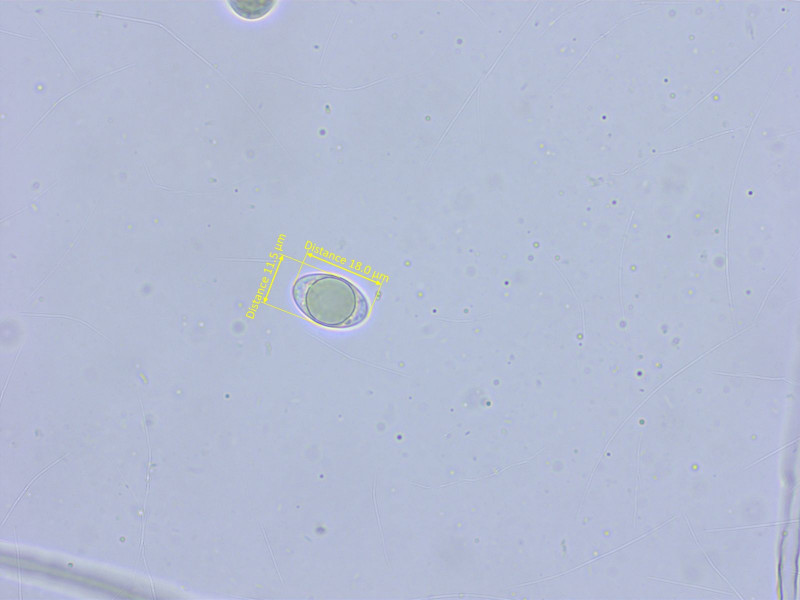
Es gab nur wenige reife Sporen., aber ich meine die Bestimmung passt.
Am Montag gab es dann eine grössere Wanderung über das Emshorn.

Leider gab es nur wenig Pilze, das wenige was ich fand war schliesslich irgendwas Banales.
8:

Es gibt zwei Gymnopus-Arten, die wie dieser hier typisch in der Gämsheide (Loiseleuria) wachsen.
Das machte mir natürlich grosse Freude und sie wurden eifrig eingepackt.
Zu Hause musste ich mit Bedauern feststellen, dass es einfach Gymnopus dryophilus ist.
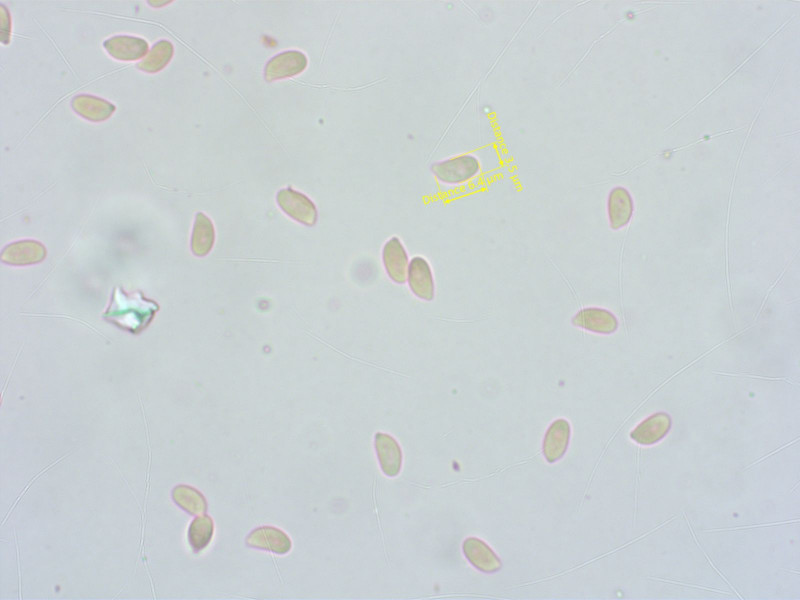
Sporen so wie sie halt bei Rüblingen aussehen.
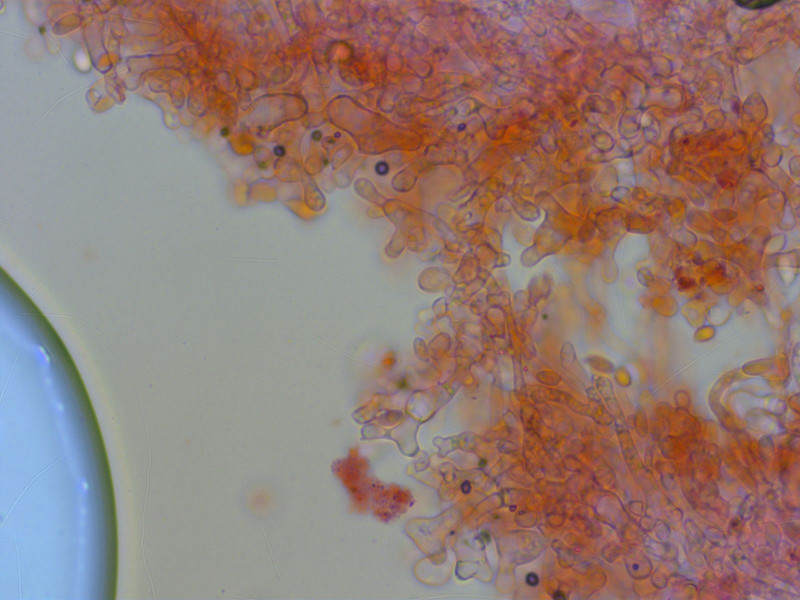
Aber die Zystiden sie so lappig-verwachsen, das gibt es bei G. loiseleurietorum und G. pyrenaeicus nicht.
9:

Diese kleine Infundibulicybe auf 2500m fand ich auch spannend, es gibt da ein paar alpine Arten.
Auch hier die riesige Enttäuschung, es kann eigentlich nur Infundibulicybe gibba sein.
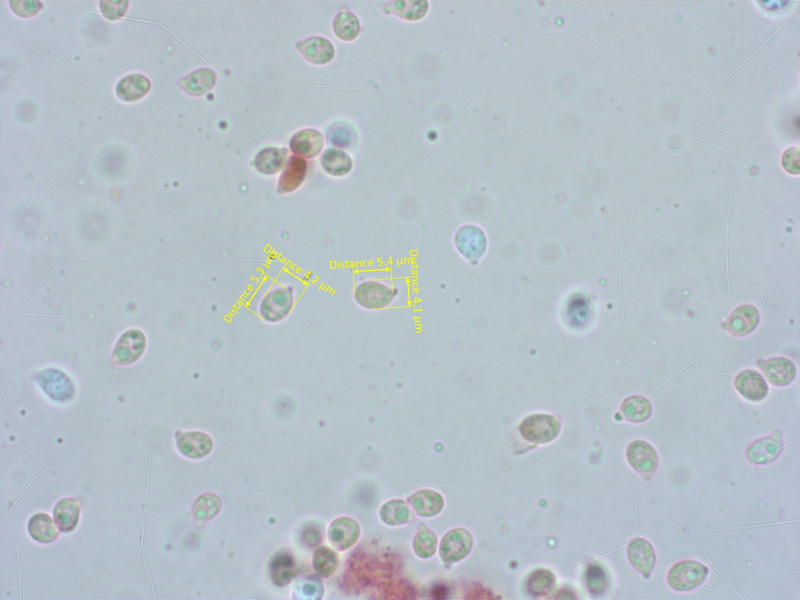
Die Sporen sind breit tropfenförmig, was schon viele Arten ausschliesst.
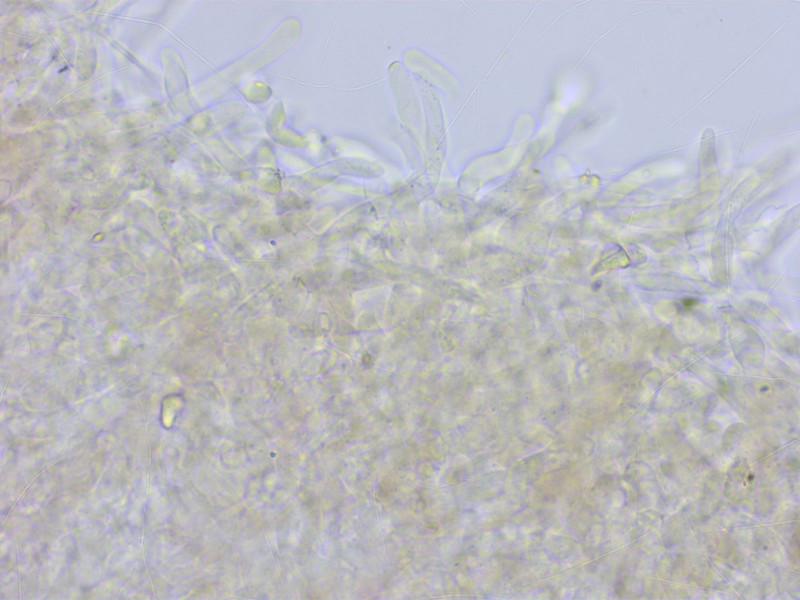
Die HDS ist rein intrazellulär pigmentiert, keine Spur von Inkrustationen.
10:

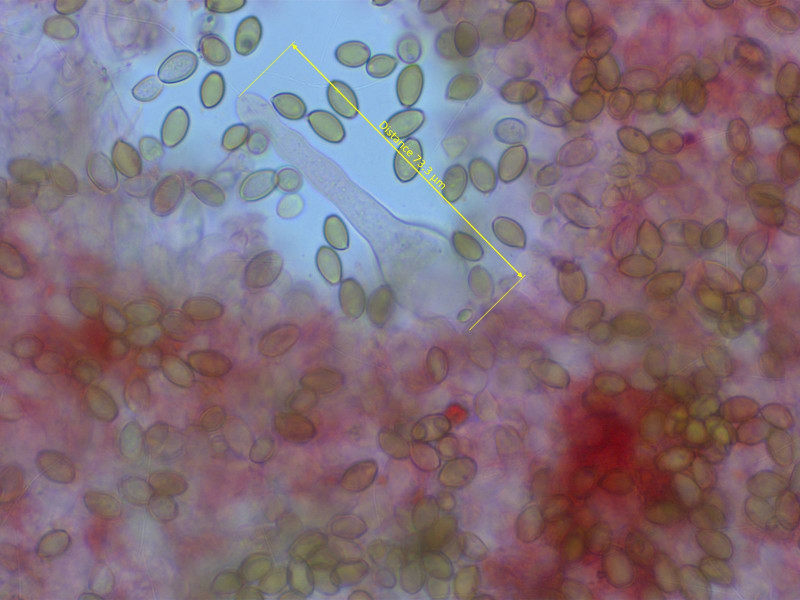
Das hier ist mir noch ein Rätsel. Mit diesem aufsteigenden Ring wusste ich anfangs nicht wo ich das einordnen soll.
Aber es ist eindeutig ein Ackerling, vermutlich in der Nähe des praecox-Aggregats.
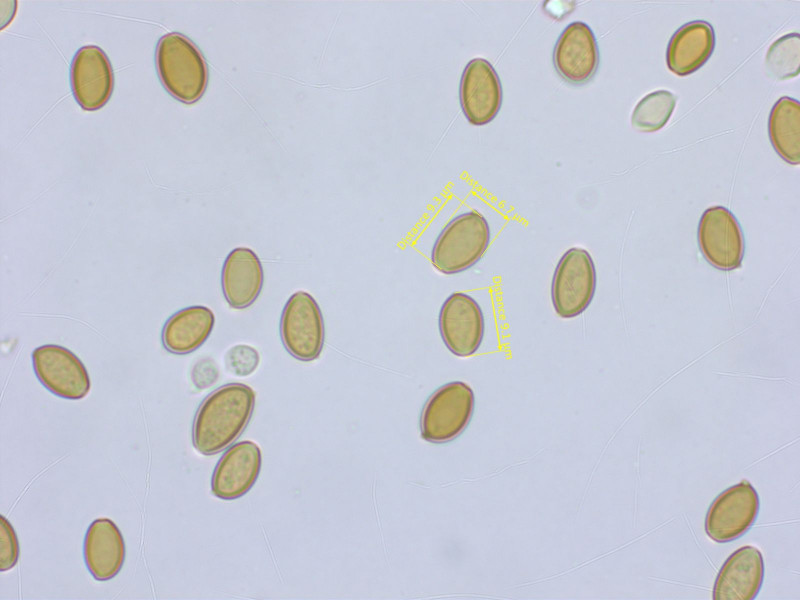
Die Sporen helfen nicht weiter. Dickwandig, mit deutlichem Keimporus.
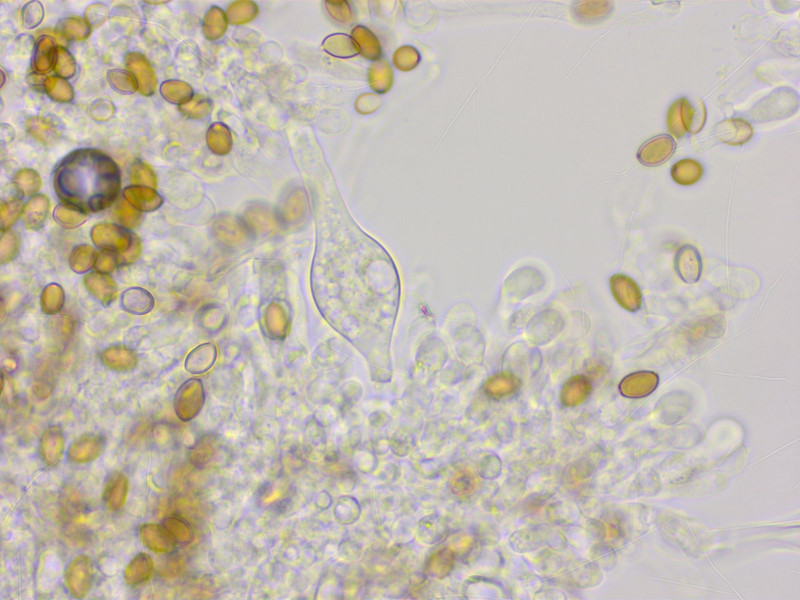
Cheilo- und Pleurozystiden gab es nur zerstreut, aber sie sahen alle genau so aus. Ein breiter Bauchteil und sehr lang gestreckter, teilweise welliger Hals.
Solche Zystiden hat z.B. Agrocybe putaminum, aber der hat keinen Ring. Die Arten um A. praecox haben eigentlich keine solchen Zystiden.
Es gab übrigens auch ähnlich geformte Pileo- und Kaulozystiden.
Dann am Dienstag zum Lac de Dix, nur für einen kleinen Spaziergang.

Ich hatte nur begrenzt Zeit, also gab es auch nicht viele Pilze. Nur zwei unbestimmbare Rötlinge.
11:

Diese Winzlinge hielt ich erst für eine Arrhenia. Sie wuchsen auf der Strasse im Sand.
Es ist wohl etwas aus der rusticoides-Gruppe, aber leider konnte ich sie nicht bestimmen.
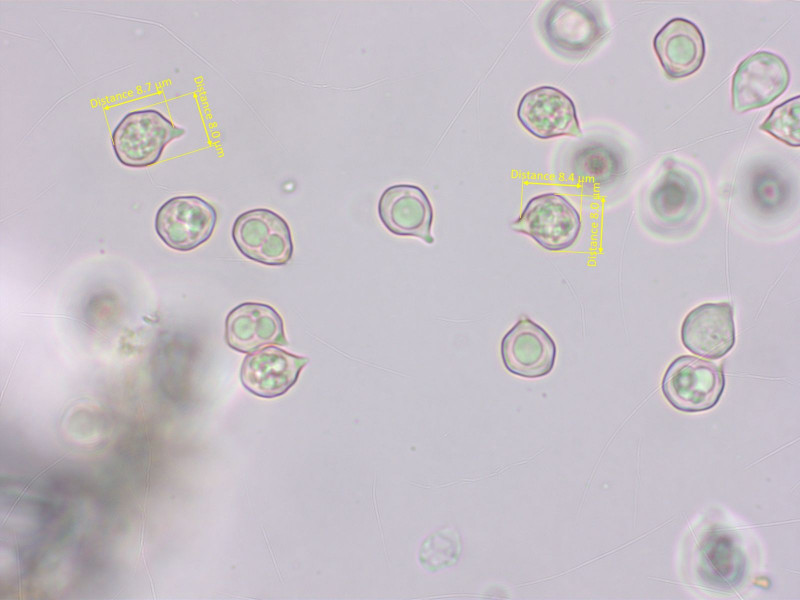
Die Sporen sind isodiametrisch und zu klein für die meisten Vertreter der Gruppe.
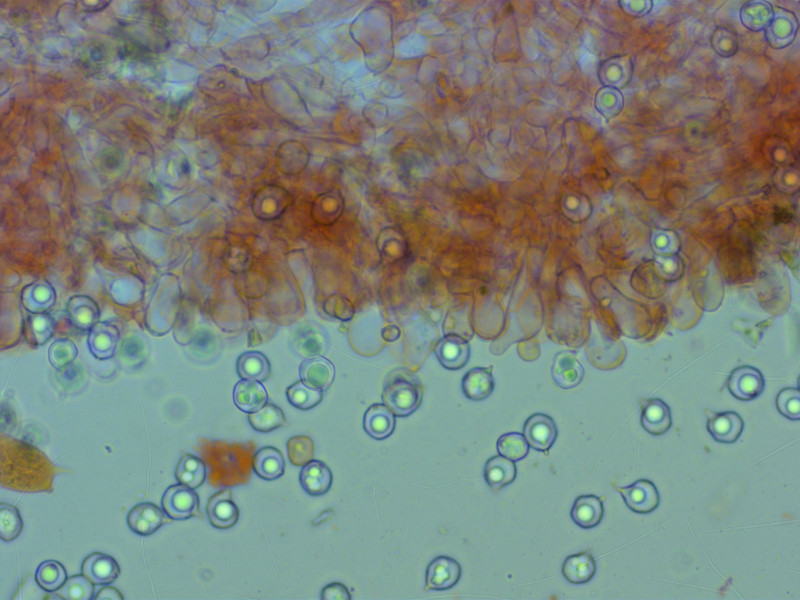
Die Cheilozystiden sind oft keulig, einige aber auch etwas unregelmässig geformt.
Basidien 4-sporig, keine Schnallen.
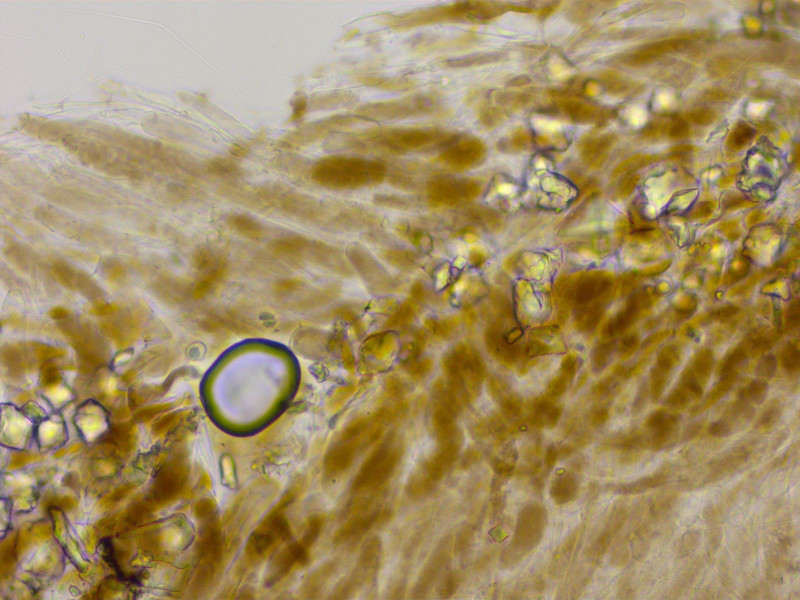
HDS rein intrazellulär pigmentiert.
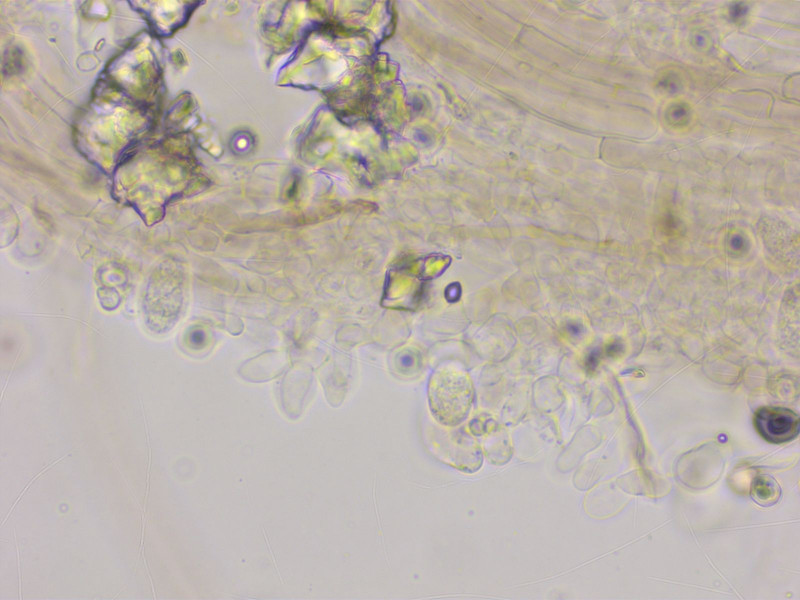
Am Stiel gibt es zahlreiche, büschelige Kaulozystiden.
Ist wohl ein Fall für die Sequenzierung, wenn niemand einen brillianten Vorschlag hat.
12:

Diesen alpinen Rötling meine ich schon das zweite Mal gefunden zu haben, er könnte irgendwo in die Nähe von Entoloma linkii gehören.
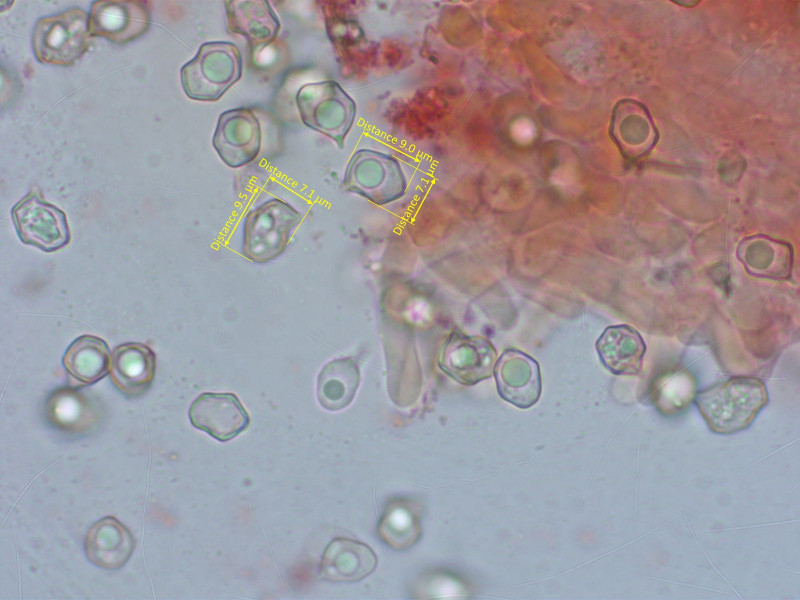
Sporen mal wieder recht unspezifisch.
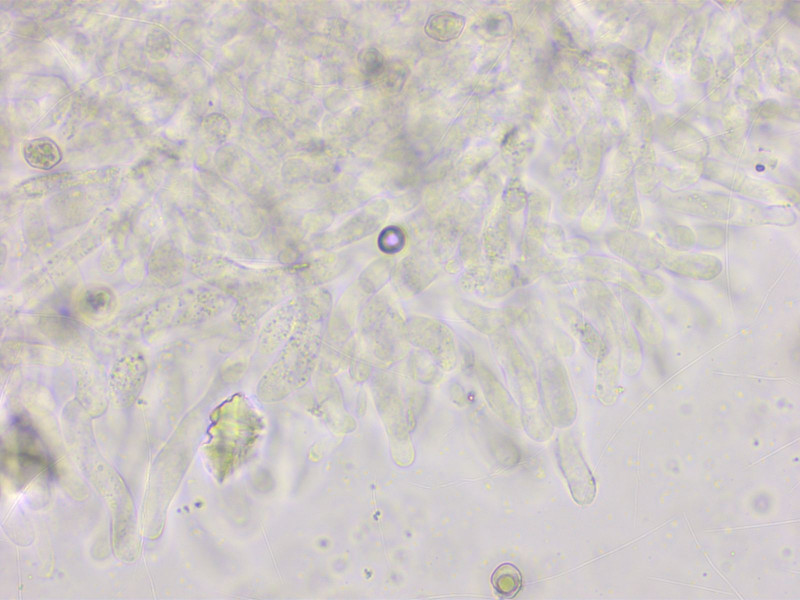
Die keuligen Cheilozystiden sind ganz schwach pigmentiert. Mit der Lupe findet man auch einzelte dunkel Stellen an der Lamellenschneide.
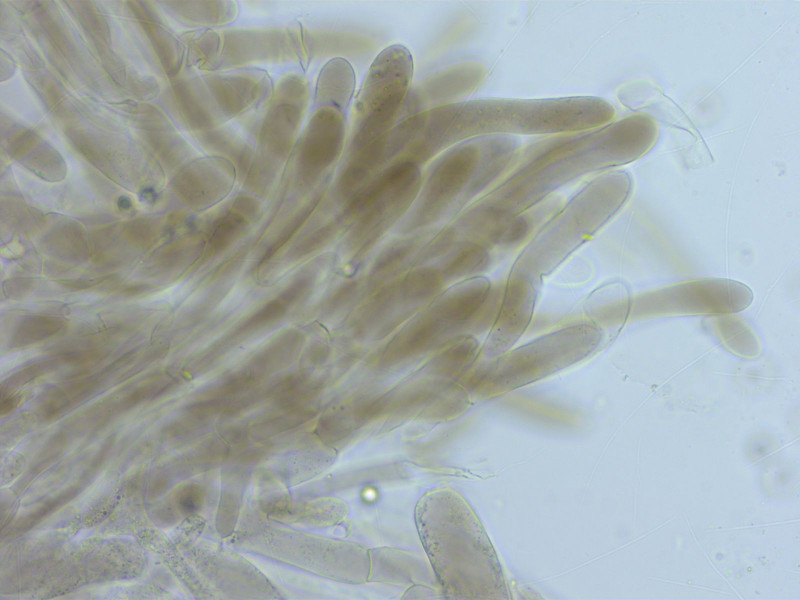
HDS dunkel pigmentiert, mit eher schlanken Endzellen.
Vorgestern gab es schliesslich noch eine Ausflug auf den Sanetsch-Pass:

Es ist zwar wunderschön zum Laufen dort, aber es gibt nur wenige Pilze. Die zahllosen Kühe leisten ganze Arbeit.

Ich bin bis ins Schwemmgebiet des Zanfleuron-Gletschers gegangen, aber Fehlanzeige. Vielleicht war es auch der falsche Zeitpunkt.
13:

Immerhin ein Trichterling hat mich nach Hause begleitet.
Aufgrund des leicht schuppigen Hutes und des Standorts bei Dryas halte ich es für Infundibulicybe dryadum.
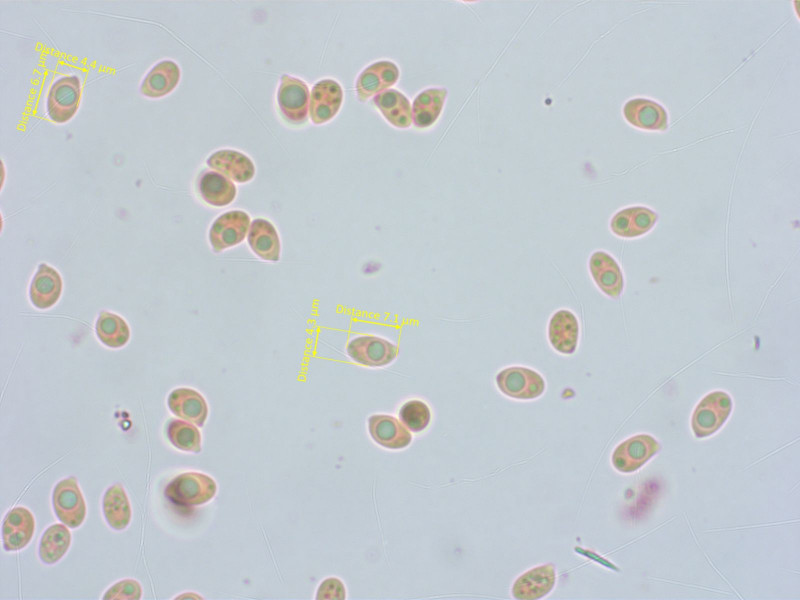
Sporen deutlich schlanker als bei dem Trichterling weiter oben.
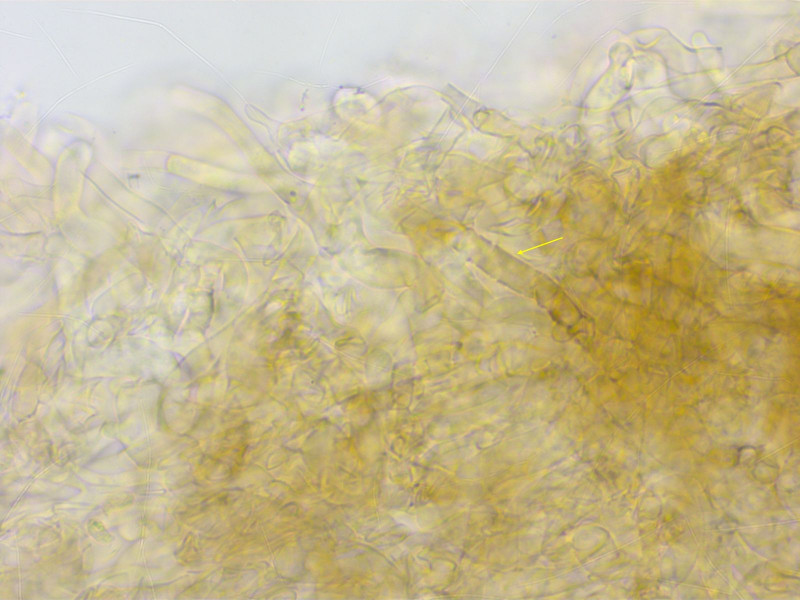
Und hier ist die HDS auch stellenweise deutlich inkrustiert.
Heute hat es ausgiebig geregnet, es sollte die nächsten Tage also wieder Frischmaterial geben.
Viele Grüsse
Raphael


