Hallo zusammen,
nachdem ich am letzten Wochenende im Duisburger Landschaftspark ja schon einige nette Pilze gefunden habe, war ich gestern noch mal dort unterwegs. Der Regen hat offenbar gut getan, denn es gab noch mal deutlich mehr zu bestaunen:
1. Agaricus campestris


2. Lactarius pubescens



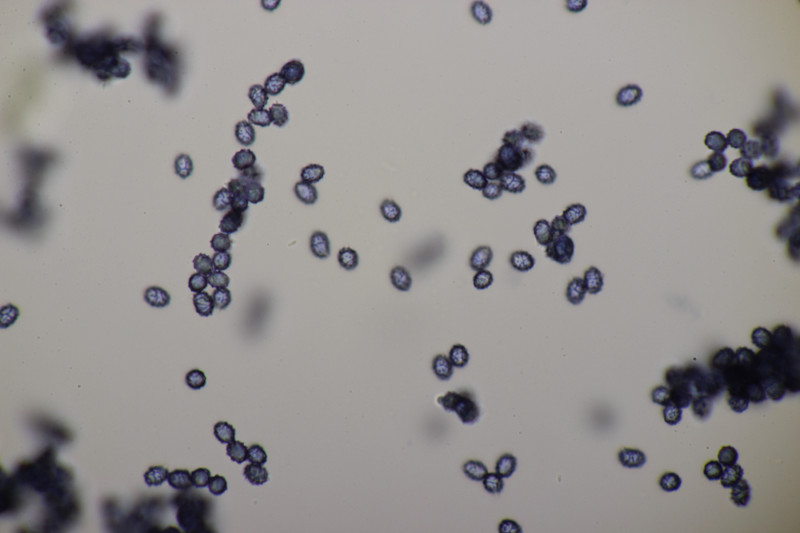
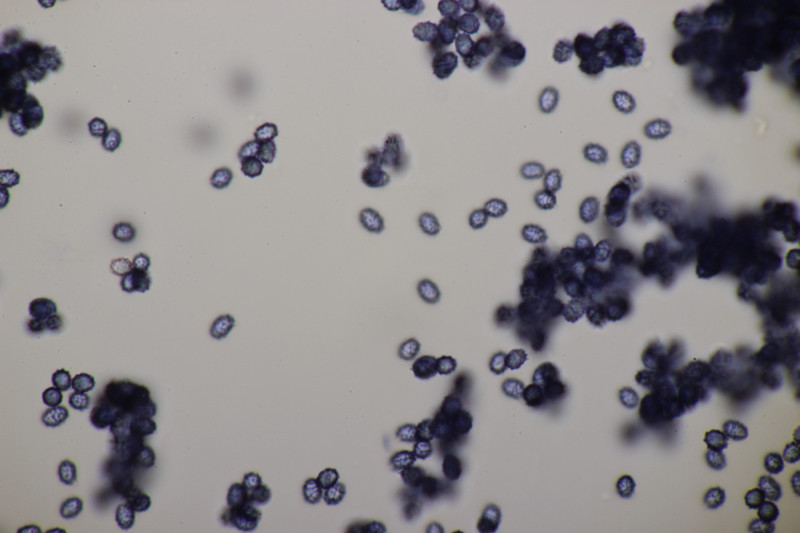
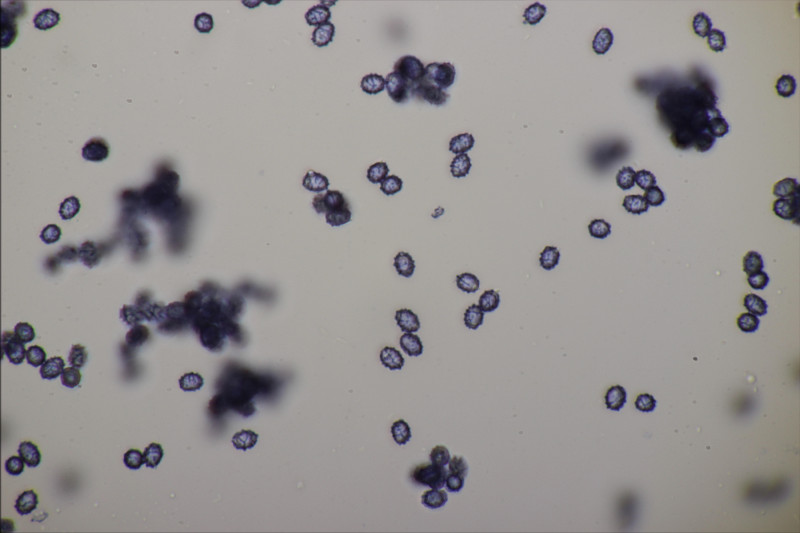

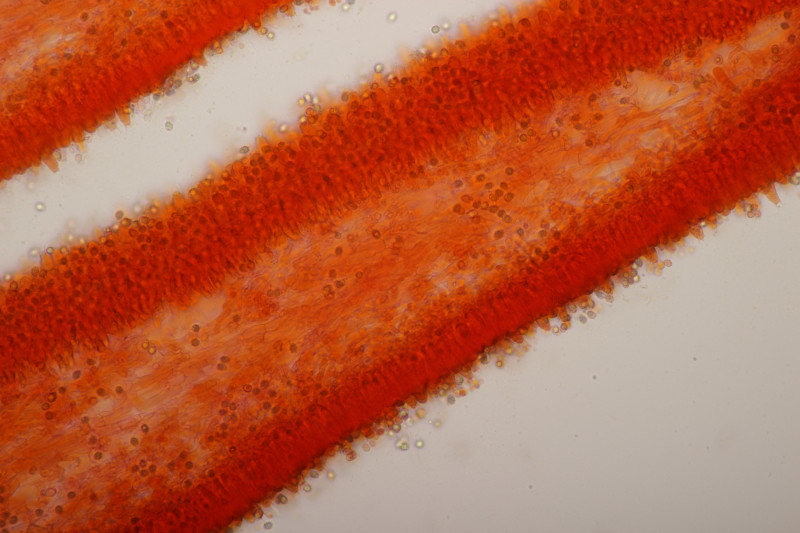

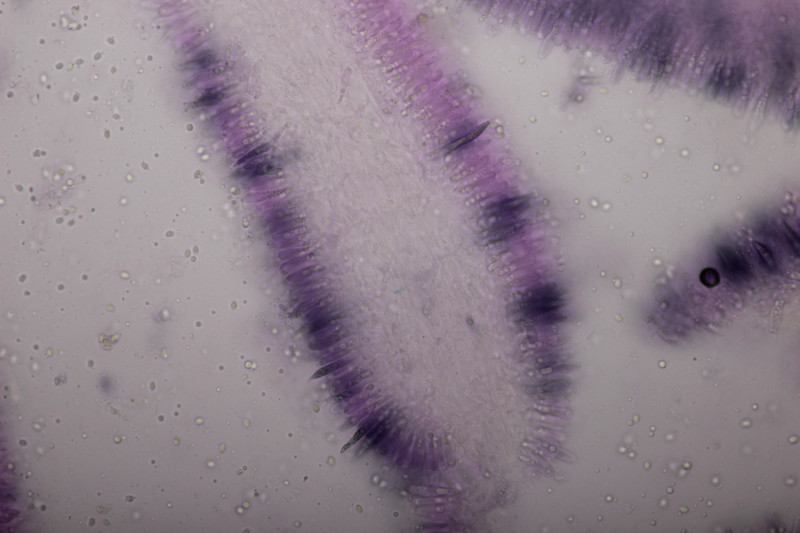

3. Gymnosporangium sabinae ex Pyrus sp.

4. Phyllactinia guttata ex Corylus avellana



5. Parasola conopileus


6. Leucoagaricus leucothites

7. Bovista sp.

8. Pseudombrophila bulbifera. Sporengröße 9.2+-0.3 µm.




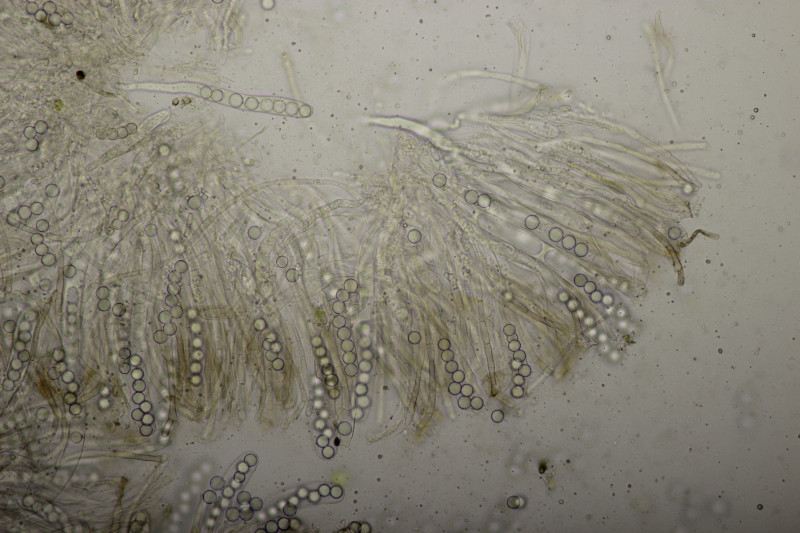

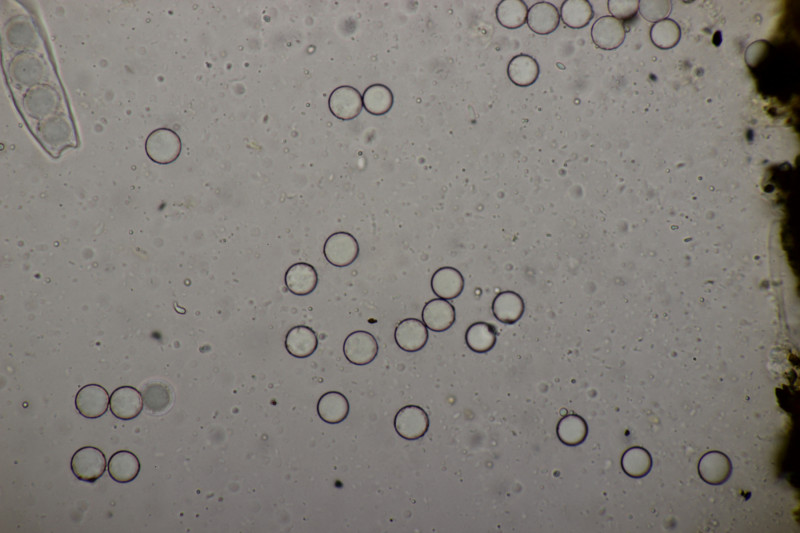
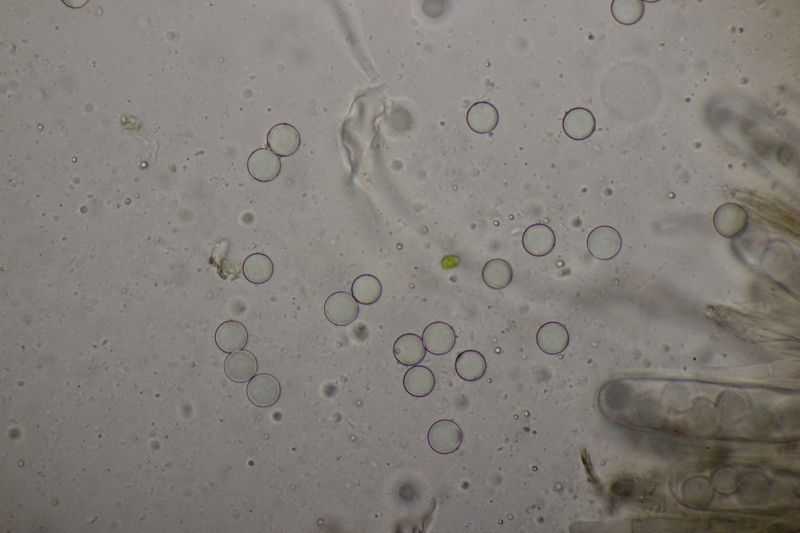



9. Mehltau auf Weide. Vom Blatt her nicht Salix caprea, womit der Mehltau Erysiphe adunca sein müßte. Dafür sind die Anhängsel aber recht kurz und sie standen auch deutlich in eine Richtung ab statt äquatorial.



10. Mehltau auf unbekannter Pflanze





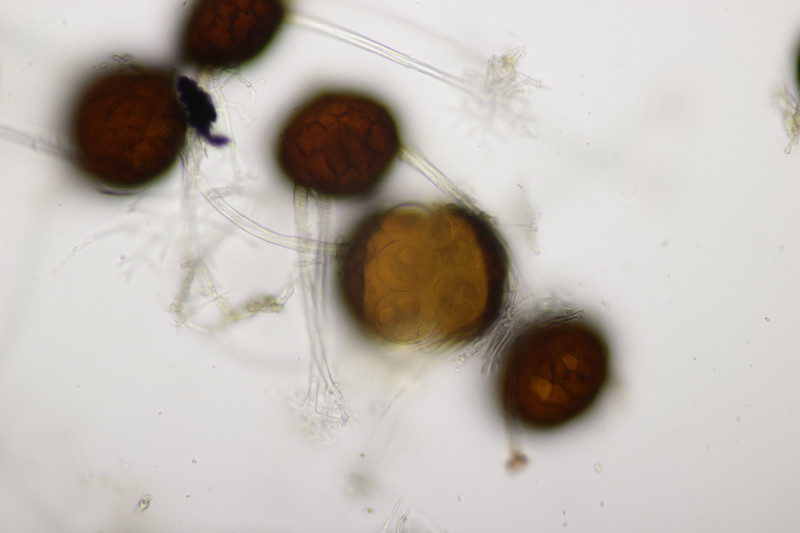
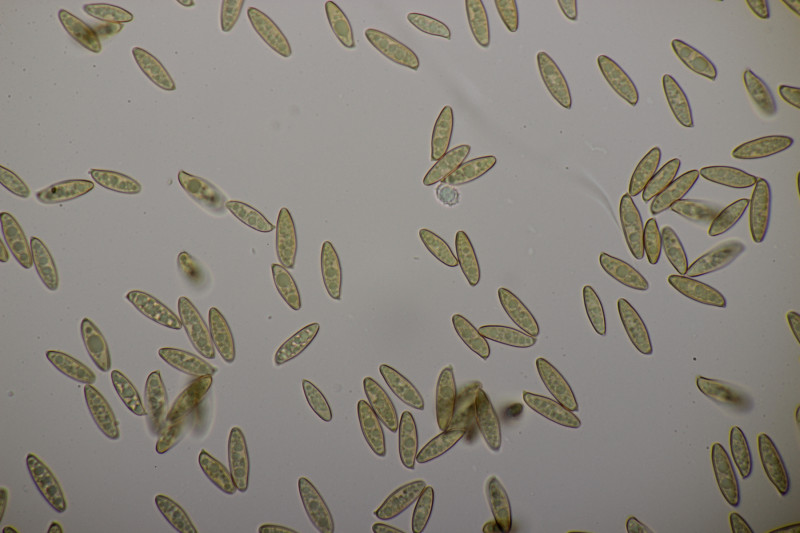
11. Leccinum scabrum. Keine Verfärbung im Fleisch sichtbar. Sporengröße (16.9+-1.0) µm x (5.0+-0.2) µm, Q=3.4+-0.2






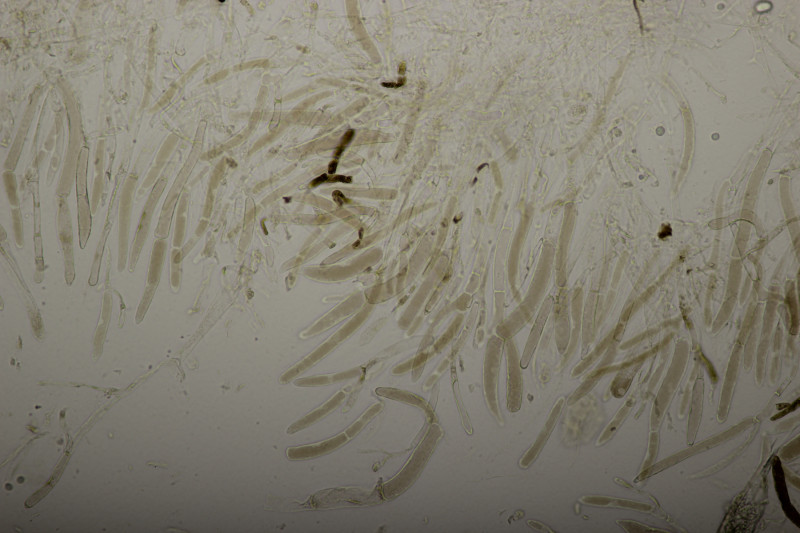

Landschaftspark-0080.jpg



12. Coprinus comatus

13. Stropharia caerulea. Sporengröße (8.6+-0.4) µm x (4.6+-0.2) µm, Q=1.9+-0.1


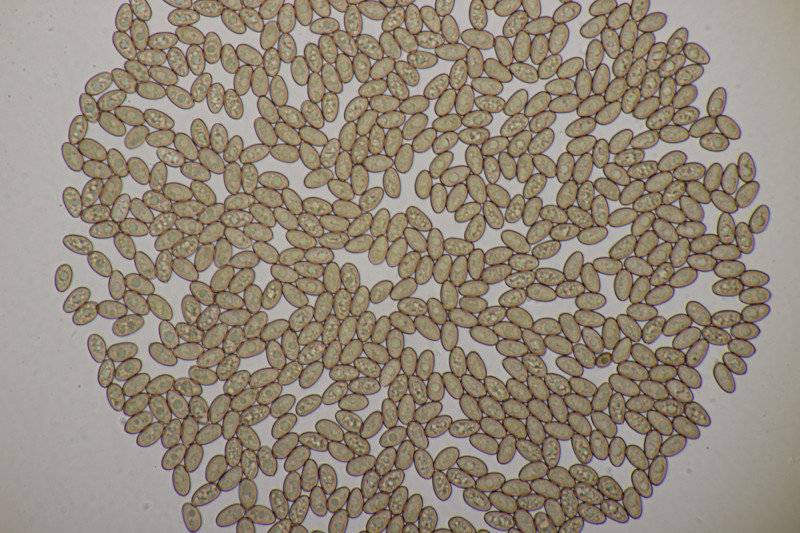
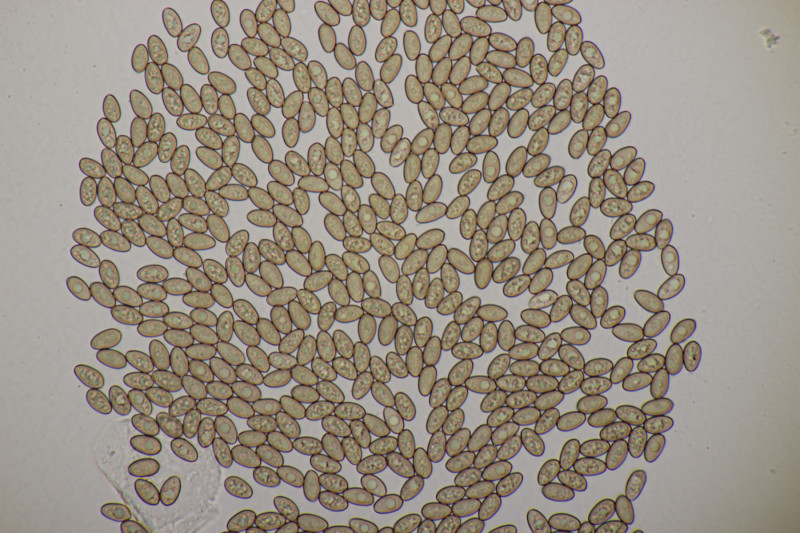

14. Melampsora sp. ex Populus sp. Meine Tendenz geht zu Melampsora laricis-populina





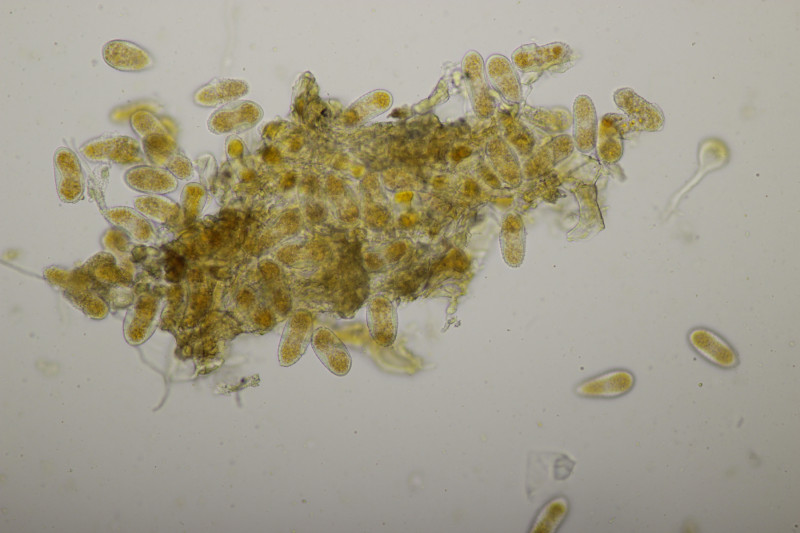


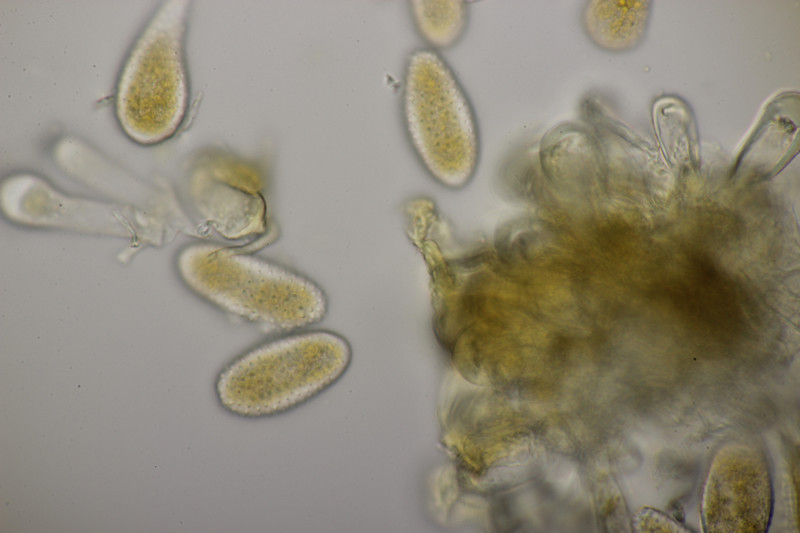
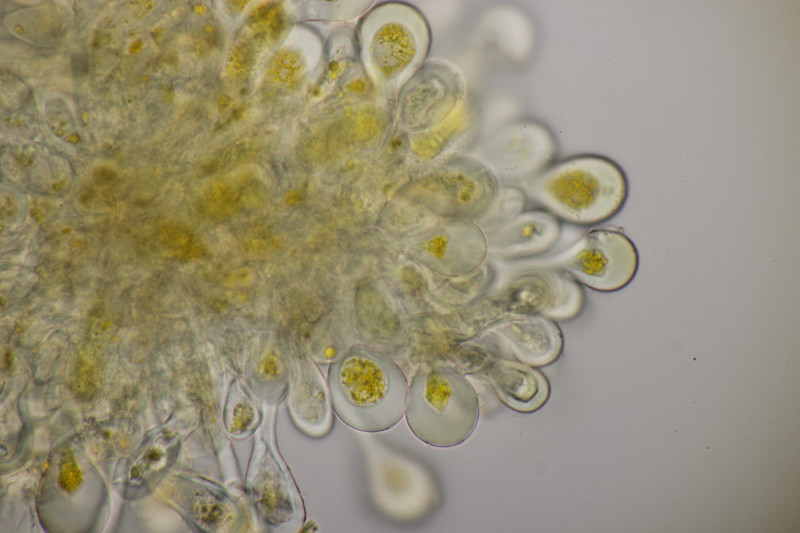


15. Geopora arenicola




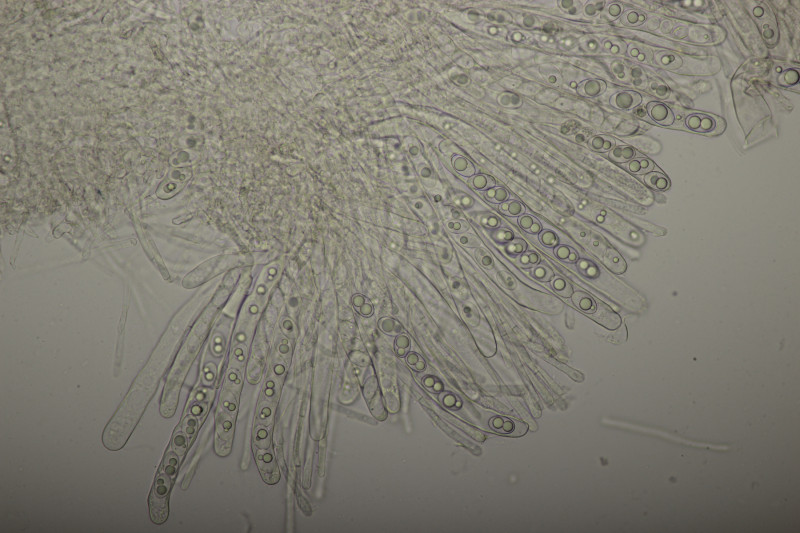


16. Agaricus sp. mit Anisgeruch. Fruchtkörper auffallend klein und mit deutlich gelblichem-orangenen Hut, so daß ich sie auf den ersten Blick gar nicht als Champignons erkannt habe. Sporen muß ich später noch messen. Sporengröße (5.0+-0.3) µm x (3.4+-0.2) µm, Q=1.5+-0.1





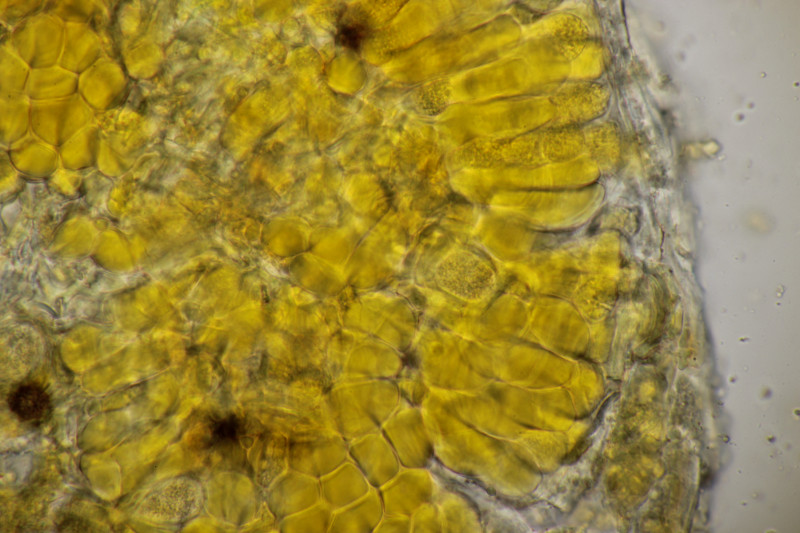
17. Melamspora sp. ex Populus tremula




Björn


