Hallo,
folgende Kollektion Risspilze habe ich kürzlich in meinem Untersuchungsgebiet aufgegabelt:
.
Geruch unbedeutend bis leicht spermatisch (süßliche Komponente?)
bei Pinus
Lamellen jung gräulich-weiß, später hellgrau, schmal angewachsen/angeheftet, untermischt, leicht gesägt.



Hut bucklig, Huthaut eine Kutis, relativ glatt mit rimos eingewachsenen Radialfasern, ockerfarben, zur Hutmitte hin gelblicher. Bis 3,5cm breit

Stiel +- durchgehend weiß, zur Spitze hin mit feiner weißer Bereifung, Basis knollig verdickt. Bis 6cm lang. Trama rötend.

Mikroskopisch:
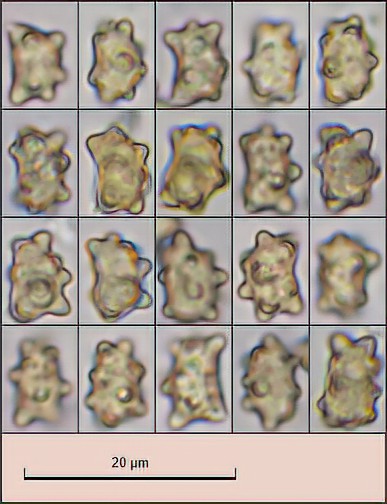
höckersporig
(8) 8.2 - 9 (9.7) × (5.7) 5.8 - 6.5 (6.7) µm
Q = (1.3) 1.34 - 1.5 (1.6) ; N = 20
Me = 8.6 × 6.1 µm ; Qe = 1.4
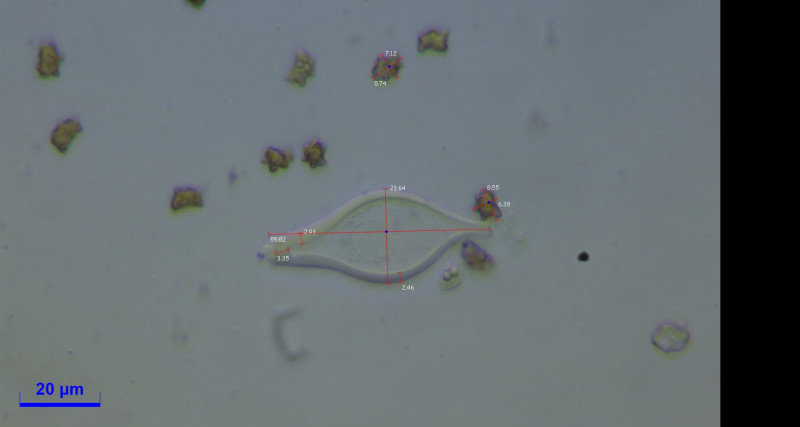
Zystiden:
Cheilozystiden und Pleurozystiden vorhanden, metuloid mit Kristallschopf. Wandstärke bis 3,5. Unterschiede in Hymenialzystiden nicht beobachtet. ca. 50x20.
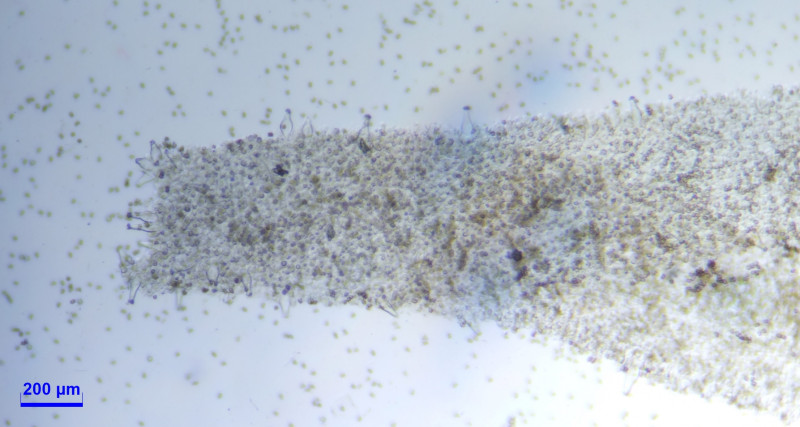
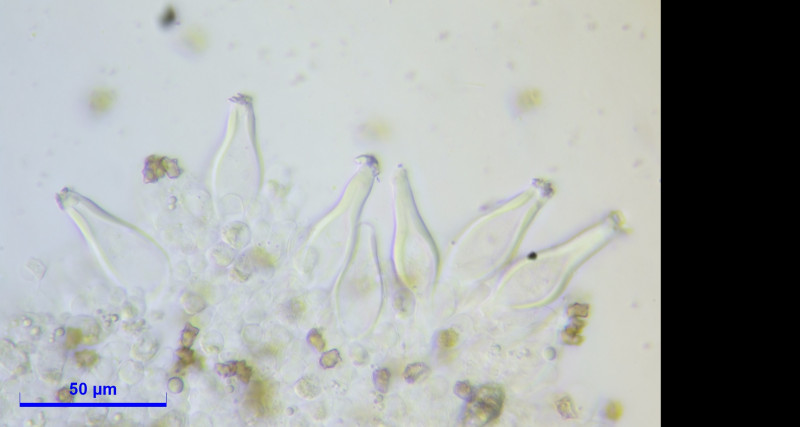
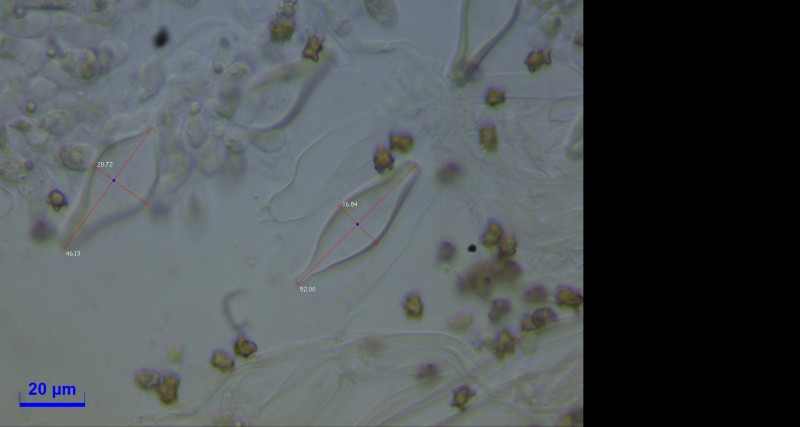
Caulozystiden teils pyriform, bauchig bis fusiform, langeniform, eher flaschenförmig, teils mit Kristallschopf, dann ganz ähnlich den Hymenialzystiden.
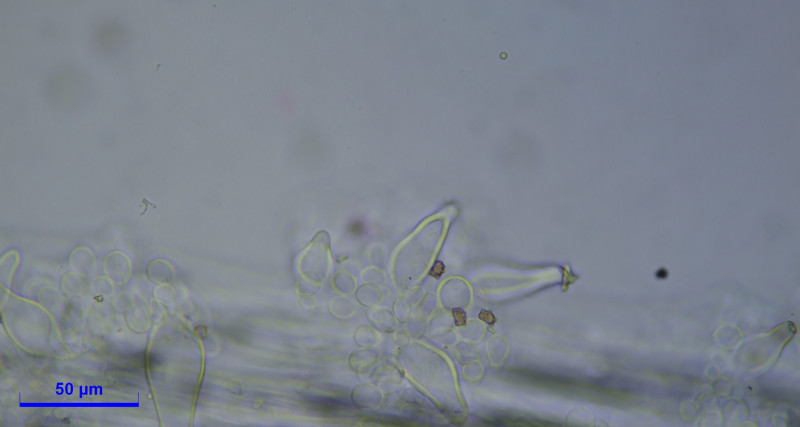
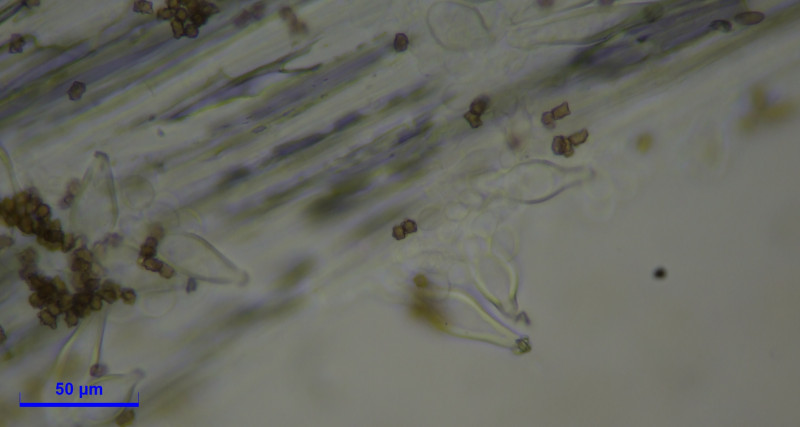
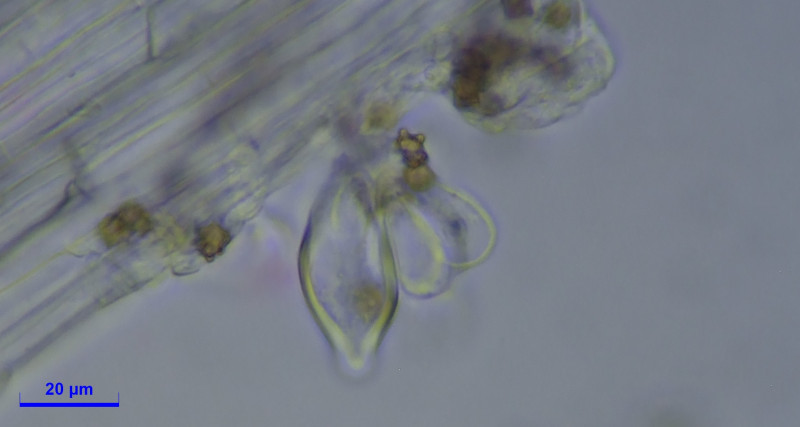
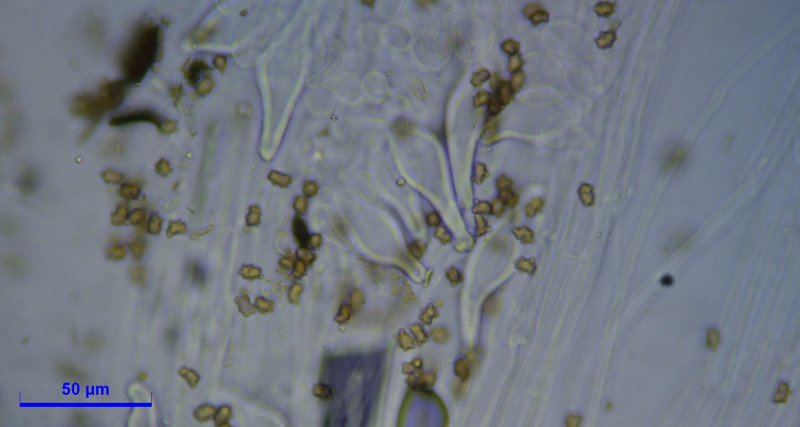
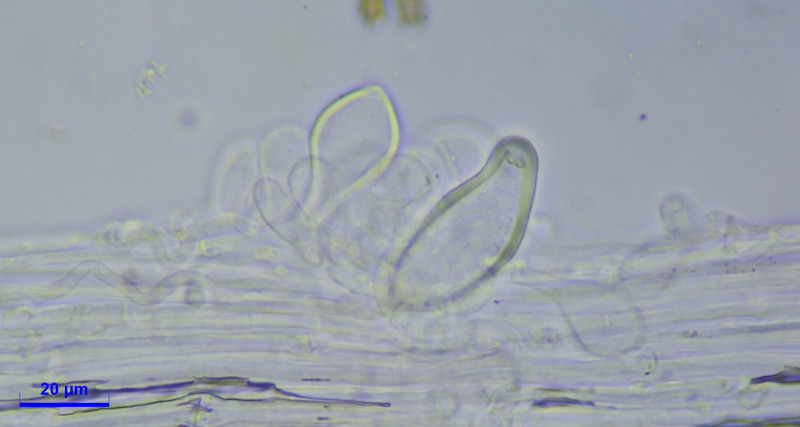
Diagnose: Ich komme bei Inocybe mixtilis raus, halte aber Inocybe abdita für eine Option?
Vielen Dank euch!
Grüße
Lukas
![]() Da man Täublinge gar nicht bestimmen kann, niemand kann sowas seriös von sich behaupten… was soll ich machen?
Da man Täublinge gar nicht bestimmen kann, niemand kann sowas seriös von sich behaupten… was soll ich machen?![]()


