Hallo!
Sorry, gibt noch eine Fortsetzung.
Ist zwar nun auch schon über eine Woche her, aber das "Gelände II" musste nochmal untersucht werden.
Äh...
Ich häng' das hier einfach mal hinten dran. War eh kaum was zu finden, lohnt sich kaum, da nochmal reinzufahren.
Albatrellus confluens = Semmelporling


Das ist die selbe Fundstelle wie oben.
So langsam lerne ich die kennen...
Pleurocybella porrigens = Ohrförmiger Seitling

Leccinum cf scabrum = Birkenpilz



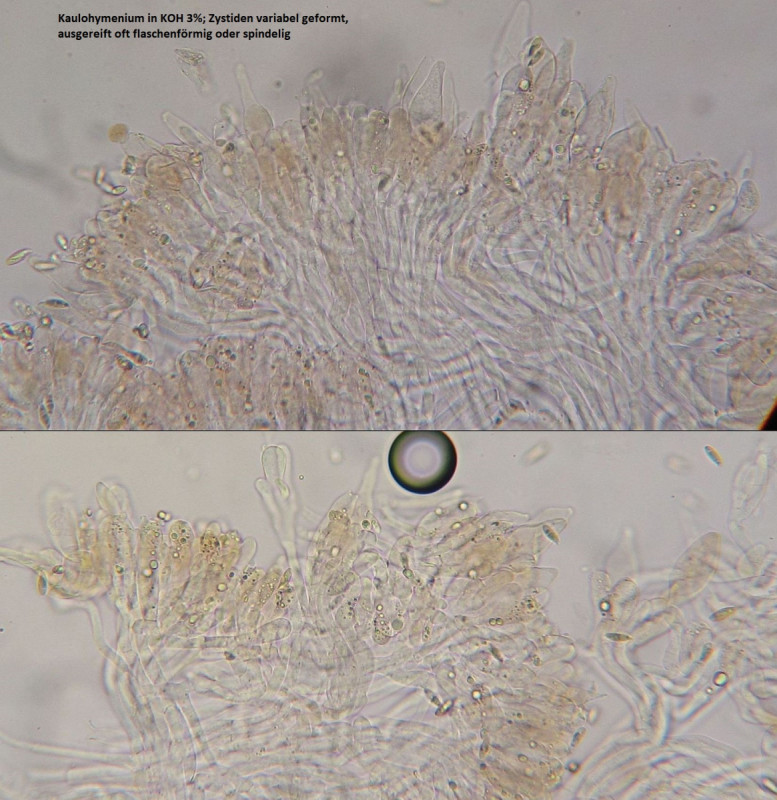

Kam mir komisch vor mit den ganz hellen Hüten und auch hellen Stielschuppen.
Stand aber im finstersten dichten Fichtendickicht der Welt, und mikroskopisch ist das schon einfach scabrum, also...
Beleg habe ich mal getrocknet, falls das doch noch jemand weiter untersuchen will.
Ganoderma lucidum s.l. = Glänzender Lackporling


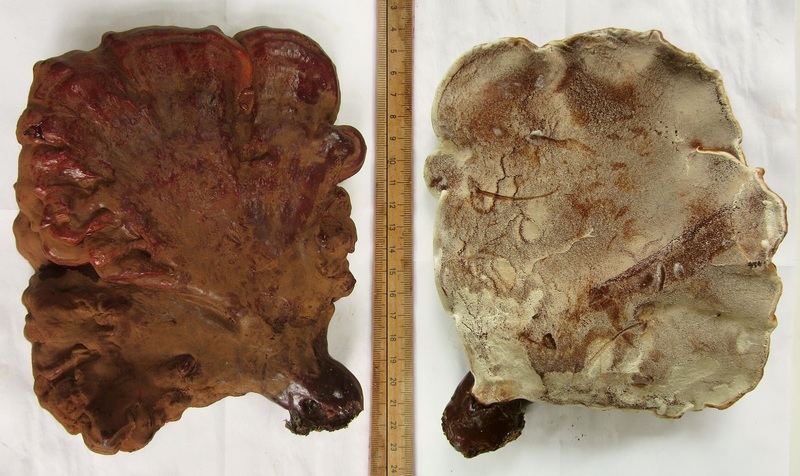
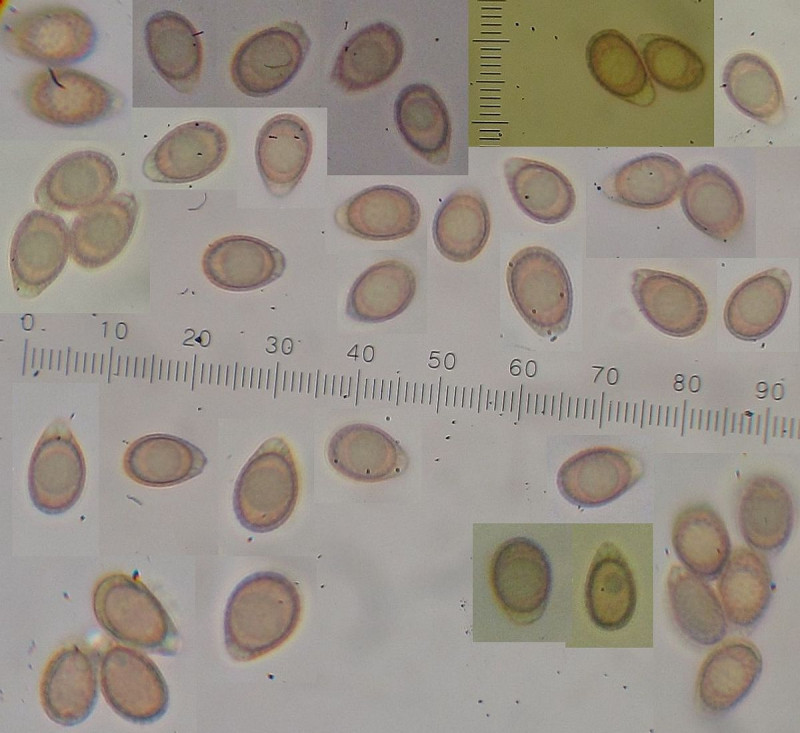
Substrat ist Tanne (Abies spec.). Es ist aber nicht Ganoderma carnosum, denn das passt von den Farben der Kruste her genauso wenig wie von der Sporengröße (wobei die wohl eher unzuverlässig sein könnte). Das "s.l." im Namen ist deswegen wichtig weil Ganoderma lucidum s.str. wohl nicht an Nadelholz vorkommt.
Was diese leuchtend rotkrustigen an Nadelholz genau sind (ob tsugae, valesiacum oder noch was ganz anderes) ist für mich momentan nicht zu klären.
Auch dazu gibt's einen (umfangreichen) Beleg, wenn jemand da noch tiefer reingucken möchte.
Hericium flagellum = Tannen - Stachelbart


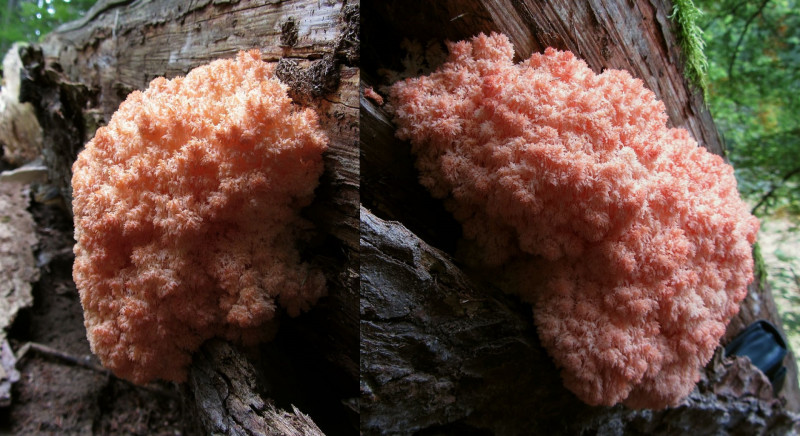

In der Färbung definitiv einer der bemerkenswertesten Pilze, die ich je gesehen habe. Keine Ahnung, warum dieser junge fruchtkörper so pink ist. Es ist kein Farbartefakt der Kamera (die habe ich sogar noch ausgeglichen).
Tolles Ding. 
Leotia spec. = Gallertkäppchen





Also...
Ich kenne schwarzgrün verfärbende Leotia lubrica. Denen sieht man schon an, daß sie unfit sind. Die bilden auch nicht so schicke, grüne Schüppchen auf gelbem Stieluntergrund. Die Kappen sind glitschig, breiig und zerfließen dann irgendwann. Man sieht ihnen an, daß die unfit sind. Irgendwie krank, befallen, von was auch immer...
Die hier sind nicht befallen. Die sind quietschfidel und munter, meiner Einschätzung nach. Die Käppchen glänzten teilweise, weil nass, aber sind nicht breiig weich, sondern fest und elastisch. Mikroskopieren musste ich leider Totmaterial (also getrocknet), was freilich nicht so ein großer Spaß ist bei Ascos.
Also wenn es sowas wie ein "Schwarzgrünes Gallertkäppchen" als eigene Art auch hier in Europa gibt, dann müsste das vermutlich das hier sein.
Beleg ist vorhanden, falls jemand mag...
Nochmal zurück zu der Ramaria, die oben bisher als "Ramaria cf subbotrytis" dokumentiert war, in kürze aber zu "Ramaria spec. A1" geändert wird.
Die konnte ich an drei weiteren Stellen finden, die schönste Kollektion habe ich nochmal eingesammelt.
Ramaria spec. A2 = Unbiskante Koralle



Auch wieder nach trennung vom Mycel rasch zu gelb / ockergelb umfärbend:



Die Farben sind wirklich krass wiederzugeben, vor allem mit einer farbenblinden Kamera.
Gerade die Fundortaufnahmen geben es hier aber ganz gut wieder, sogar noch einen Tik besser als die im Startbeitrag. Auch wenn das Moos komisch aussieht (stimmt aber auch fast von den Farben her).
Ramaria subbotrytis würde ich inzwischen ausschließen wollen. Das ist doch irgendwie zu viel gelb und orange. Zudem: Zwei der drei neuen Fundstellen lassen eine Assoziation zu Nadelbäumen als Mykorrhizapartner zu. Also Fichte oder Weißtanne. Auch bei den anderen Fundstellen, waren kleinere Rotbuchen eher Randerscheinungen im Fichten- Tannenbestand.
Ramaria neoformosa würde farblich ganz gut passen - ist aber zumindest im Sinne von Christan auch eine Laubwaldart und hat zudem breitere Sporen (aus meiner Sicht das Hauptausschlusskriterium gegen neoformosa in diesem Fall). Allerdings fand ich einen Artikel mit einem Bericht zu Korallenfunden aus Skandinavien - da gibt es "Ramaria neoformosa agg." auch in Nadelwäldern, allerdings scheinen die das Taxon doch etwas anders zu interpretieren.
Am ehesten favorisiere ich im Moment Ramaria dolomitica s. Christan. Das wäre immerhin ein "Bergpilz" mit Assoziation zu Nadelbäumen.
Oder ich bleibe vorerst einfach bei "Ramaria spec. A" und nummeriere die Funde durch...
Tricholoma columbetta = Weißseidiger Ritterling

Tricholoma pardinum = Echter Tigerritterling


Hier hätte ich ernste Schwierigkeiten gehabt, das von Tricholoma filamentosum zu trennen, wenn nicht der alte Fruchtkörper dabei gestanden wäre.
In Gebieten, wo Tannen und Rotbuchen durcheinander wachsen, und wenn die Fruchtkörper nicht typisch ausgeprägt sind, ist die Trennung der beiden Arten schwierig.
Cortinarius varius = Semmelgelber Schleimkopf

Gibt's dort an mehreren Stellen. Nun auch mal ausreichend frische, knackige Fruchtkörper für ein Pfännchen. Sehr lecker!
Cortinarius venetus = Grünfaseriger Raukopf






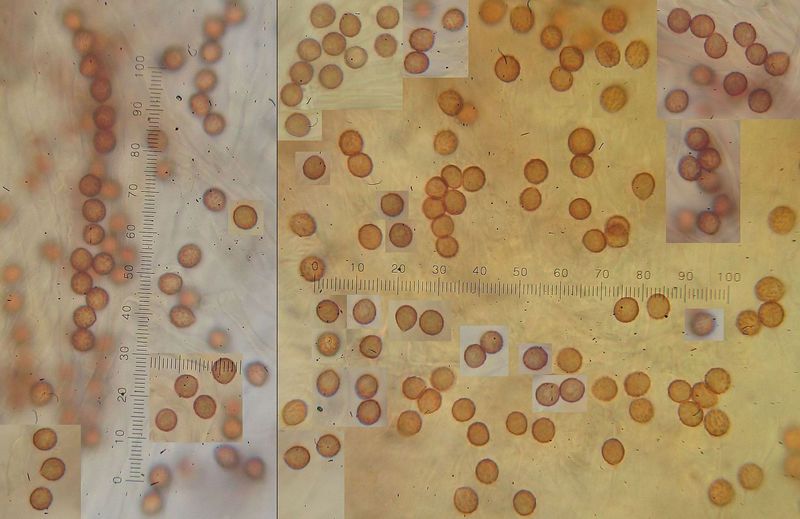
Cortinarius cf aureofulvus = Goldbrauner Klumpfuß



Cortinarius spec. ("sect. riederi")




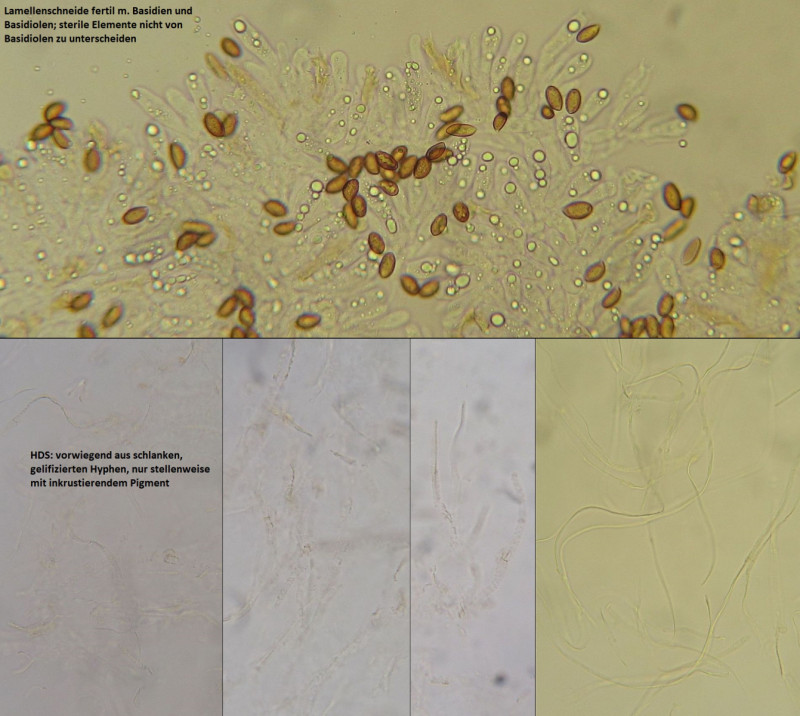
Für dieses Phlegmacium kommen als Mykorrhizapartner Weißtanne, Fichte und Rotbuche in Betracht.
Ich denke, daß die Pilze zur Rotbuche gehören, daß das also eine der Laubwaldarten ist - und damit ist das Pilzchen für mich momentan unbestimmbar.
Im Grunde müsste das entweder Cortinarius argenteolilacinus oder Cortinarius glaucocyanopus sein.
Zu beiden Arten ist allerdings so gut wie nix bekannt. Ich kann mir dazu derzeit kein Bild machen und ordne den Fund erstmal keiner der beiden Arten zu - wenn jemand dazu eine Eingebung hat: Immer her damit, ansonsten lege ich den mal beiseite (Beleg ist selbstverständlich vorhanden) und gucke, was weietre Funde so an weiteren Erkenntnissen bringen.
Das Tal scheint sich übrigens als ein kleines Schleierlingsparadies zu entpuppen.
Da waren noch erheblich mehr Arten, aber meistens entweder Einzelfruchtkörper (cf. magicus oder glaucescens) oder unfotogene Kollektionen von Bekanntem (scaurus)...
Das Schöne ist: Man findet ziemlich direkt nebeneinander her kalkliebende wie säureliebende Arten. Die Kalkarten freilich vorwiegend entlang der Wege, aber ich vermute nach wie vor, daß da stellenweise auch im Berg selbst basische Gesteine eingelagert sind.
Kritik und sämtliche weiteren Einlassungen erwünscht. 
LG; Pablo.


