Hallo, Freunde der Pilzwelt!
An dem kleinen Haselnuss-Ästchen, das ich vor einigen Tagen mit nach Hause genommen hatte, lässt sich allerhand Pilziges finden.
Der Ast befand sich ursprünglich auf etwa 1m Höhe über dem Boden an einem umgestürtzen Haselbusch-Stamm am Waldrand.
Der Ast ist entrindet und sichtbar von Hysterium angustatum bevölkert (hier!), deswegen hatte ich ihn vor ein paar Tagen abgebrochen und zur Analyse eingesteckt.
Bei der Inspektion zuhause entdeckte ich neben den Hysterium-Fruchtkörpen u.a. winzige, runde Fruchtkörper ohne erkennbaren Stiel.
Die Fruchtkörper wirken fein warzig, am Rand und auf der Oberfläche.
Seine Färbung ist hellbraun/rosa; er wirkt transluzend.
Randhaare scheinen die Fruchtkörper nicht aufzuweisen.

Bild 1 Durchscheinende Fruchtkörper auf Haselholz, Durchmesser des Werkzeugs rechts an der Spitze etwa 120µm
Pfückt man ein Früchtlein und dreht es um, ist ein sehr kurzes Stielchen erkennbar.
Die Probe(n) wurde aus einem Bereich mit umgebenden brauen Fremdhyphen herausgelöst:

Bild 2 Fruchtkörper mit Nadel gelöst und gedreht - ev. ist ein kurzes Stielchen auf der Unterseite vorhanden
Zerquetscht in Wasser ist der Fruchtkörper nahezu farblos:

Bild 3 Fruchtkörper zerquetscht in Wasser, mit etwas braunem Fremdmaterial
Die Hyphen und Asci scheinen in einer wachsartigen Masse eingebettet zu sein

Bild 4 item
Die achtsporigen, keulenförmigen Schläuche sind etwa 50µm lang und 10µm dick.
An der Basis befinden sich Haken.
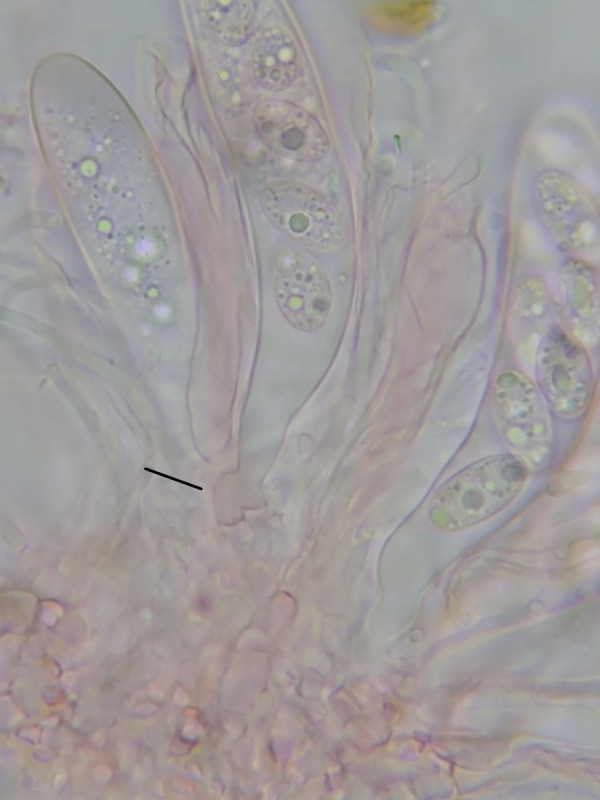
Bild 5 Ascus mit Haken, hier in Kongorot
Die Ascuswandung wirkt mal glatt, mal durch die Sporen beulig deformiert.

Bild 6 Schläuche mit unterschiedlich entwickelten Sporen im Inneren (in Wasser)
Die Sporenabmessungen betragen etwa (10,5)10,4-11,5-12,6(14,0) x (5,5)5,4-5,8-6,1(6,0) µm².
Die reifen Sporen (vermutlich links) sind mehr oder minder deutlich septiert
Gelegentlich ist die Septierung auch im (früheren?) Stadium mit den Tröpfchen erkennbar.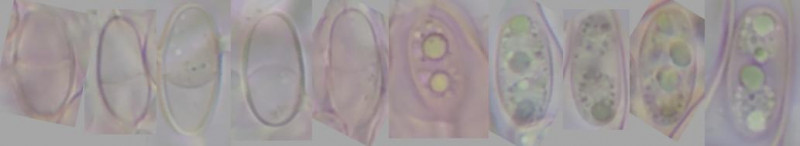
Bild 7 Sporen in Kongorot mit erkennbarer einfacher Septierung (links) und mit Tröpfchen (rechts)
Eine Spore wurde beim Kemen erwischt:

Bild 8 Frei schwimmende, septierte Spore, doppelt auskeimend?
Die Schläuche und und insbesondere die Sporen in den Schläuchen färben sich in Lugol kräftig gelb.
Alle Strukturen sind aber inamyloid.

Bild 9 Quetschpräparat nach Einziehen von Lugol
Die dicke Ascuswandung ist nun gut erkennbar (im Bild unten besonders bei dem unreifen Ascus).
Die Sporen sind eventuell dextrinoid, da bereichsweise orangebraun eingefärbt.
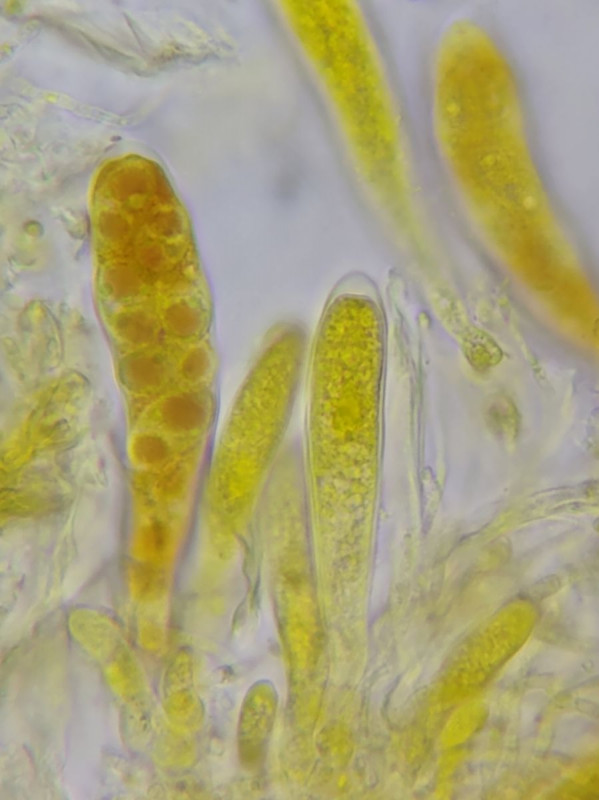
Bild 10 In Lugol gefärbte Asci und Sporen, die dicke Ascusspitze bleibt ungefärbt
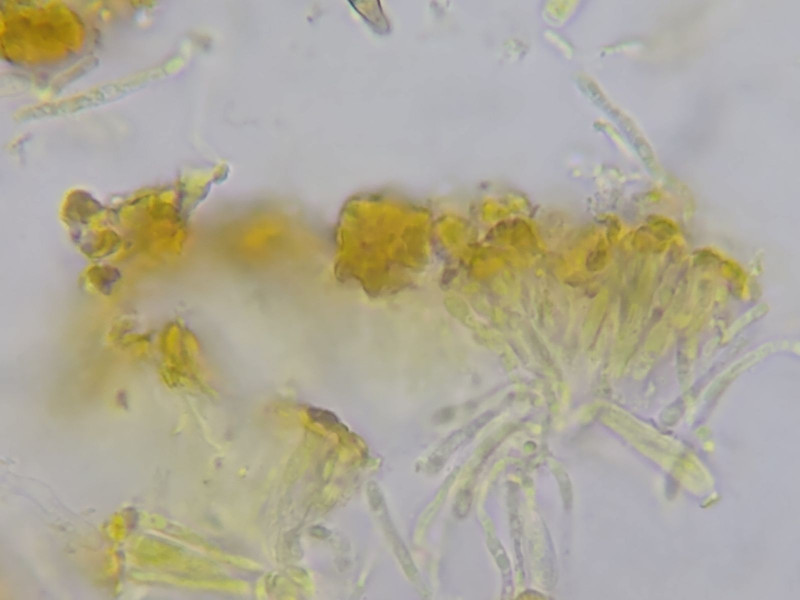
Bild 11 Paraphysen-Enden in wachsartiger Masse verklebt (Lugol)
Es lassen sich Bereiche mit rundlichen Zellen finden:
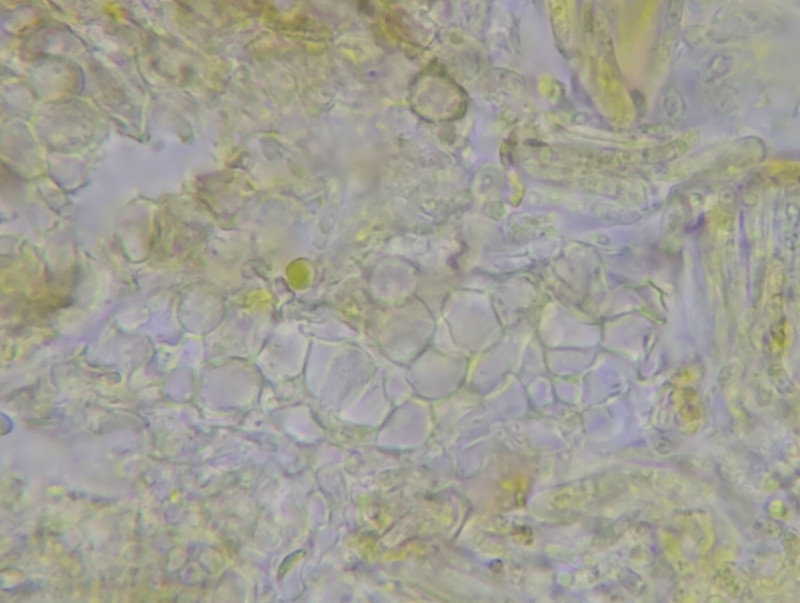
Bild 12 Rundliche Zellen (=Peridium?)
Die Zellwände der Asci und Sporen sind ferner cyanphil:
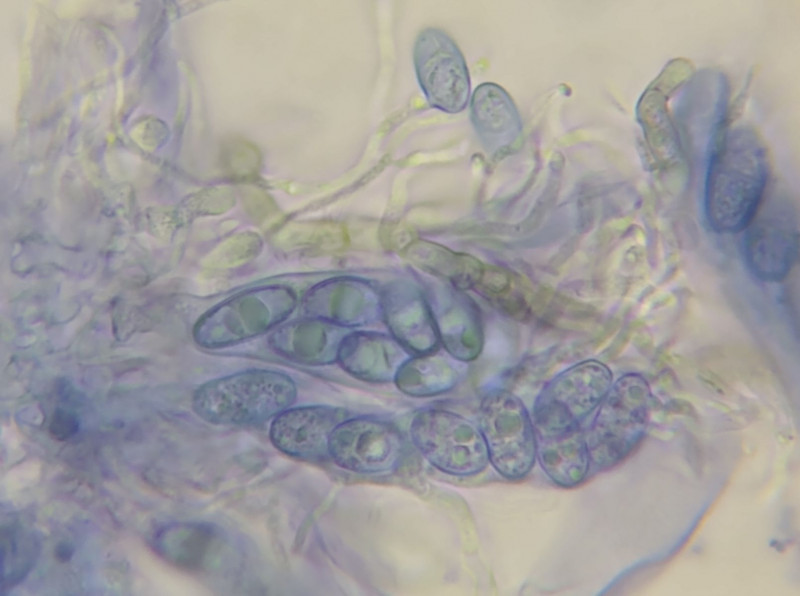
Bild 13 Quetschpräparat nach (kalter) BWB-Behandlung und Spülen mit Wasser
Ob es sich hier um operculate, inoperculate oder bitunicate oder sonstwas für Asci handelt, kann ich leider nicht erkennen - keine Ahnung!
Das ist aber mitentscheidend für die Bestimmung.
Hat jemand einen Tipp für mich, wie man diese Ascuseigenschaft erkennt / bestimmt, wenn keine leeren Schläuche mit aufgerissenem Deckel oder runtergeschobener äußerer Hülle zu finden sind? 
Durch Vergleichen meine ich, dass eventuell etwas wie Coprotus hier passen könnte - dann müssten die Asci allerdings operculat sein - aber sind sie das hier???
Ich stecke an dier Stelle leider fest!
Erbarmt sich jemand und gibt mir bitte eine Tipp, wo ich weitersuchen kann?
Zumindest die Klärung des Ascus-Typs könnte vielleicht schon helfen.
Dann könnte ich mich des nächsten Pilzes auf meinem Haselnussästchen annehmen (ich habe schon eine ziemlich sichere Vermutung).
Das kleine Ast hat sich als äußerst ergiebig herausgestellt! 
LG, Martin
![]()
![]()


