Hallo,
nach zwei Nachmittagen Irrungen und Wirrungen hoffe auf Hilfe bei der Bestimmung einer orange-früchtigen Caloplaca, denn sie reagiert C+ rot im Epihymenium, was sie aber vermutlich nicht sollte...
Zum Fund:
Gefunden in mitten in Berlin-Adlershof neben dem Großen Windkanal an lichtreich stehendem Pappel-Stumpf.

Bild 0 Fundort
Auf der Borke eine Flechtengemeinschaft aus Xanthoria parietina, Physcia adscendens, Phaeophyscia orbicularis, Lecidella spec (unbestimmt) und verm anderer gelbfrüchtiger Caloplaca spec (unbestimmt, nicht in Bild 1).

Bild 1 Blick auf Borkenstück vor Ort bei Tageslicht mit deutlich orange-früchtiger Caloplaca

Bild 2 Lupenbild in Kunstlicht: Ältere, gedrängt stehende, unförmige, sich überwachsende, gewölbte FK (bis >= 1mm Durchmesser)
und junge FK mit deutlich erhabenem, etwas hellerem Rand

Bild 3 Trockener Thallus zwischen den Apothecien gefeldert, unscheinbar weißlich-grau, dickere Stellen gelblich.

Bild 4a FK seitlich mit gelblichem Rand, Thallus weißlich mit etwas dickeren, gelblichen Inseln (= Ap.-Initiale?)

Bild 4b Weitere FK mit scheibenfarbigem Eigenrand und weißlich-gelblichem Thallusrand
Algen auch trocken hindurchschimmernd

Bild 4c Apothecien nochmals von Seite

Bild 5 Apothecien nass - Thallusrand mit durchschimmernden Algen

Bild 6a Apothecienrand und -scheibe (Bildeinsatz oben links) K+ purpur, Thallus stellenweise K+ purpur (gelbe Inselchen reagieren)

Bild 6b Andere Stelle ebenfalls K+ purpur an vormals gelblichen Thallusstellen
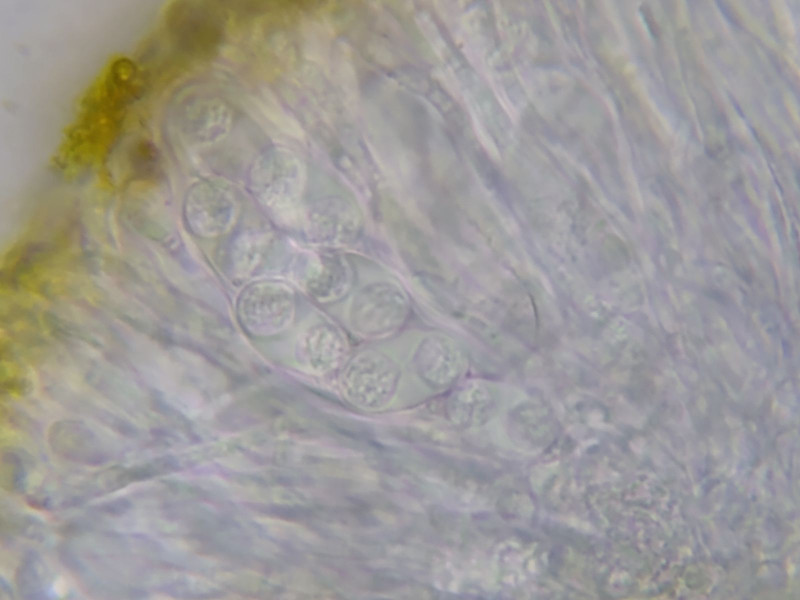
Bild 7 Hymenium in Wasser mit orange-gelbem Epihymenium,
Asci (4)8-sporig, Sporen 13,0-14,0-16,0 x 6,5-7,5-8,2 µm,
Septum 4,5-6,0-7,0 µm,
Sporenwand nicht auffällig dick.
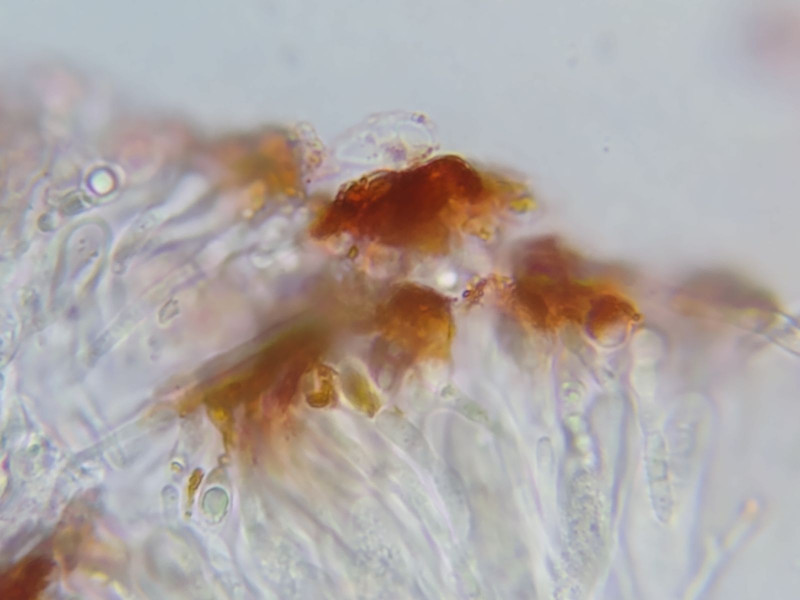
Bild 8 Epihymenium VERMEINTLICH C+ orange-rot bis rot (!) vgl. Originalzustand in Wasser in Bild 7.
Tatsächlich scheint der verwendete Rohrreiniger nicht mehr für Farbreaktion zu gebrauchen zu sein, da er entweder kontaminiert oder gealtert ist.
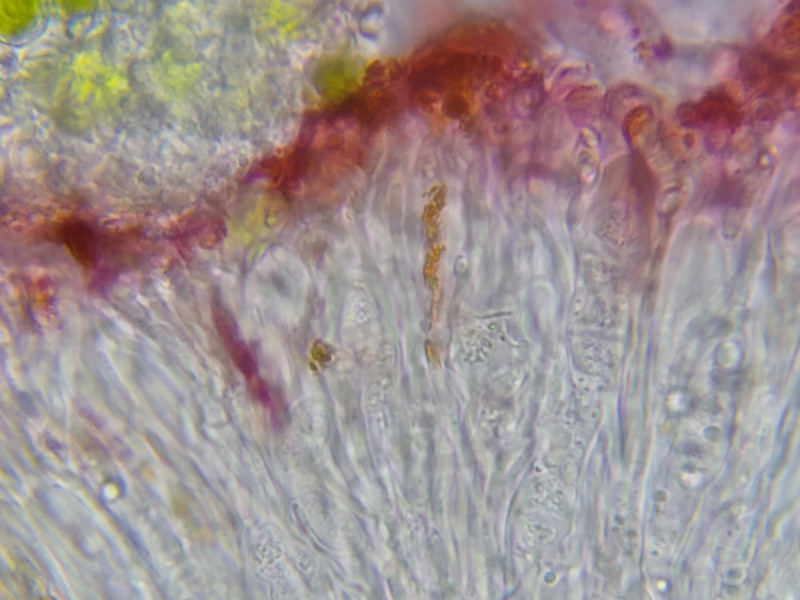
Bild 9 Epihymenium K+ purpur (nirgends blau)

Bild 10 Apothecienschnitt; Excipulum proprium Breite um 45 µm, Excipulum thallinum um 40 µm
Mit dem Schlüssel in DFD für Caloplaca, TS2 (Substrat Rinde/Holz) komme ich über
1* Th. nicht isidiös/sorediös
19* Ap. K+ purpurn
20* Ap.rand zeorin/biatorin gelb, orange, ...
24 Thallus gelb .. graugelb, K+ rot, Ap. mit orange/gelb gefärbtem Rand
25* Th. nicht rosettig, gelappt
26 Ap. C+, groß (1-2 mm), tief orange bis rötlich, jung mit blassgelbem Thallusrand, ... zu Gyalolechia flavorubescens (?).
Geheuer ist mir diese Bestimmung gar nicht, sie fußt hauptsächlich auf C+ rot und führt zu einer ex. seltenen Flechte, die zwar hauptsächlich auf Pappelrinde vorkommen soll, aber in humider Lage, und als anitrophil bis max. mäßig nitrophil gilt - das passt mMn gar nicht zu Berlin - weder von der Feuchtigkeit her, noch von der Stickstoffbelastung.
Die Flechtenfotos zeigen Exemplare mit deutlich gelbem Thallus, was ebenfalls nicht passt.
Irgendwo habe ich gelesen, dass der Ap.rand bei ältere FK unverändert deutlich bleibt, passt auch nicht!
Biegt ich im letzten Schritt das Schlüssels allerdings anders ab, gelangt man über
26* Ap. C-!
zu:
27 Gelber Th., reduziert auf kleine Flecken um Ap., sonst Th. grau und sehr dünn; Ap 0,3-1,0mm, orange-gelborange, mit deutlichem weißlich-gelblichem Th.rand; gewöhnlich nicht gedrängt; Exc. prop. 35-70µm, Exc. th. 50-80µm. => Caloplaca/Athallia pyracea.
Das passt alles wirklich gut bis sehr gut zum Fund, nur die Beobachtung C+ rot will nicht passen!
Auch die Art-Beschreibung zu Athallia pyracea empfinde ich als überaus passend:
An Allee- und Straßenbäumen, auf Rindenstegen (!) von Populus (!), ziemlich nitrophil (passt besser zu Berlin!), mäß.- sehr photophil (Stammbereich 1m über Boden an alleinstehendem, hochastigem Baum, jetzt Stubben!), im Xantherion parietinum (!).
Hautpsächlich in kalkreichen und luftreinen Gebieten.
Selbst die Abbildungen in Büchern (Thallus mit kleine gelben Inseln) passen wie die Faust aufs Auge, aber:
Den Test mit C habe ich insgesamt vier Mal durchgeführt, 3 davon unter dem Deckglas.
in Kontamination meines Rohrreiniger-Tröpfelfläschchens schließe ich eigentlich aus. (Edit: Genau das ist aber tatsächlich hier der Fall! Also C- A. pyracea)
Darf das Epihymenium von Athallia pyracea auf C+ rot reagieren?
Weiß jemand dazu etwas?
Sonst würde ja alles gut passen...
VG, Martin
![]()


