Hallo liebe Pilzgemeinde,
während es in den höheren Lagen bereits überall zugeschneit ist, sind am Rhein nach wie vor milde Temperaturen.
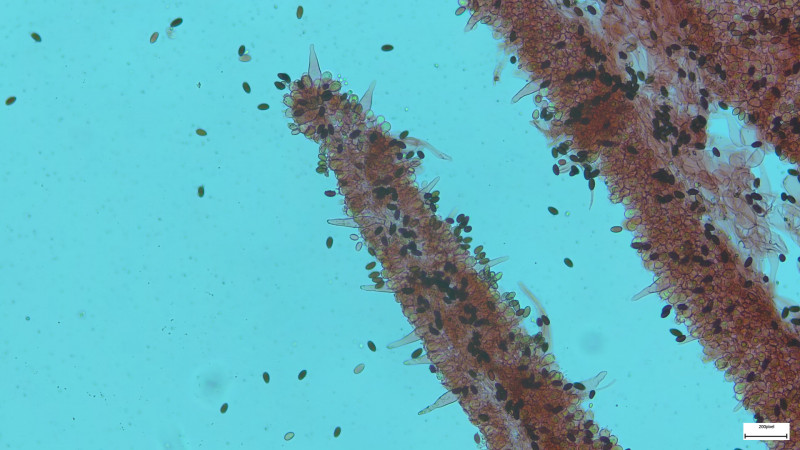
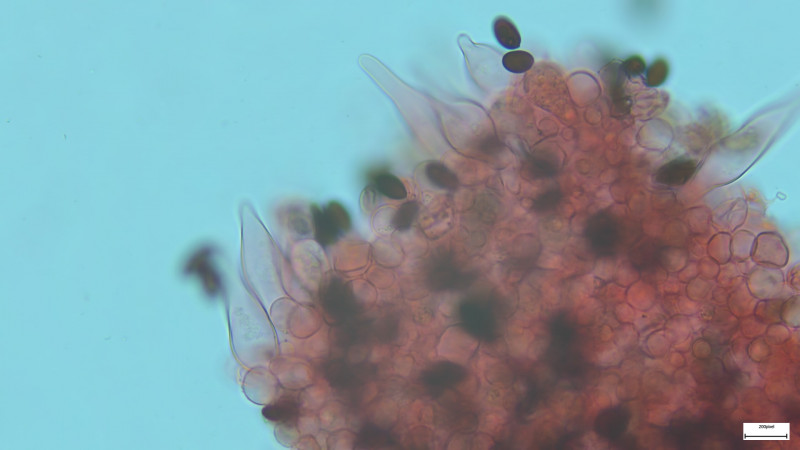
Gestern auf einem kleinen Spaziergang dann großes Erstaunen als ich zahlreiche Fruchtkörper von Helvella crispa fand:



Es gab aber auch noch ein paar Hausaufgaben. Um eine Eibe herum fand ich deutlich purpurne Psathyrellen. Insgesamt standen hier aber noch zahlreiche andere, insbesondere Laubbäume wie Buchen und Ahorn (Stadtpark):
Es sollte sich um Psathyrella bipellis handeln (erstaunlich, da bei Ludwig angegeben wird "wahrscheinlich thermophil").
Wegweisend waren schon die deutlich purpurnen Farben der Hüte und auch die purpur-rosalichen Stiele.
Hüte ca. 3-4cm. Deutlich durchscheinend gestreift und gerunzelt. Hygrophan, ausblassende Mitte mit gelblichen Farben.
Lamellen dunkel (auch Richtung purpur) mit hellen/weißen Schneiden, Schneiden ohne rötliche Töne.






Mikroskopie:
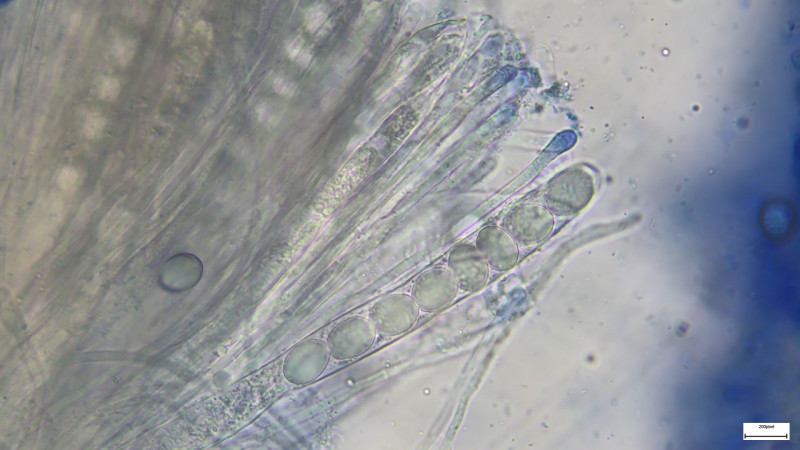
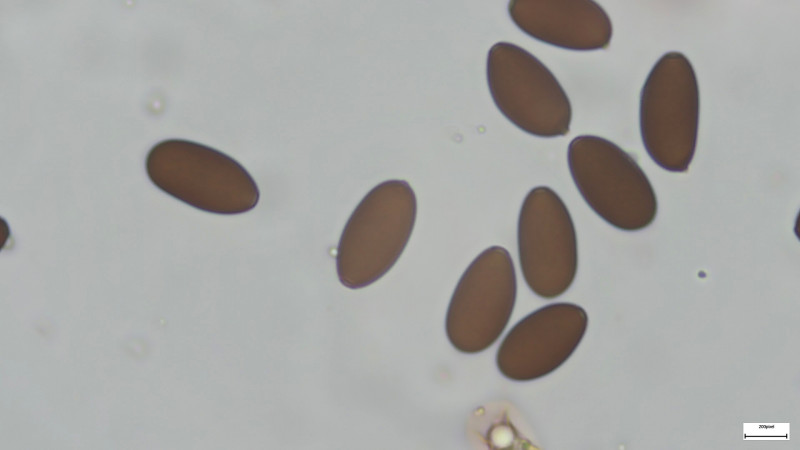
Basidien 4-sporig (siehe Bilder). Sporen 14-15µmx7,5µm, dunkelbraun, deutlicher KP ca. 1,8µm
Cheilozystiden und Pleurozystiden fusiform (nur selten oder einzeln andere Formen, z.B. mit Kopf), dünnwandig, Pleuros ca. 75µm
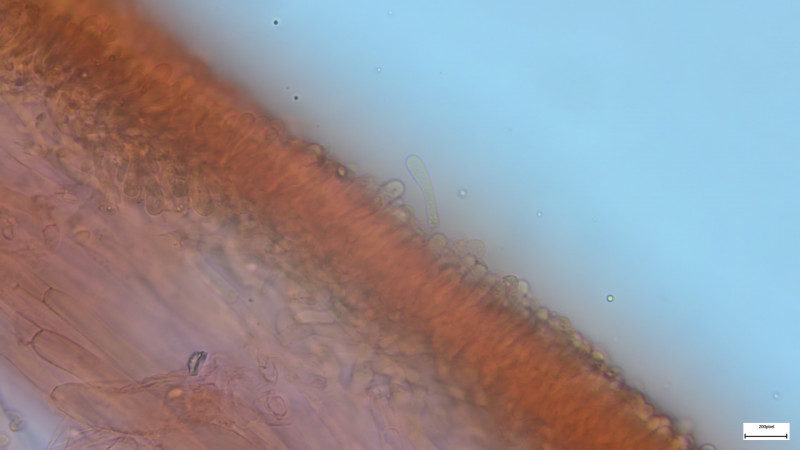
HDS kugelige Zellen
Übersicht 100-fach in Kongorot
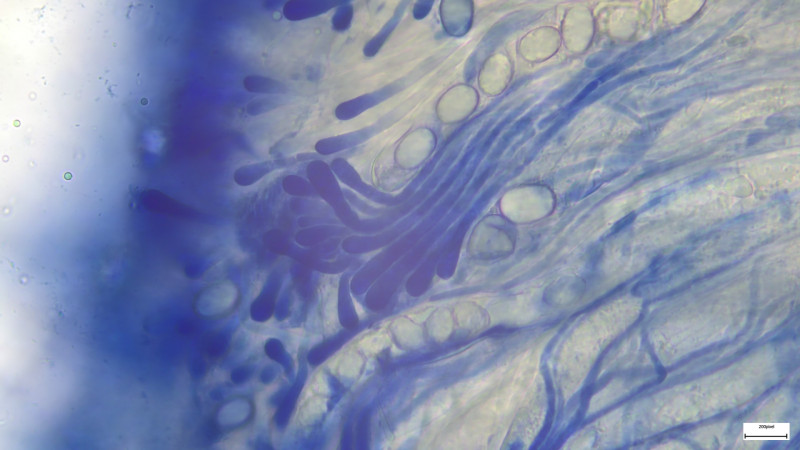
Cheilos 400fach in Kongorot
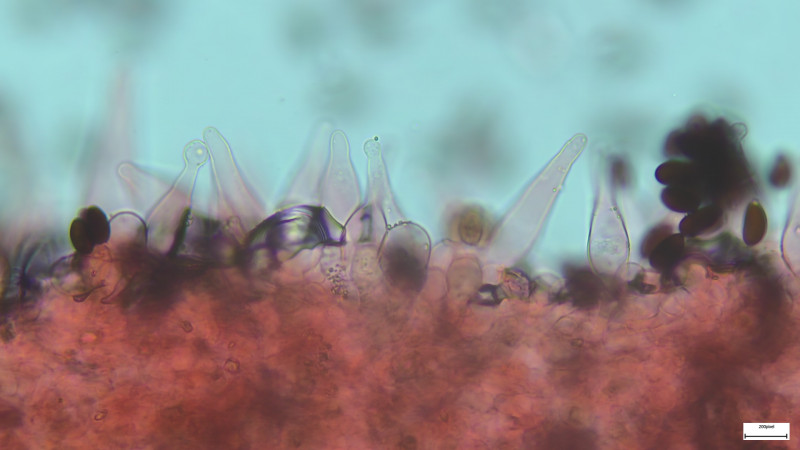
Cheilos 400-fach in Wasser mit ballonförmiger Parazystide
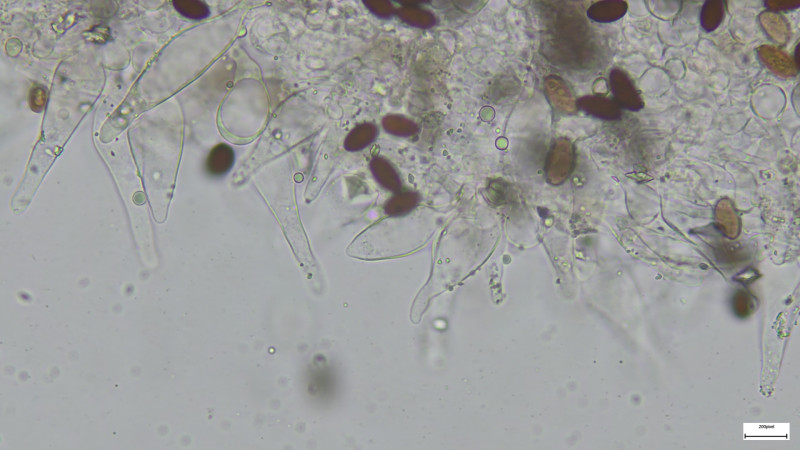
Pleuros und Basidien 400fach in Kongorot
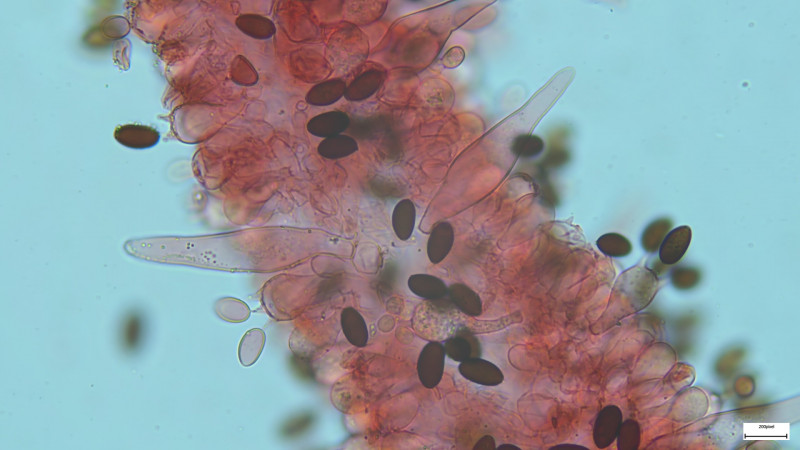
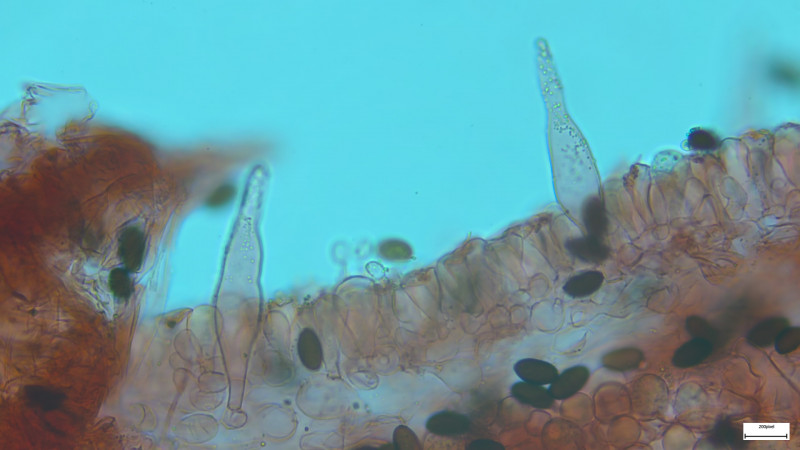
In Wasser zeigen sich die Pleurozystiden in der Spitze häufig gefüllt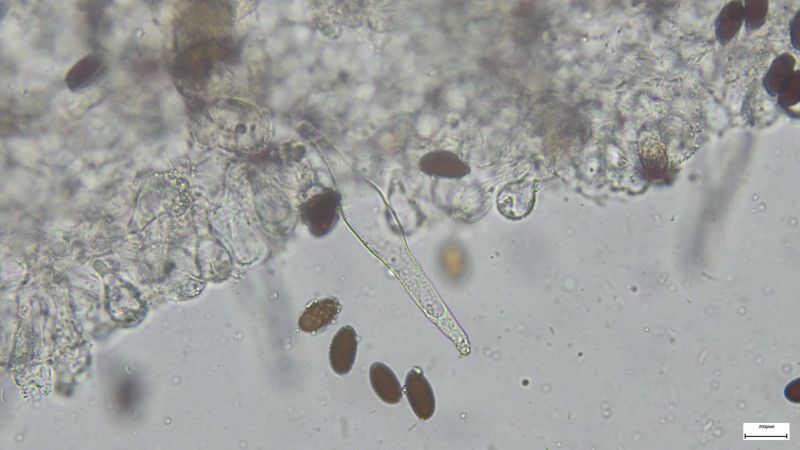
1000-fach in Kongorot
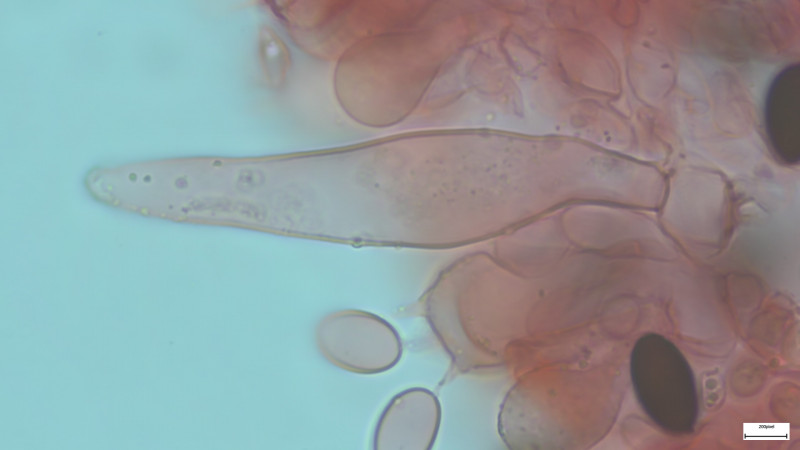
Sporen 1000-fach in H2O:
HDS und Schnallen in Trama:


Außerdem noch ein Rätsel an dem ich mir leider sehr die Zähne ausbeiße. Ein kleiner Weißer, mit ockerfarbenen Lamellen und einem gaaanz deutlichen Mehlgeruch, sehr gut wahrnehmbar, trotz der Kälte.
Gesellig wachsend unter Buchen, in der Nähe auch Birken. Es standen da aber auch noch andere, für mich nicht zu identifizierende Gehölze. Sie auch die länglich gezackten Laubblätter auf den Bildern. Die Pilze wuchsen jedenfalls definitiv saphrophytisch auf den Blättern. Sie wuchsen sehr gesellig. Es waren zahlreiche kleine Fruchtkörper zu finden, im Schnitt 1,5cm große Hüte, nur vereinzelt etwas größer, viele jüngere Stadien.
Hutfarben wirkten so bleigrau-weiß und überfasert. Stiele ebenso weiß überfasert.
Lamellen ins ockerfarbene, deutlicher am Exsikkat.
Basidien 4-sporig: Sporen: 6x3,5µm, ovoid, mit Öltropfen (leider gaben mehrere Hüten keinen rechten Sporenabwurf her). Basidien auch auf Schneide.
Schnallen definitiv vorhanden
Keinerlei Cheilo- oder Pleurozystiden aufzufinden.
HDS mit hyphigen senkrechten Zellen (=Trichoderm?)
Dachte erst an Clitopilus, aber da sollten die Sporen Längsgrate besitzen und ausserdem haben die wohl regelhaft keine Schnallen
Vielleicht habt ihr noch eine Idee ...
Habitus:



Sporen:
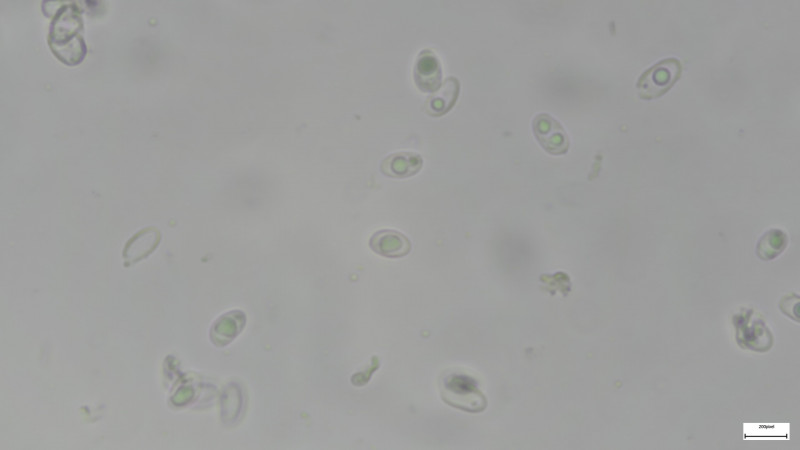
Schneiden in H2O
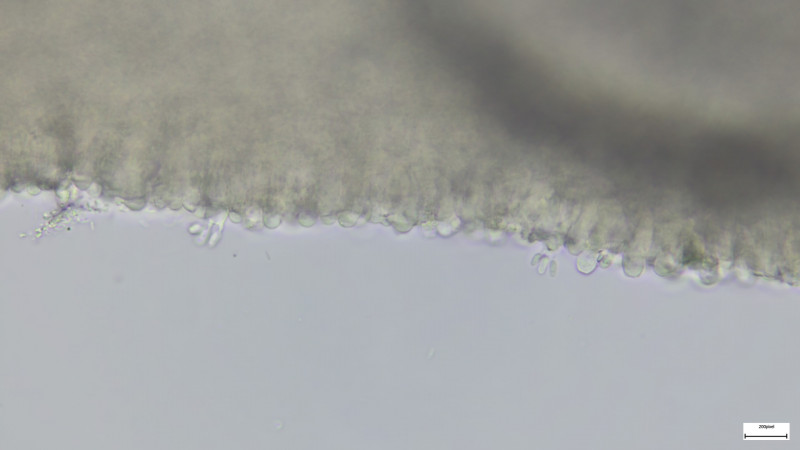
HDS
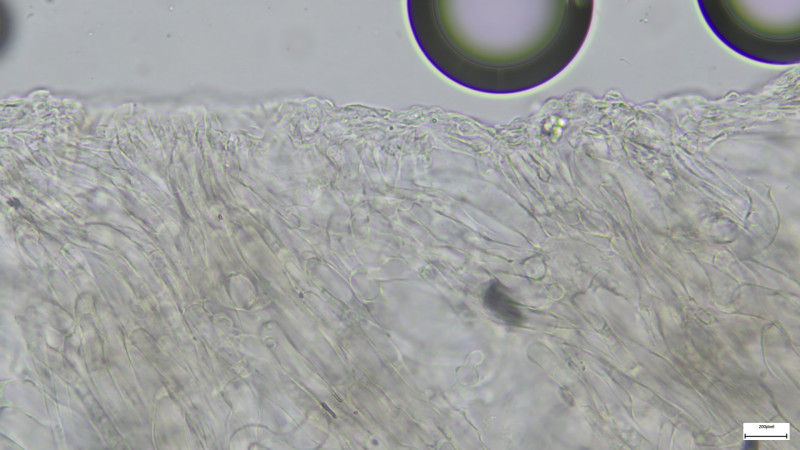
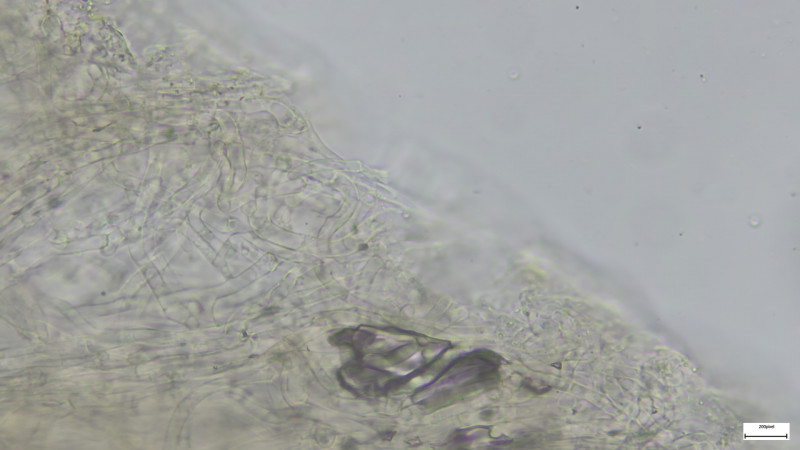

Schnallen
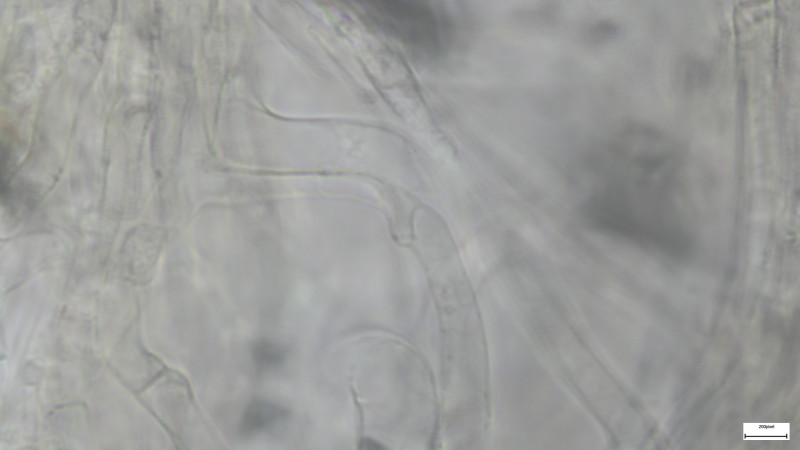
Lamellentrama und Basidiolen
Beste Grüße
Sebastian


