Hallo zusammen,
am letzten Donnerstag war ich ausnahmsweise mal wieder im Büro Office statt Home Office. Ich war gerade im Büro als das Telefon klingelte und ein Herr vom BUND sich meldete. Er kümmere sich mit der BUND Kreisgruppe Duisburg um das NSG Rheinaue Walsum und würde dort auch kartieren. Mit Pilzen habe er sich aber noch nicht eingehender beschäftigt, er sei jetzt aber über meine Homepage gestolpert und wolle wissen, ob ich Interesse hätte, mir das Gebiet mal aus mykologischer Perspektive anzuschauen. Gesagt, getan. Also trafen wir uns am Sonntag für eine Runde durch die Rheinaue. Aufgrund der Trockenheit der letzten Zeit fanden sich zwar nicht schrecklich viele Pilze, aber das eine oder andere Schmankerl gab es dann doch. Insgesamt ist die Rheinaue auf jeden Fall ein sehr interessantes Gebiet, mit einem 50-jährigen Silberweidenwald, einer Hartholzaue, Gebieten mit Erlen aber auch Hochstaudenfluren. Das war also hoffentlich nicht der letzte Pilzbesuch dort.
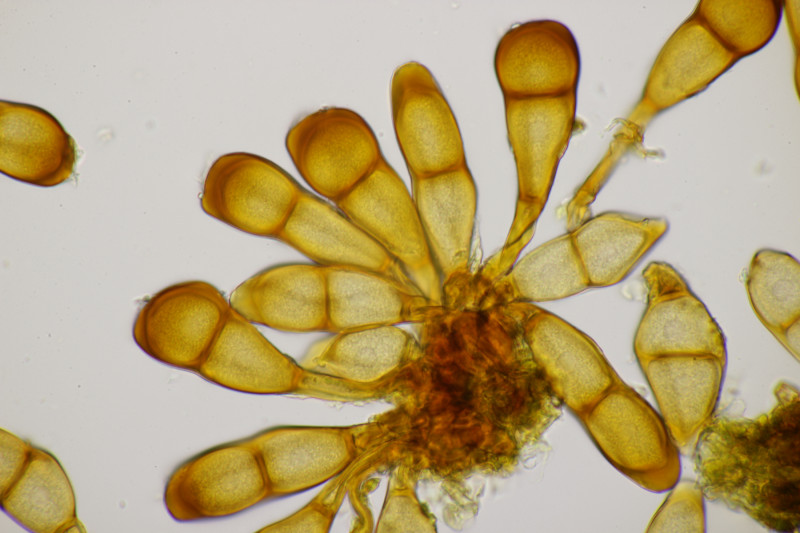
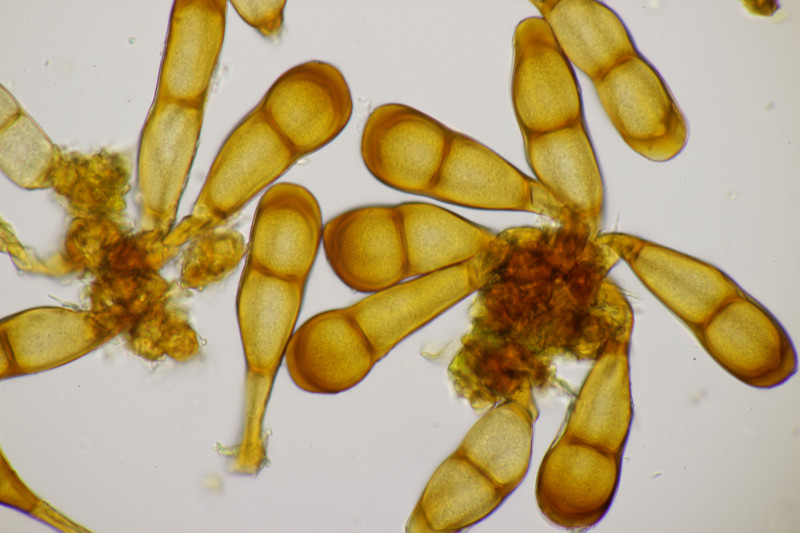
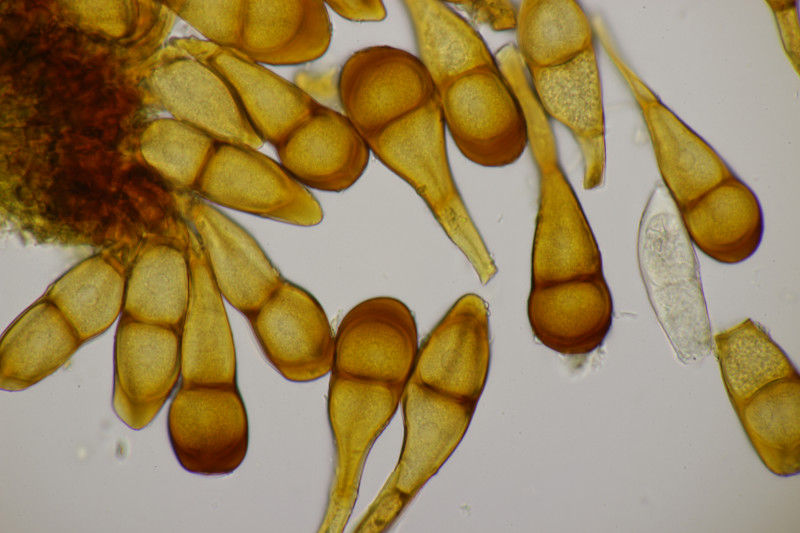
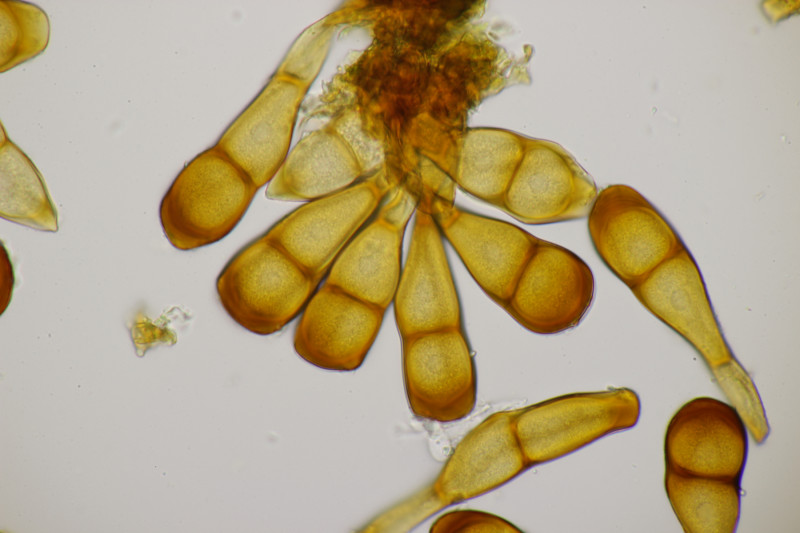
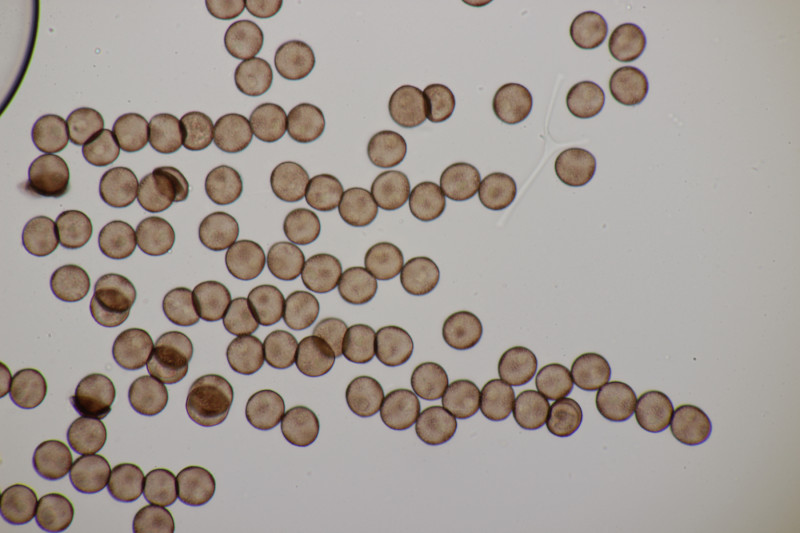
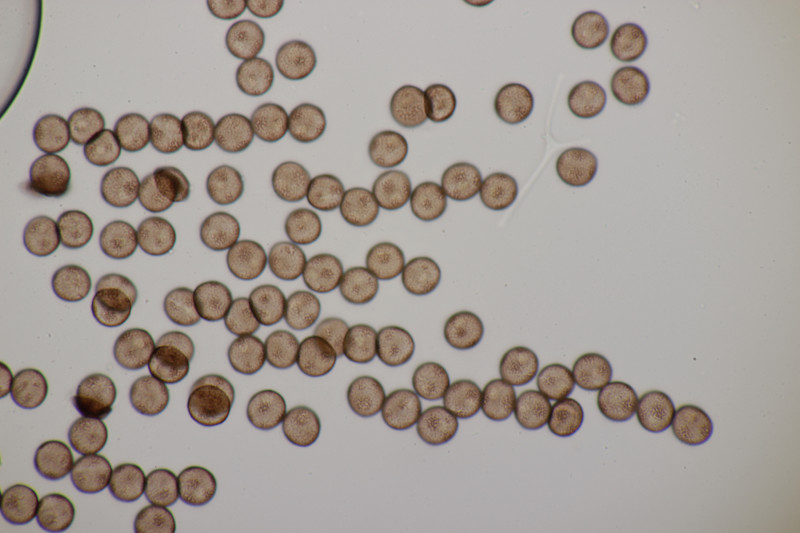
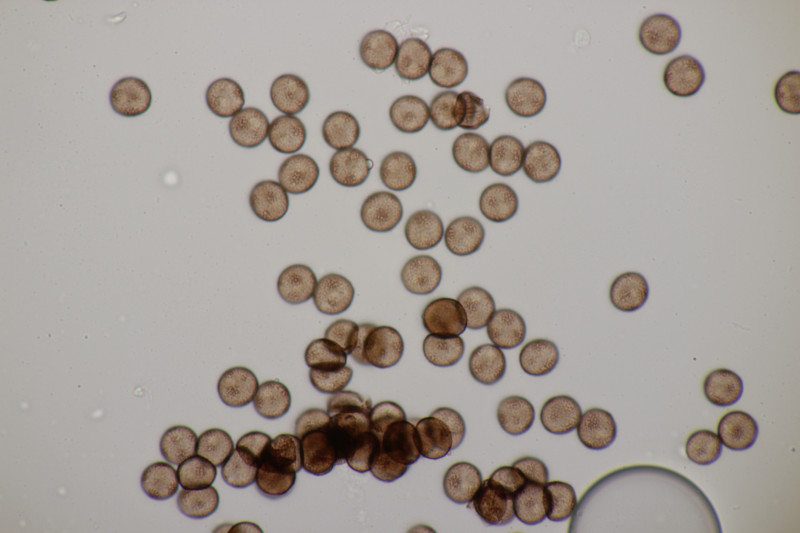
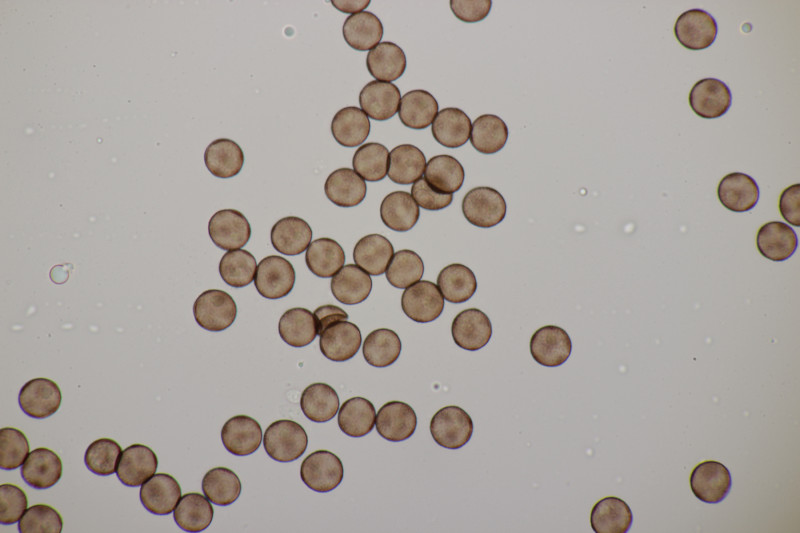
1. Eine Rosellinia auf Salix. Sporengröße (24.6+-1.2) µm x (7.4+-0.5) µm, Q=3.4+-0.3 bzw. (21.7-26.6) µm x (6.2-8.3) µm, Q=2.9-4.0. An den Sporenenden waren kleine, runde Gelgebilde zu finden. Filz war keiner zu sehen, aber der scheint im Alter ja durchaus auch verschwinden zu können bei einigen Arten. Hat jemand konkrete Ideen zu diesem Fund?

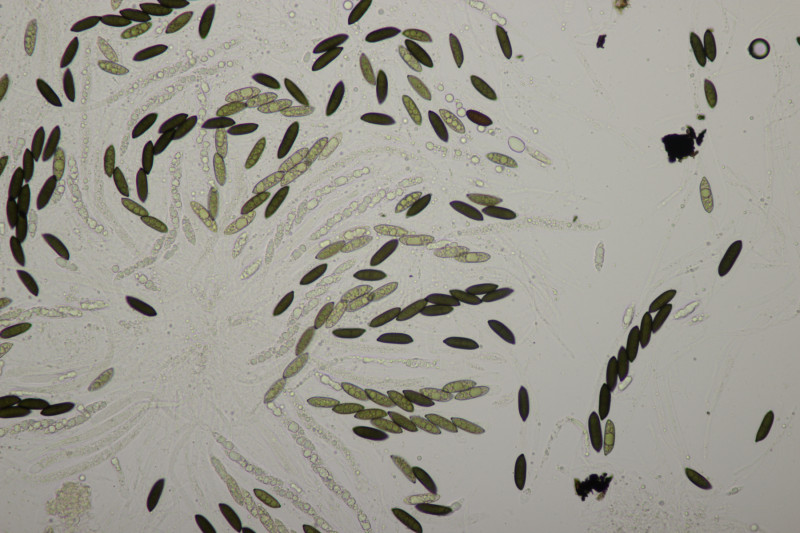

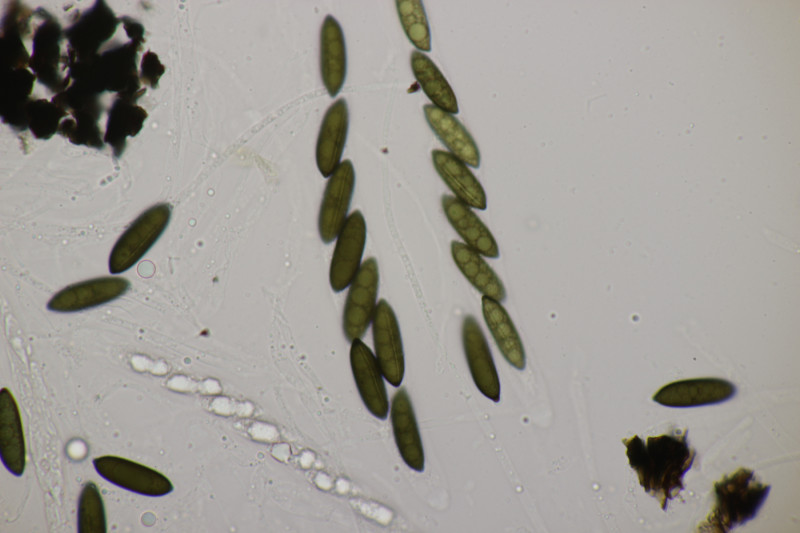
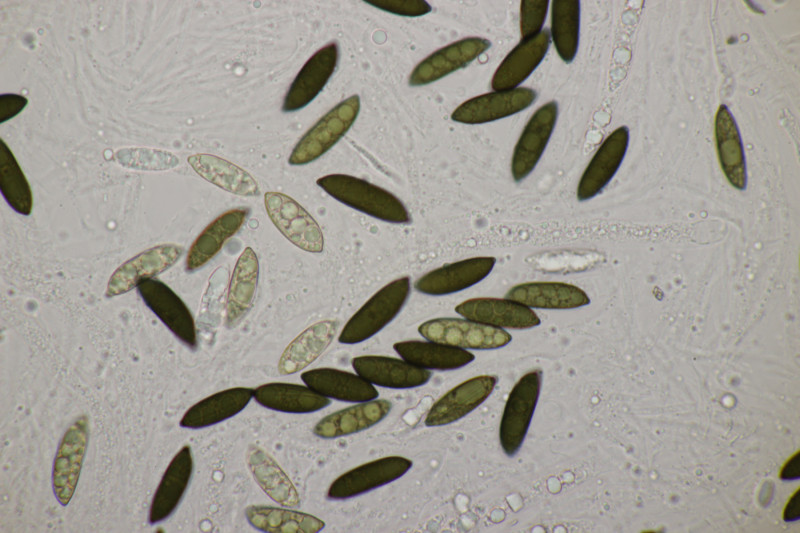
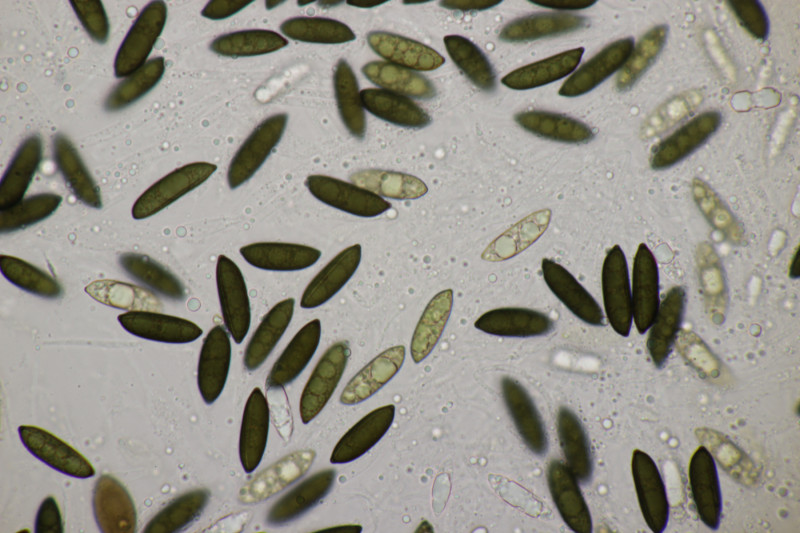
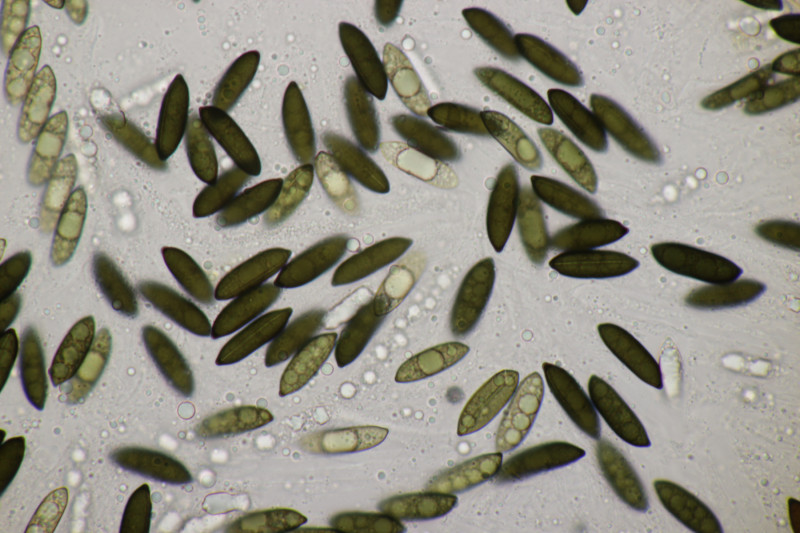

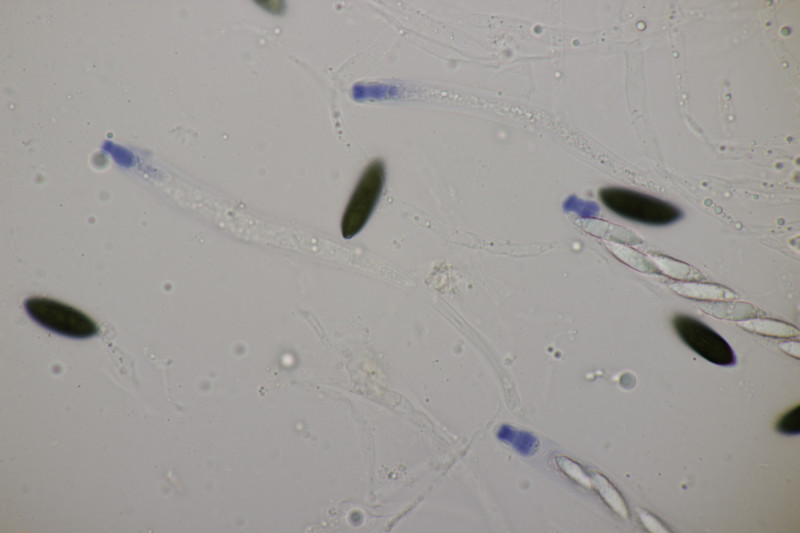

2. Ascocoryne cylichnium. Sporengröße (26.2+-1.6) µm x (6.1+-0.4) µm, Q=4.3+-0.5 bzw. (23.1-29.2) µm x (5.2-6.9) µm, Q=3.5-5.3



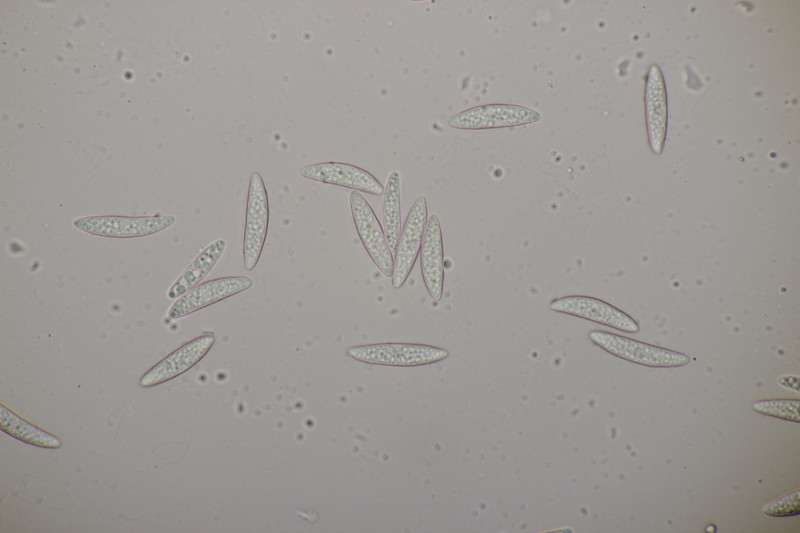
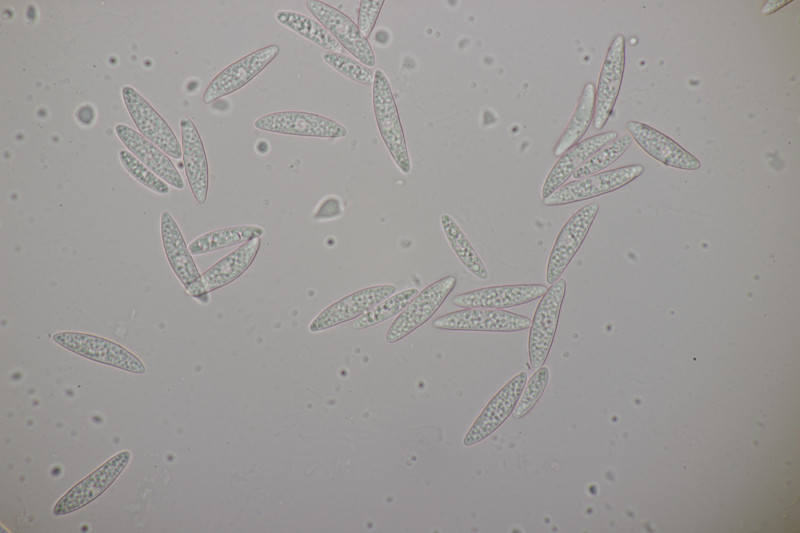
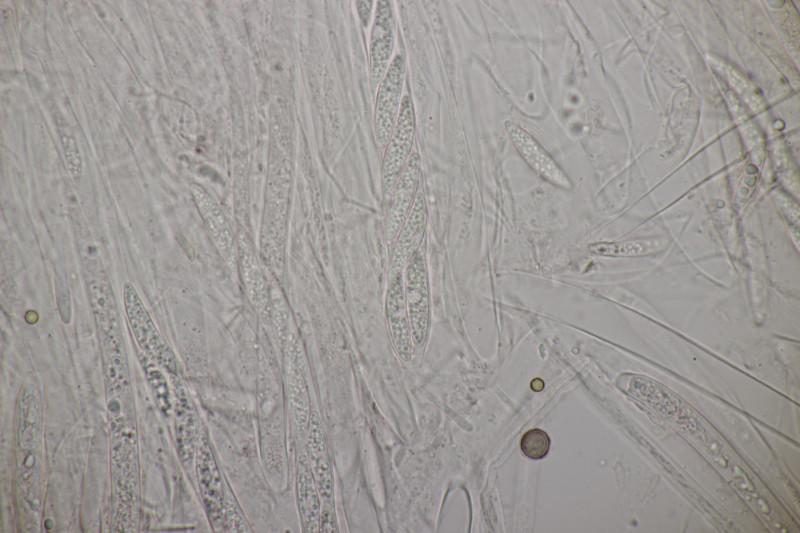
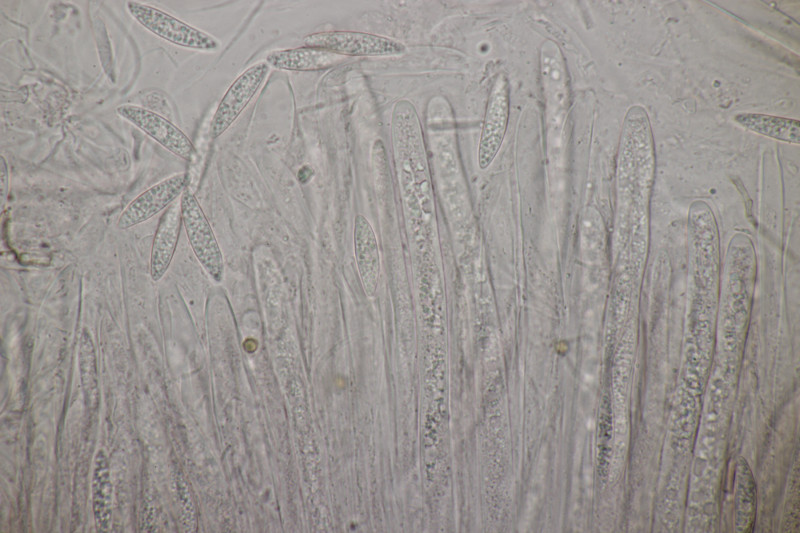

3. Auf Salix. Zwar ohne Kern, aber mit Sporen von (12.0+-0.9) µm x (4.6+-0.4) µm, Q=2.6+-0.3 bzw. (10.5-14.8) µm x (4.0-5.7) µm, Q=2.2-3.1 und den myxarioiden Basidien bleibt dann doch nichts anderes übrig: Myxarium nucleatum

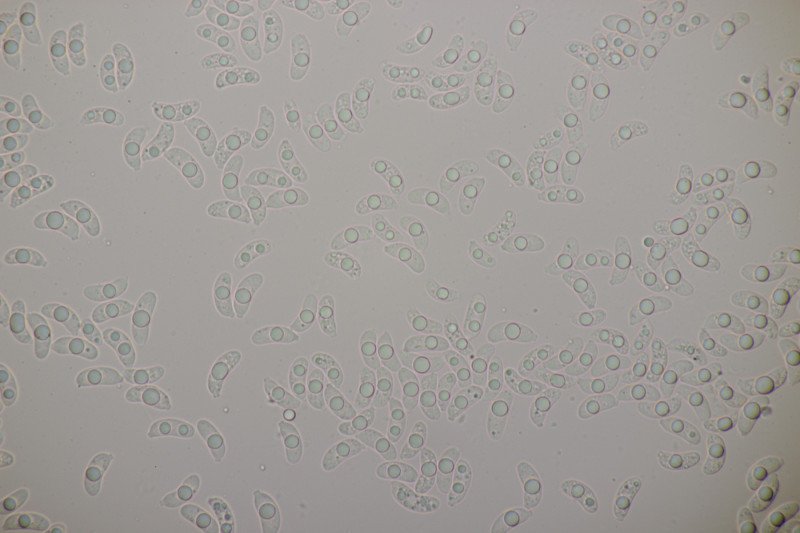

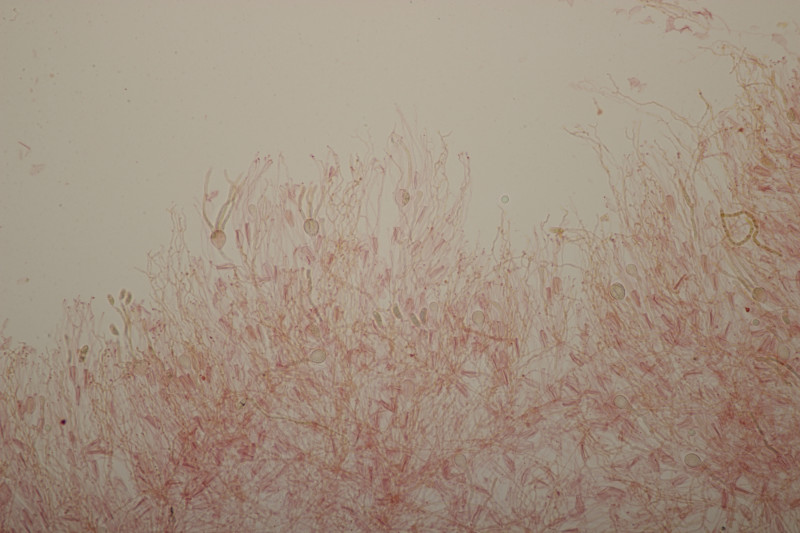
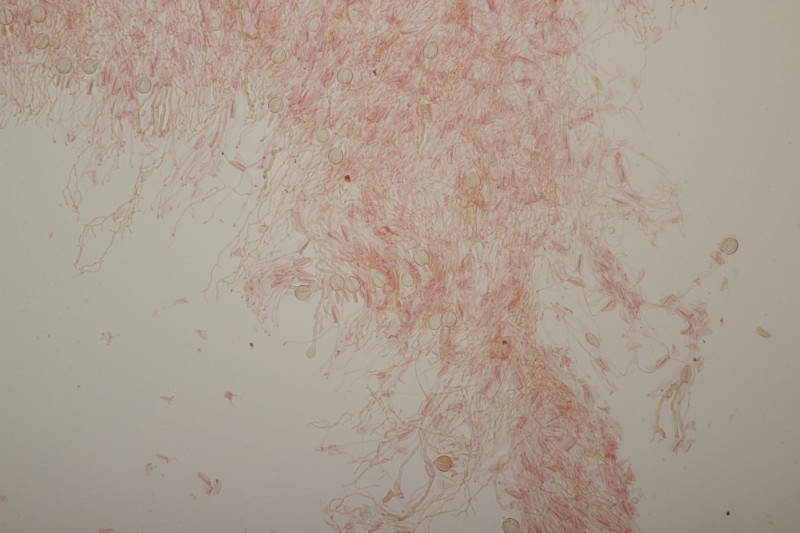
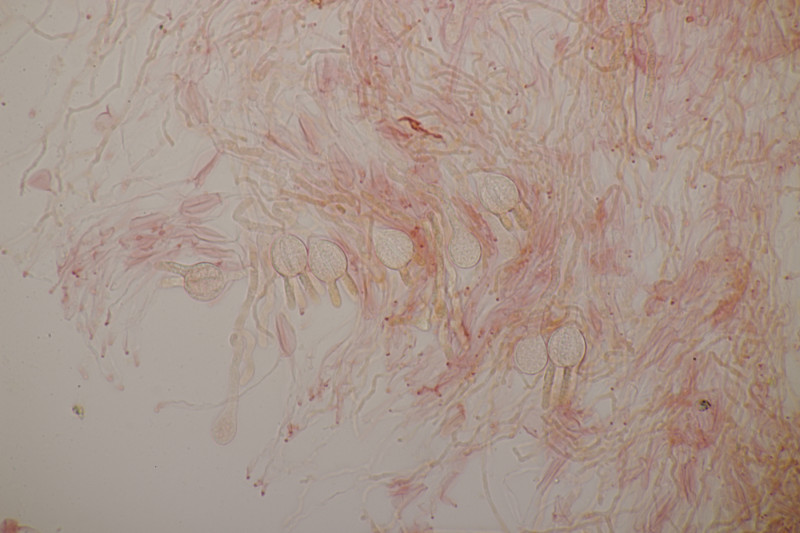
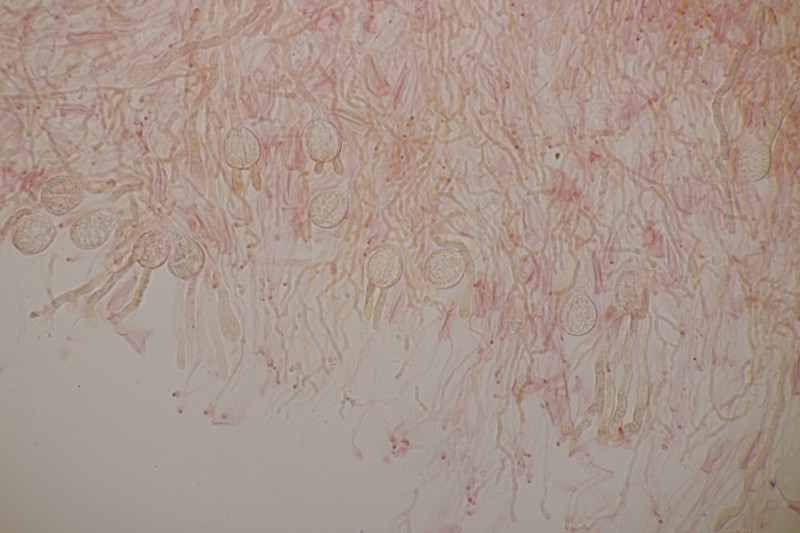
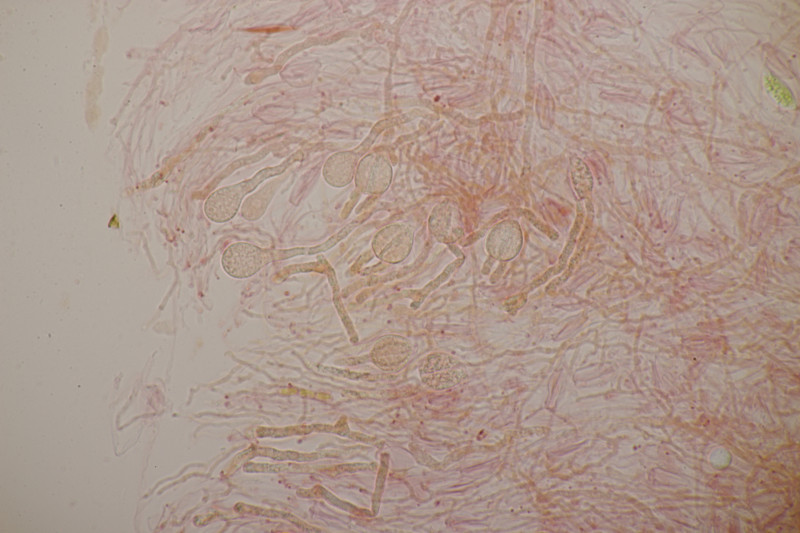
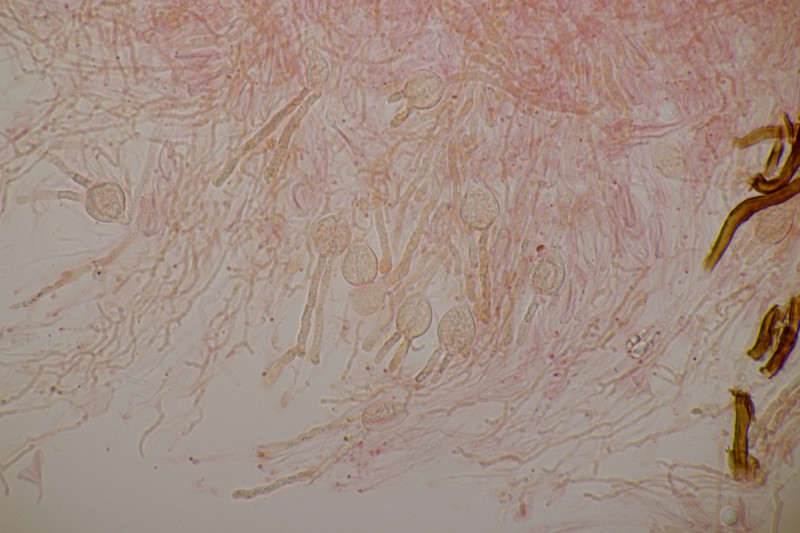
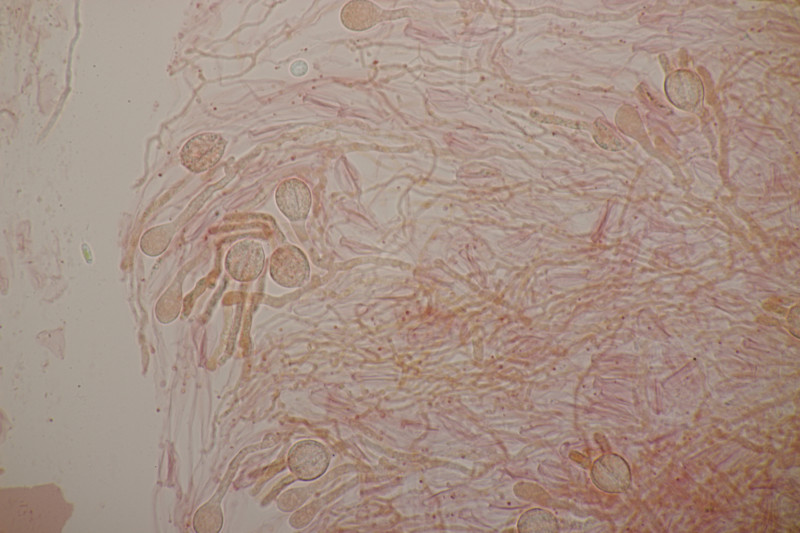

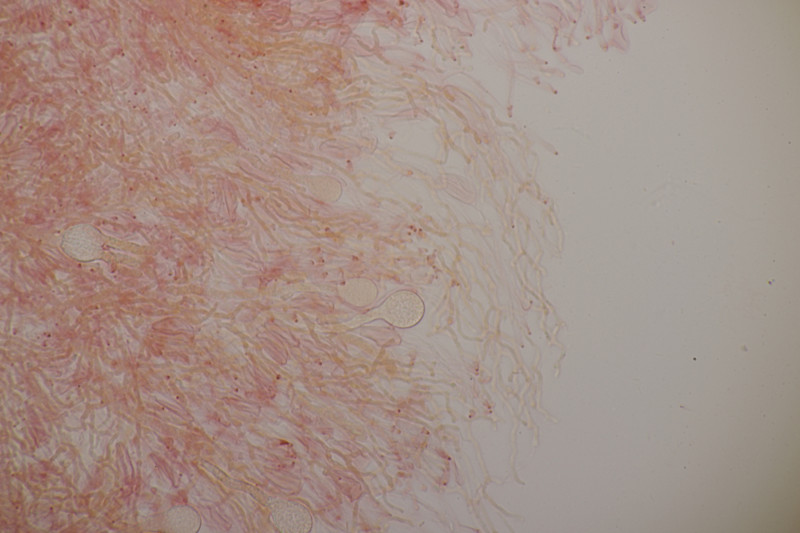
4. Trichia varia. Capillitium mit 1-2 Spiralleisten, Sporen (12.0+-0.8) µm bzw. (10.5-13.7) µm






5. Puccinia magnusiana ex Phragmites australis



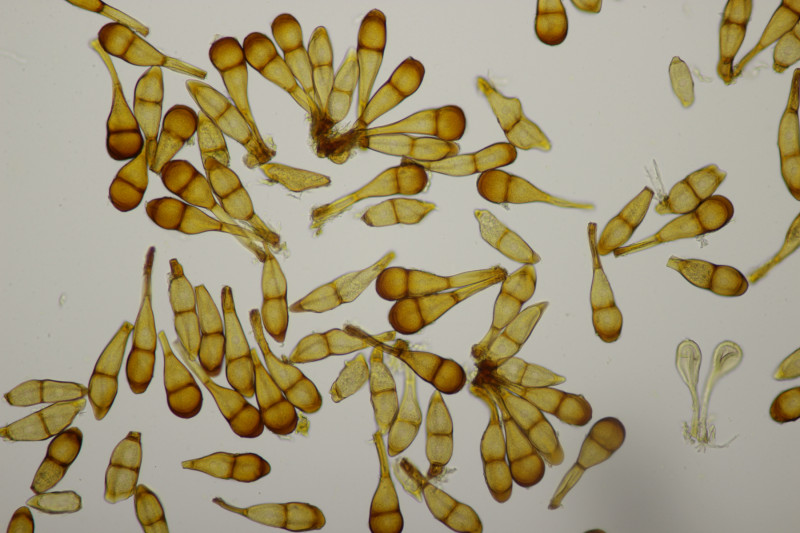



6. Unter Carpinus betulus: Lactarius circellatus


7. Ein Schleimpilz mit Sporen von (11.1+-0.5) µm bzw. (10.3-12.2) µm. Ich bin schon bei der Gattung unschlüssig...


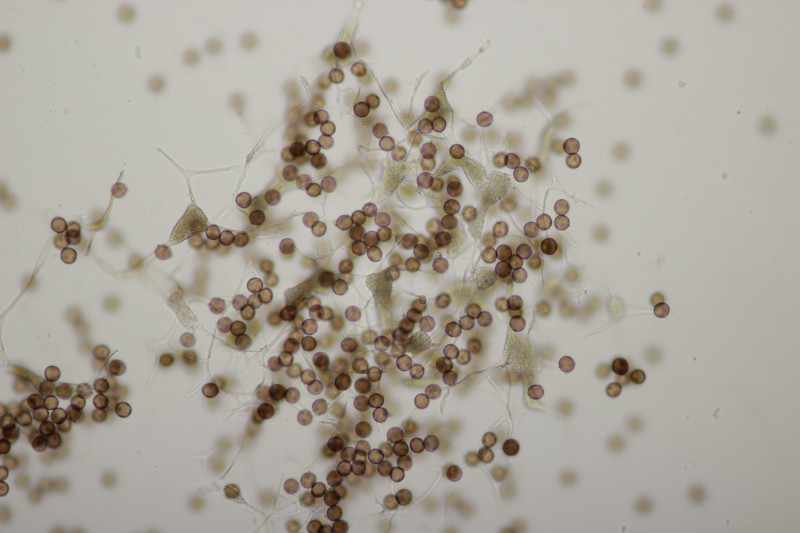
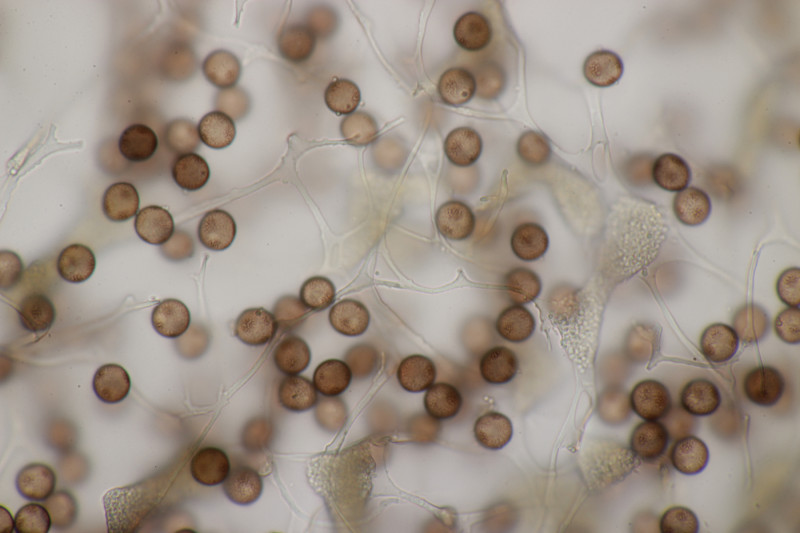

8. Unter Erlen fanden wir dann auf Erlenzapfen kleine, weiße Becher. Leider sind die beim Herumreichen auf den Boden gefallen und waren weg. Ich wollte also gerade nach neuen Zapfen suchen, als sich an Gras diese gelbe Schönheit fande: Calyptella campanula



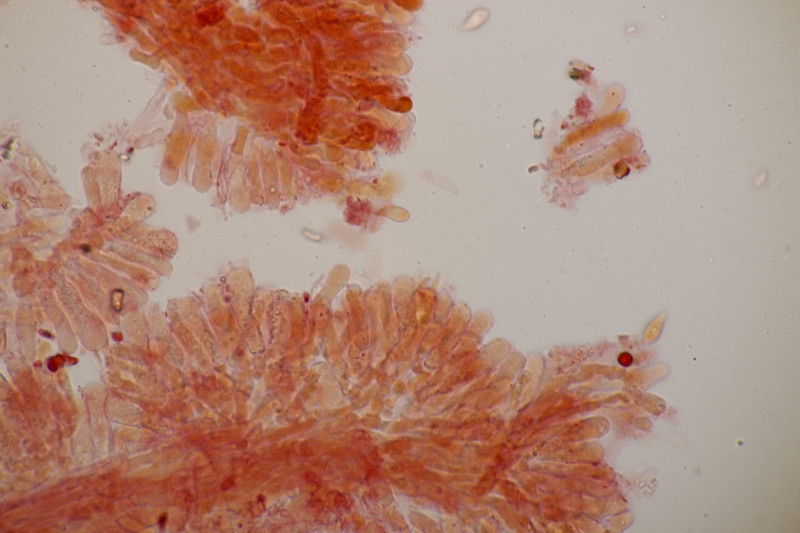
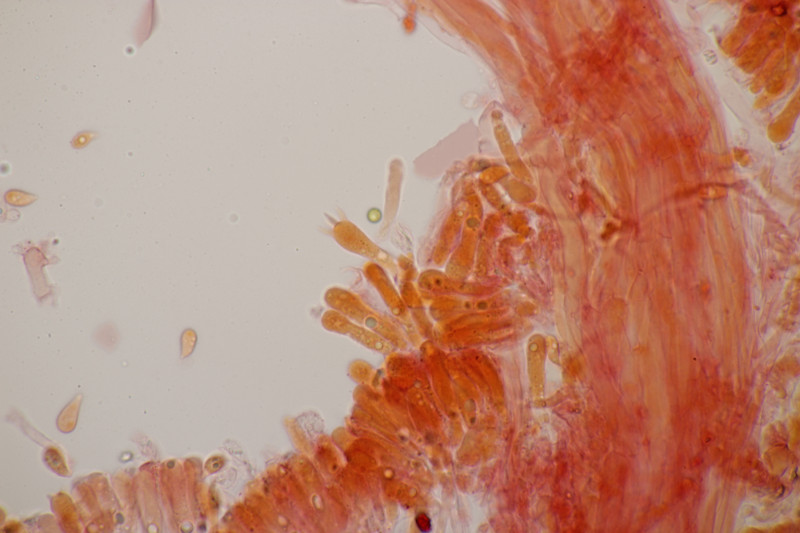


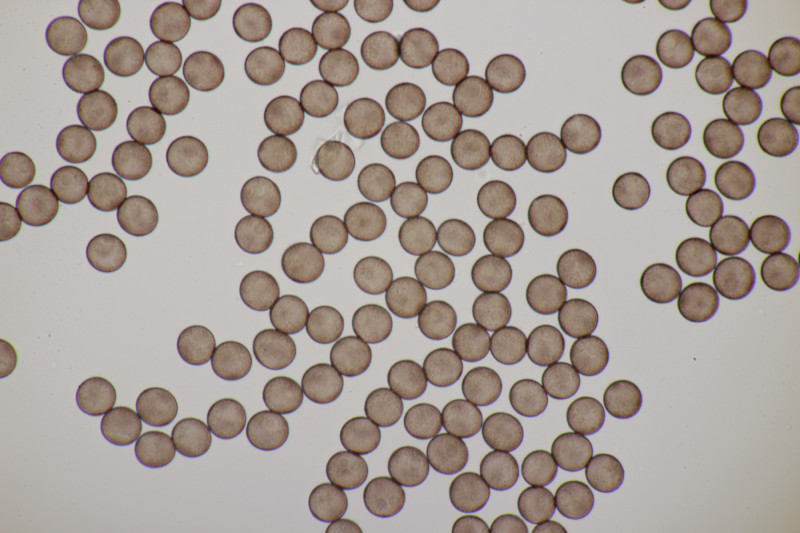
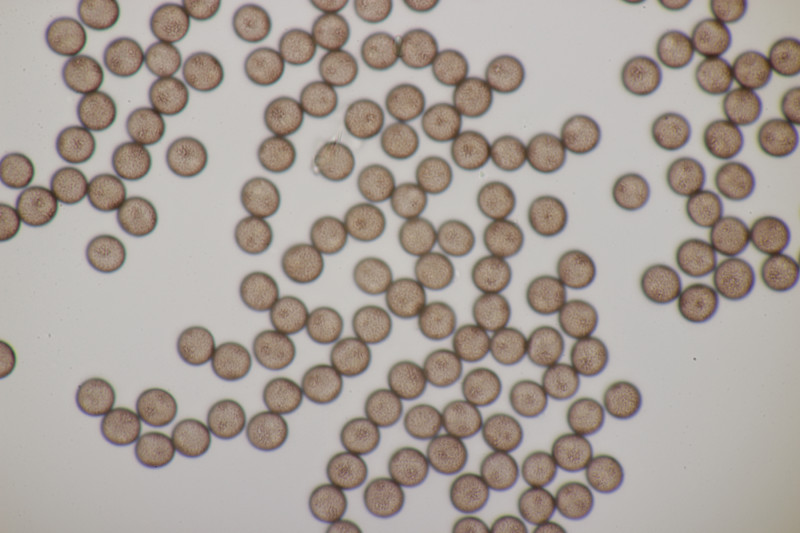
9. Badhamia utricularis. Sporen in sehr losen Ballen, (10.8+-0.5) µm bzw. (9.4-11.9) µm


10. Phleogena faginea auf interessantem Substrat: Prunus avium!


11. Lycogala epidendrum agg.

12. Bremia lactucae s.l. ex Arctium sp.


Björn


