Hallo zusammen,
weiter geht es mit dem zweiten Teil aus dem Duisburger Landschaftspark.
1. Artomyces pyxidatus hatten wir im Vorjahr schon an einem Holzstapel. Dieses Jahr war sie noch größer und schöner wieder da.


2. Hypomyces aurantius auf alter Porlingsleiche




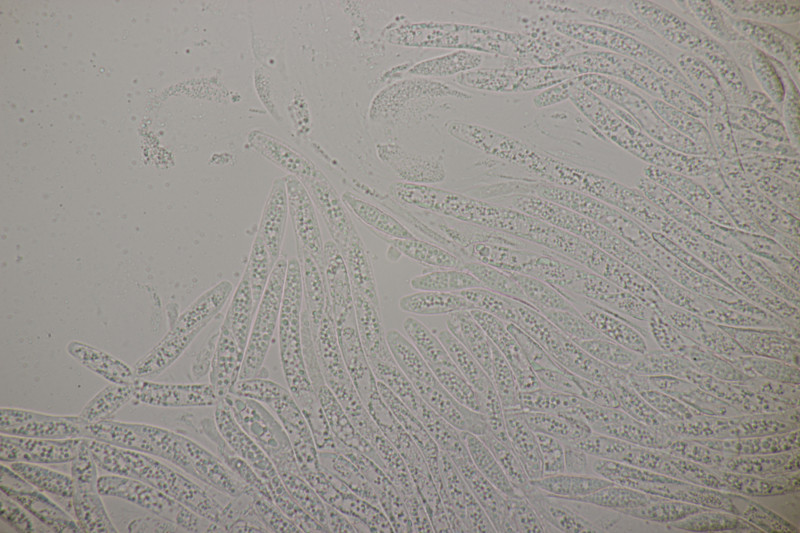

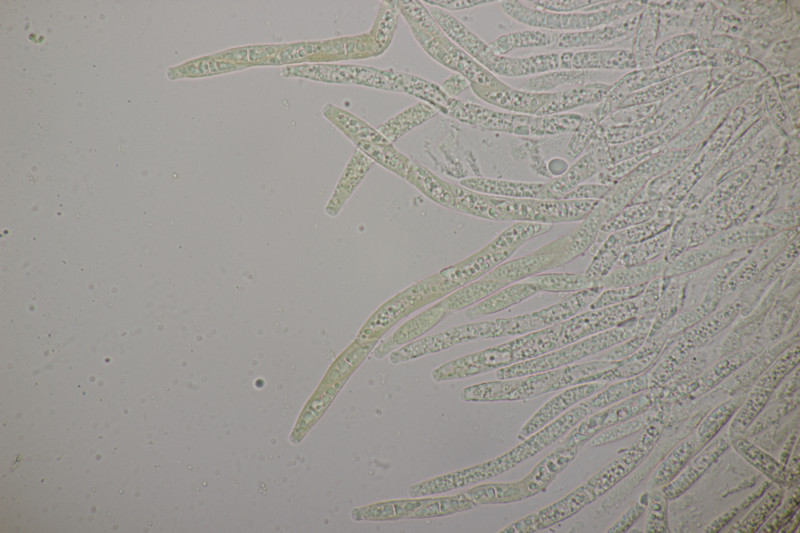

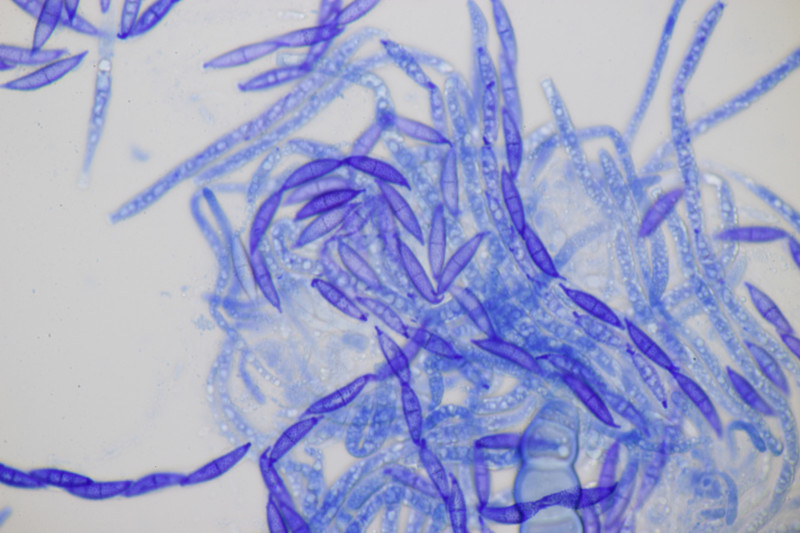


3. Lycogala epidendrum agg.


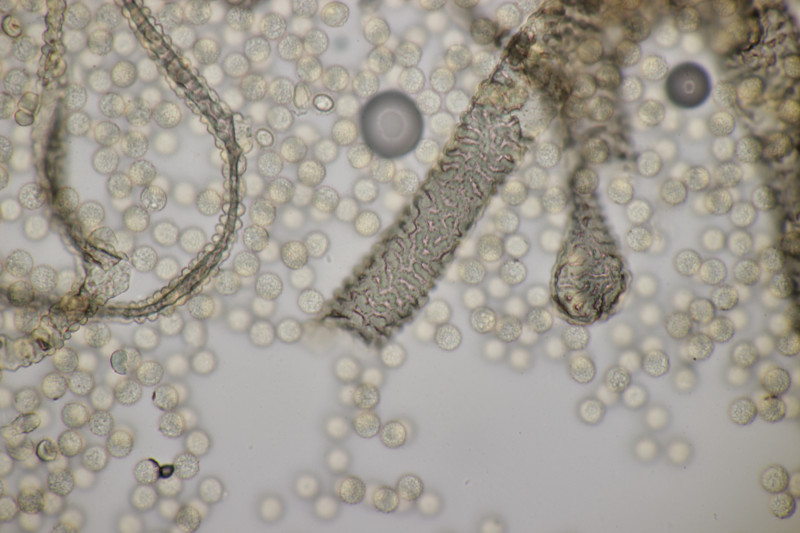



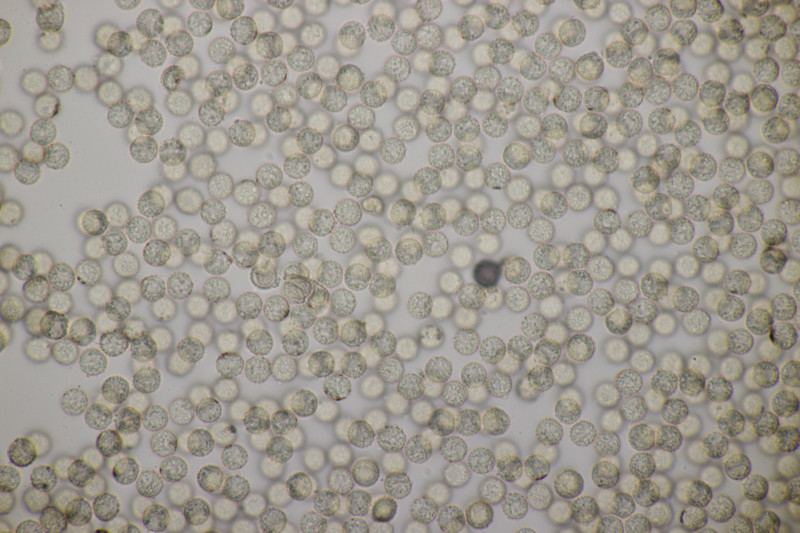


4. Gyromitra infula

5. Trichia decipiens




6. Steccherinum fimbriatum

7. Eine Orbilia. Also muß man jetzt eigentlich nur noch Zottos Monographie aus dem Schrank holen und zack hat der Pilz einen Namen... Wenn es nur so einfach wäre! Ich scheitere ehrlich gesagt schon daran zu erkennen, wie genau die winzigen Sporen nun geformt sind.


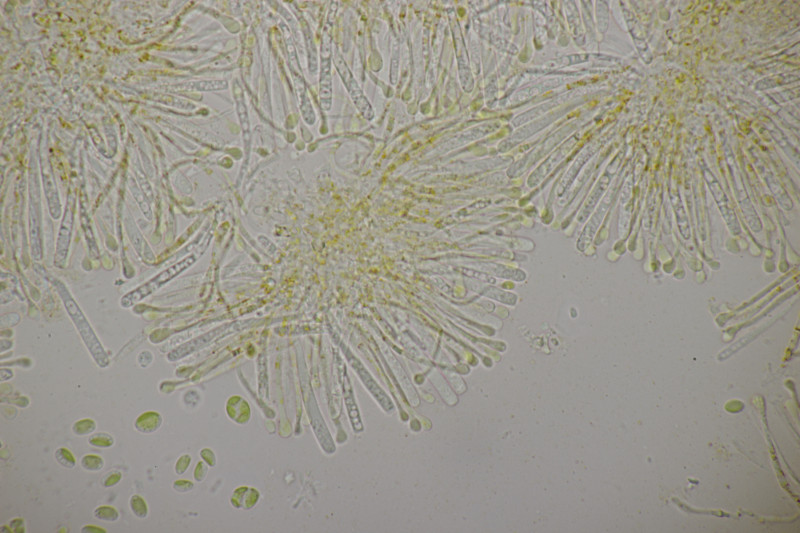



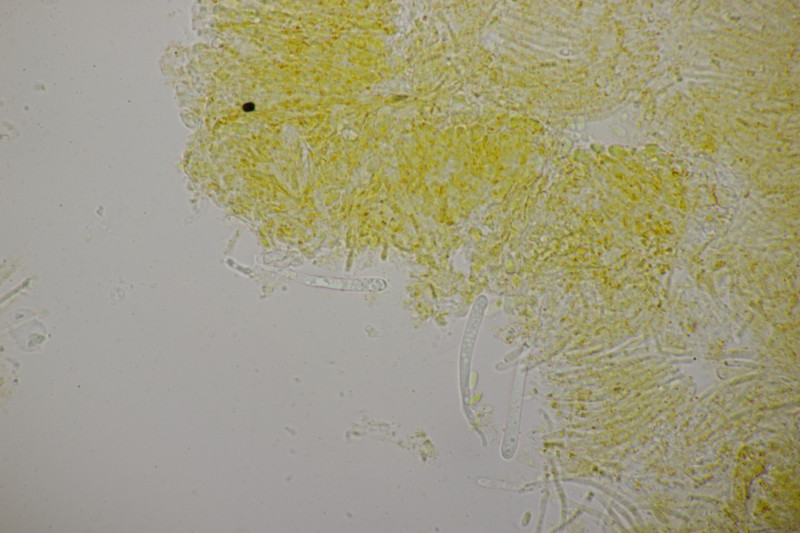

8. Auch im Dezember wachsen noch Entolomas. Diese hier hat keine Schnallen, 4-sporige Basidien, keine Zystiden und Sporen von (8.4+-0.5) µm x (6.5+-0.5) µm, Q=1.3+-0.1 bzw. (7.5-9.7) µm x (5.9-7.6) µm, Q=1.2-1.5. Das Pigment der Huthaut scheint interzellulär-inkrustierend zu sein. Die Fruchtkörper haben einen deutlichen Mehlgeruch. Die Lamellen laufen bei einigen Exemplaren deutlich nabelingsartig herab. Die Stiele sind glatt. Die Huthaut ist schwach hygrophan und glatt.
Damit würde ich in der Funga Nordica bei Schlüssel F über 1, 4, 9, 10, 12 bei E. nigellum landen. Der paßt aber von der Sporengröße her nicht. Vielleicht ist der Hut also doch nicht glatt und es geht weiter bei Schlüssel G über 1, 3, 4, 5, 6,7 aber weder E. rusticoides noch E. lanicum passen hier. Es gibt aber eine Arbeit von Vila et al. aus dem Jahr 2014, wo die Gruppe um E. rusticoides aufgedröselt wird. Da schlüssel ich mich erstmal mit den Spore zu E. flocculosum, was aber geruchsmäßig nicht paßt. Wenn man also alternativ abbiegt, lande ich dann bei E. graphitipes f. graphitipes. Meine Sporen sind zwar einen Ticken zu schmal dafür, aber das mag daran liegen, daß ich vllt. einige nicht optimal liegende Sporen erwischt habe. Für E. graphitipes spricht auch, daß Björn Sontopski die Art an gleicher Stelle vor einem Jahr auch hatte. Da aber dann die f. cystidiatum.

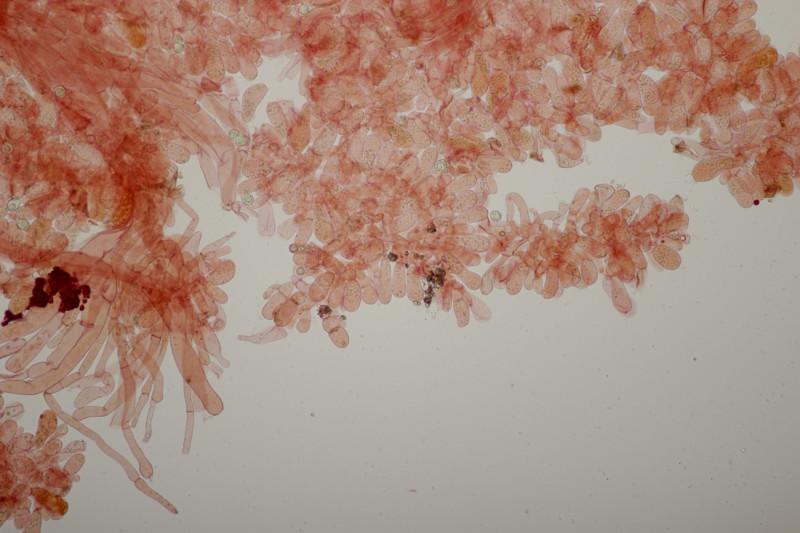







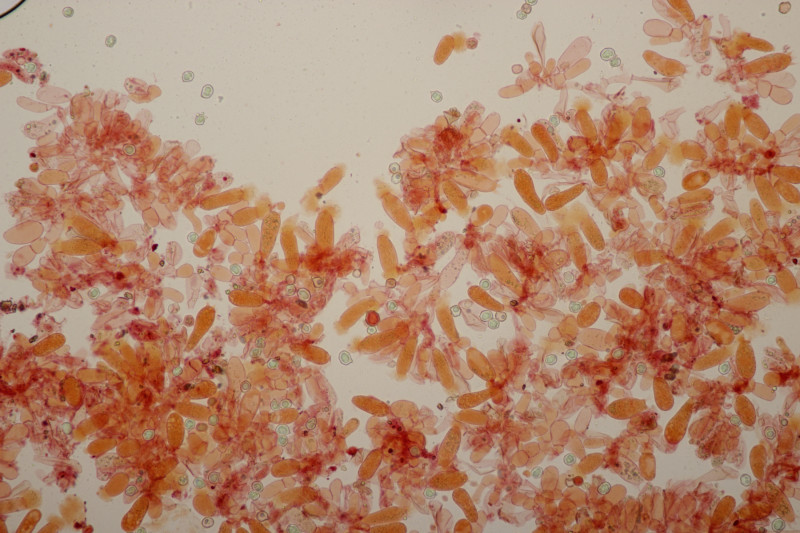




9. Melampsora pulcherrima ex Mercurialis annua


Björn


