Hallo zusammen,
am Sonntag Morgen lag zwar ein bißchen Schnee, aber es hat mich dann trotzdem raus in den Stadtwald gezogen. Wenn man da einfach genug Totholz umdreht, findet man irgendwann doch ab und zu mal einen Pilz 
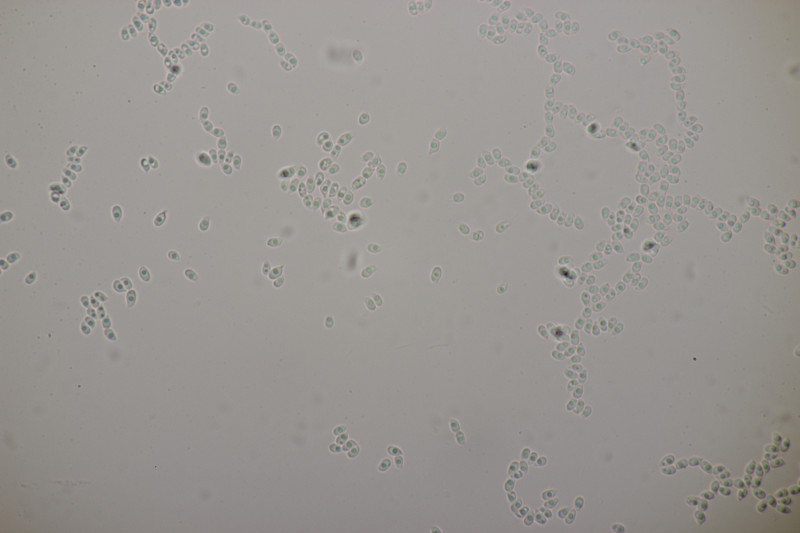
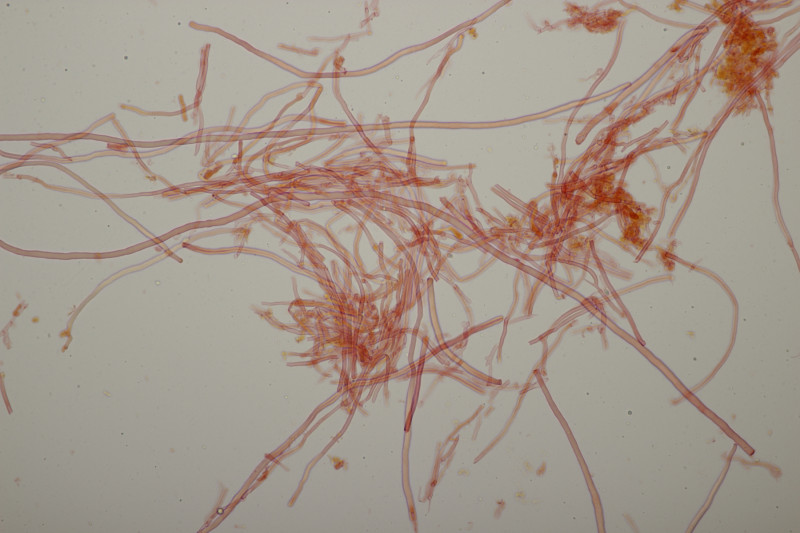
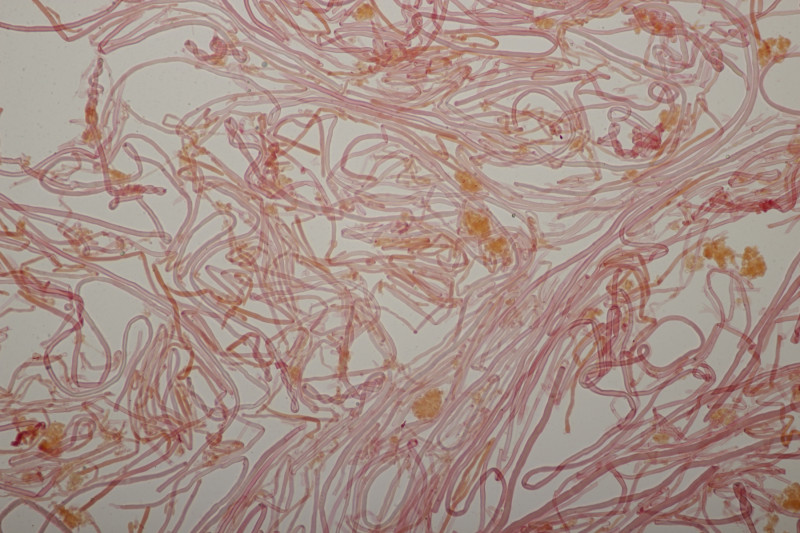
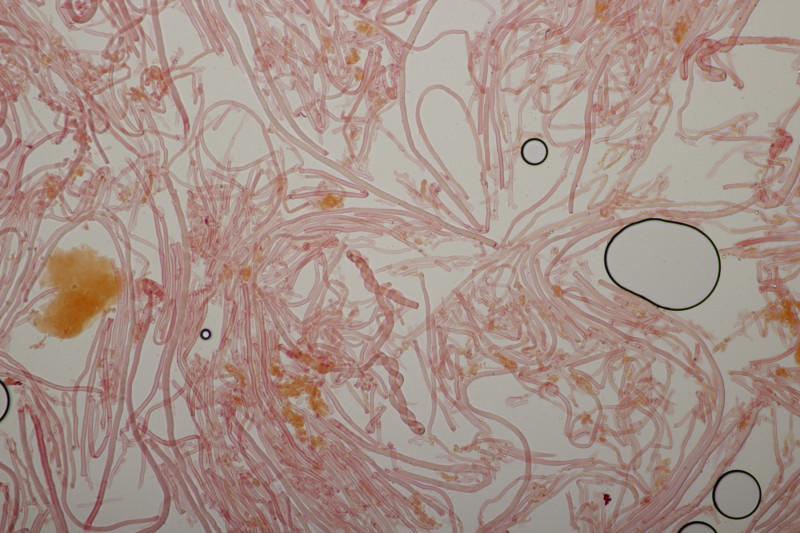
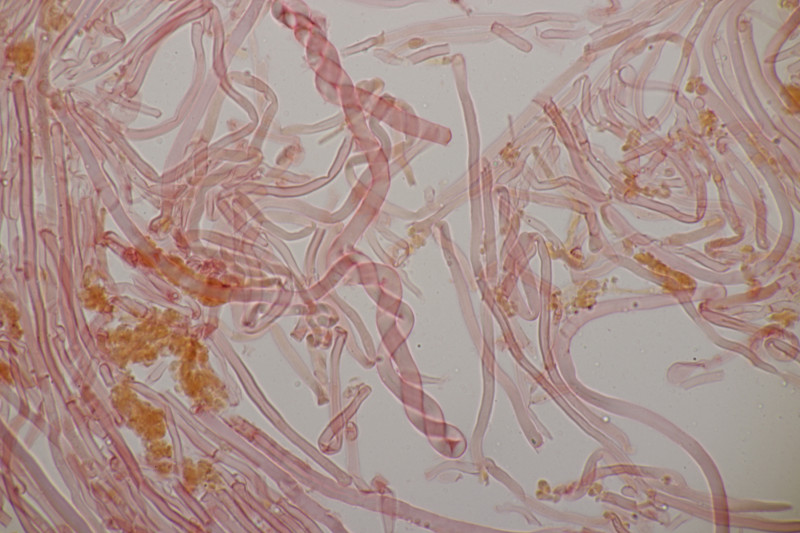
1. Den Anfang macht dieser Rindenpilz an Laubholz. Schnallen sind vorhanden, Basidien 4-sporig mit Basalschnalle, Zystiden habe ich keine gesehen. Die Sporen messen (3.7+-0.2) µm x (2.2+-0.2) µm, Q=1.7+-0.1, bzw. (3.3-4.1) µm x (1.9-2.6) µm, Q=1.4-2.0. Auffällig sind die Rhizomorphen. Der Fruchtkörper hat mit KOH nicht verfärbt. Könnte das Leptosporomyces mutabilis sein?





2. Stereum rugosum





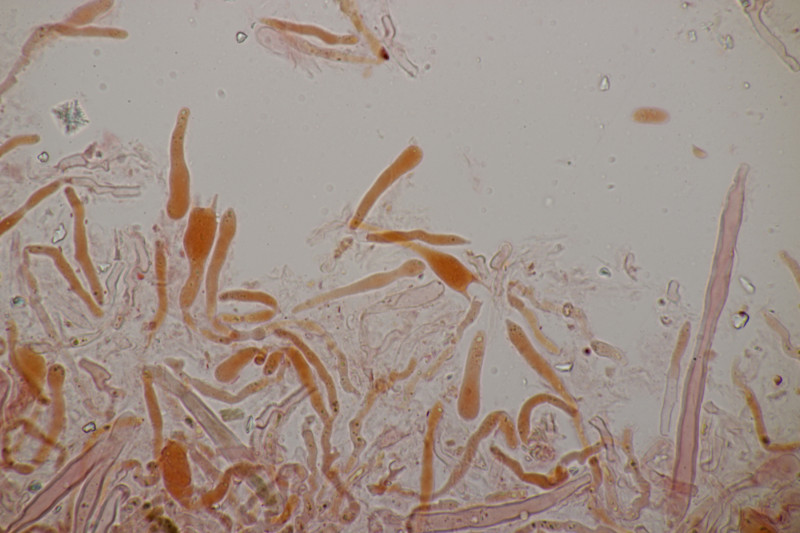


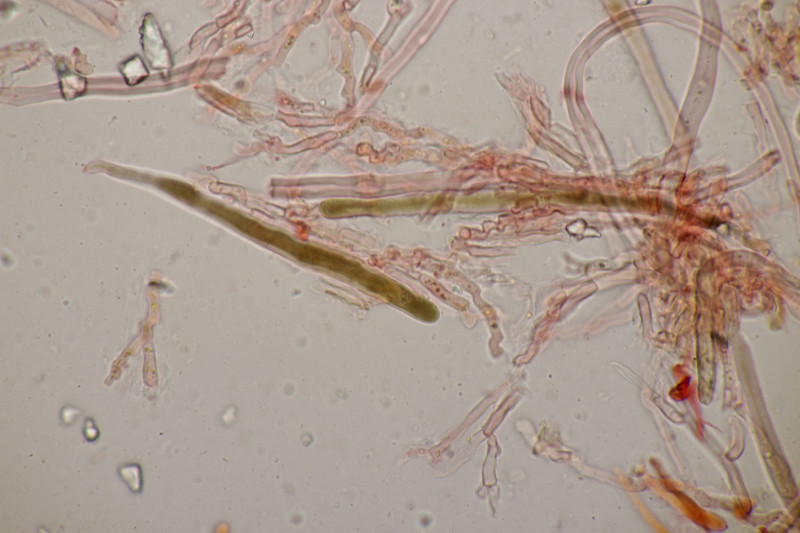
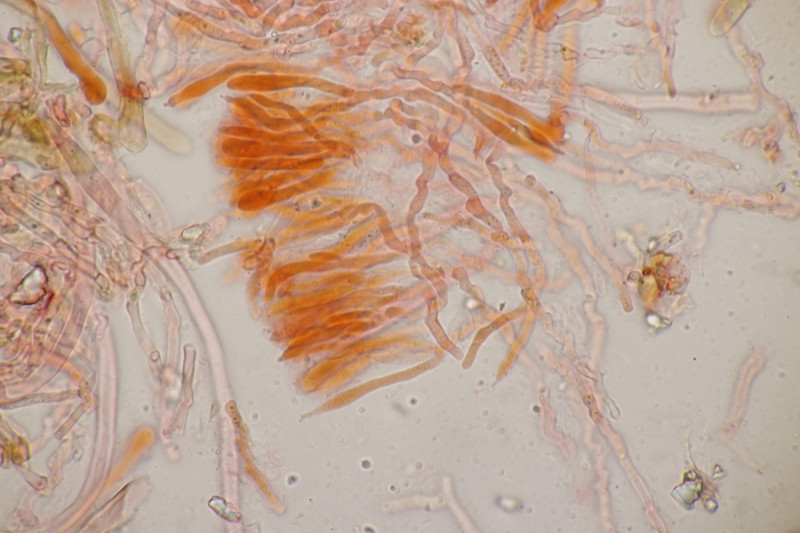




3. Hypocrea gelatinosa




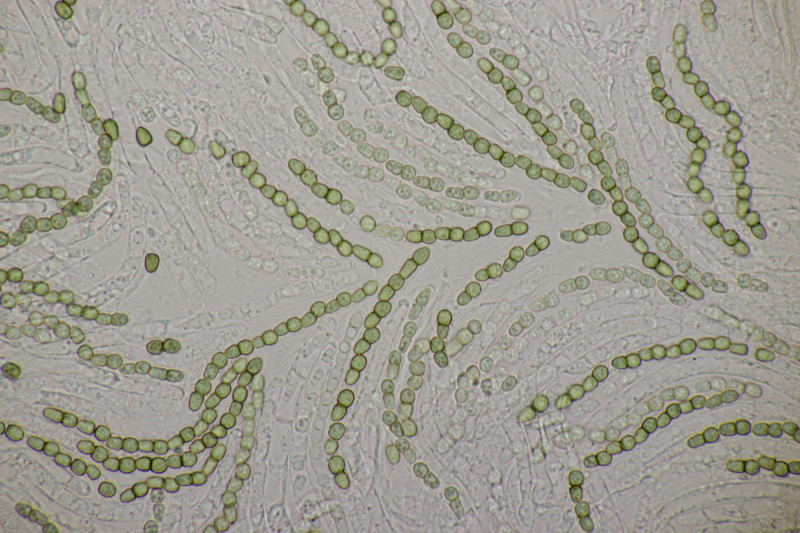

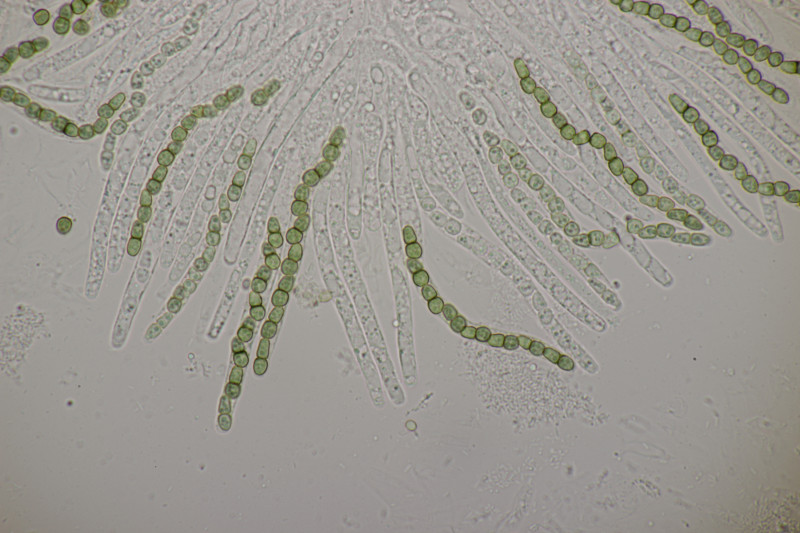
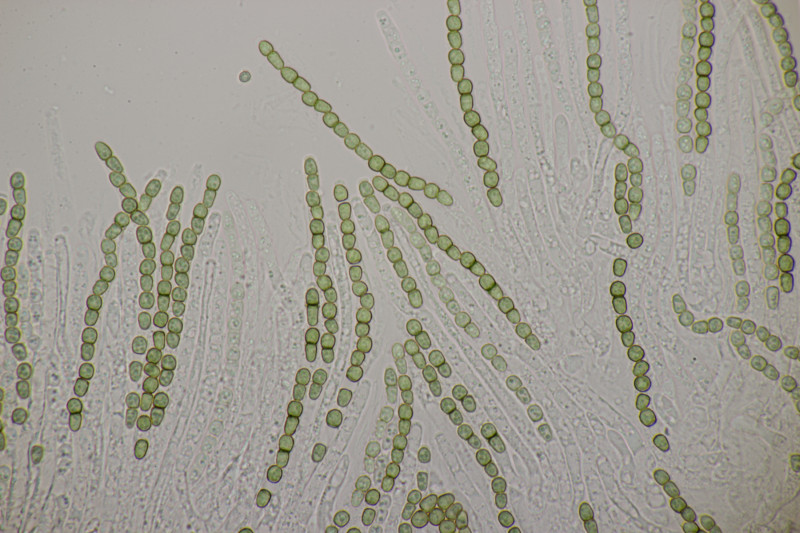








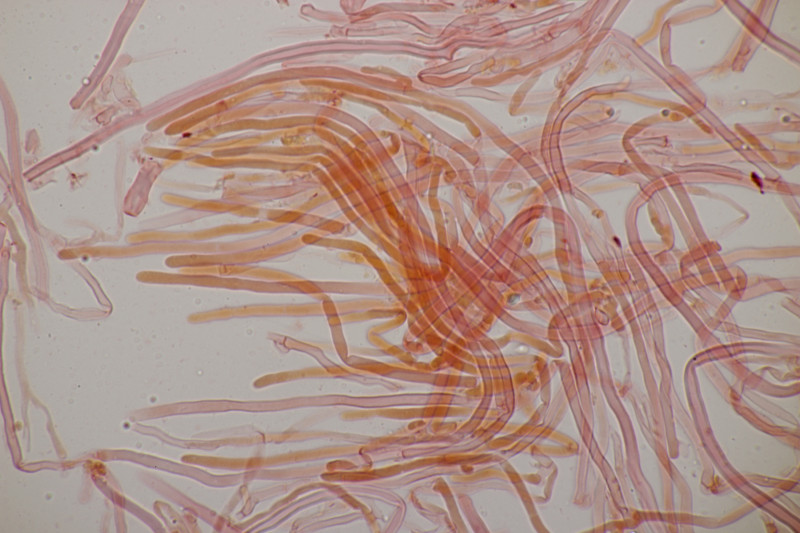
4. Noch ein Rindenpilz. An Quercus, Schnallen vorhanden, Zystiden keine gefunden, Basidien 2-4-sporig mit Basalschnalle, Sporen (4.5+-0.3) µm x (2.8+-0.3) µm, Q=1.6+-0.1, (3.8-5.1) µm x (2.4-3.4) µm, Q=1.3-1.9. Es fehlt mir eine rechte Idee...



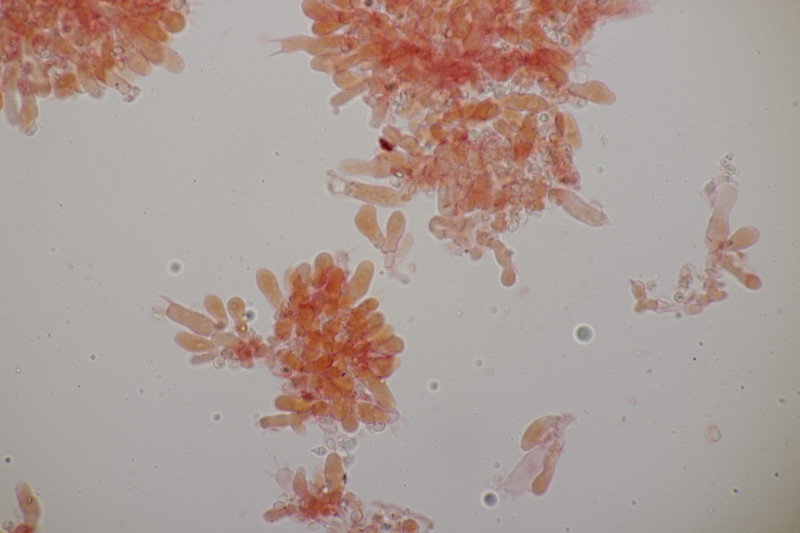
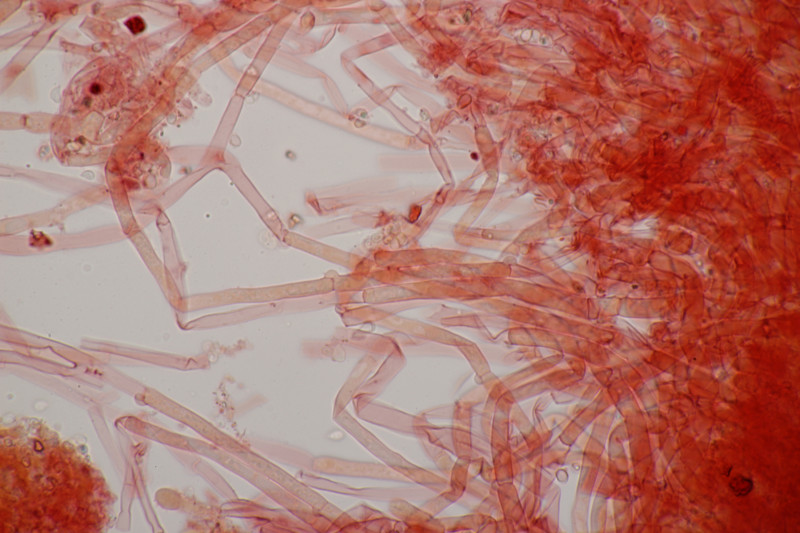

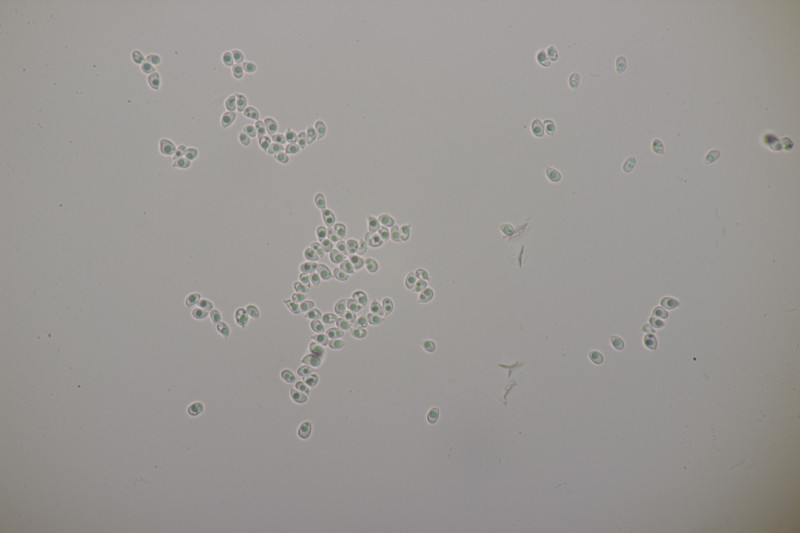
5. Zur Abwechslung mal ein Porling an Fagus sylvatica. Geruch auffallend fruchtig, sehr angenehm. Schnallen vorhanden, Zystiden nicht beobachtet, Basidien 4-sporig mit Basalschnalle, Hyphenenden teilweise inkrustiert, monomitisch. Sporen (4.8+-0.5) µm x (2.2+-0.1) µm, Q=2.1+-0.2, (3.9-5.8) µm x (2.0-2.5) µm, Q=1.8-2.5. Ich tendiere zu Ceriporiopsis gilvescens. Was meint ihr?







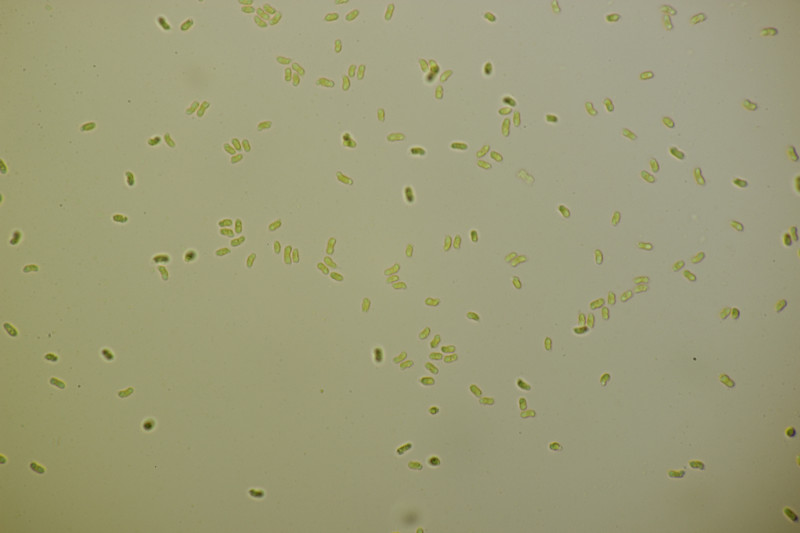
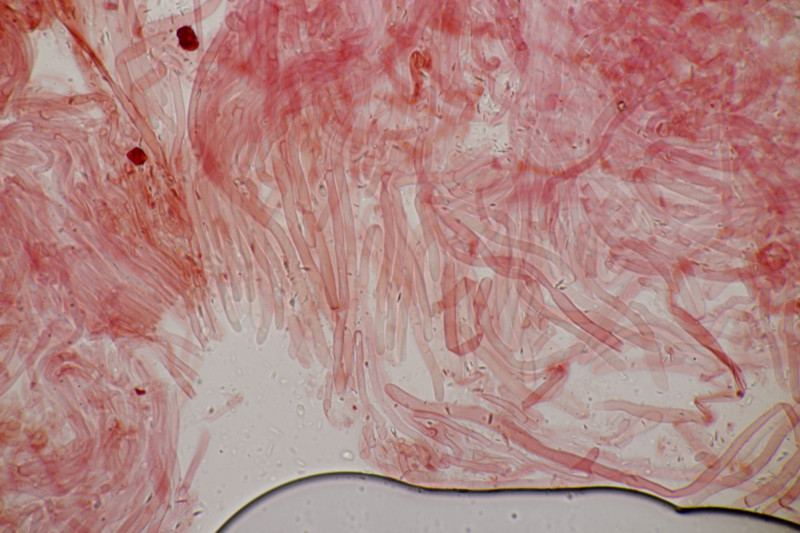
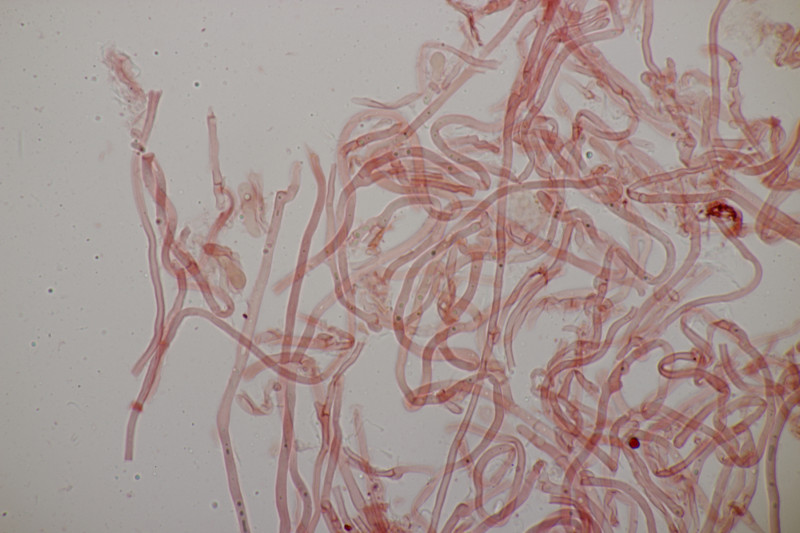

6. Paranectria oropensis an Lepraria sp.





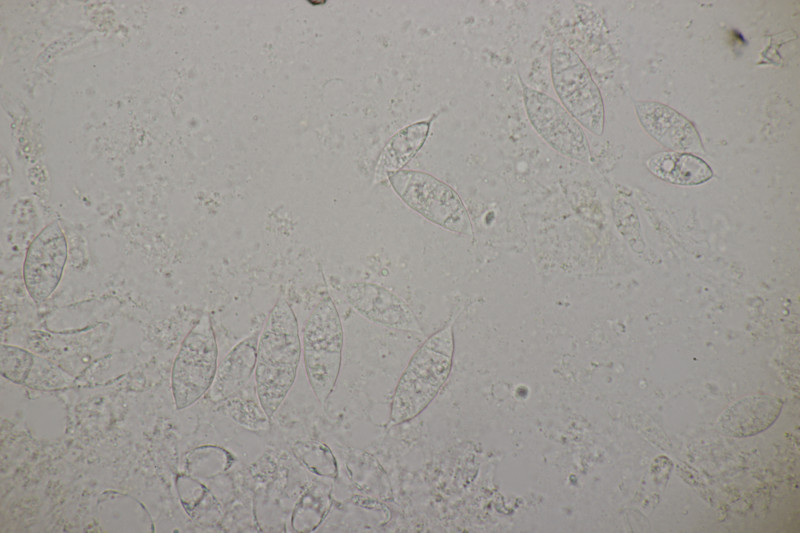


7. Die Anamorphe von Pleospora vitalbae an Clematis vitalba

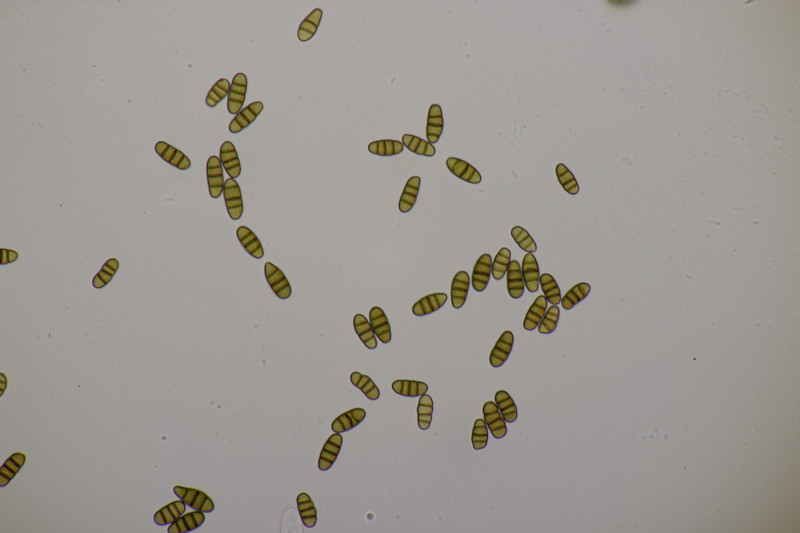



8. Hypholoma fasciculare wuchs auch
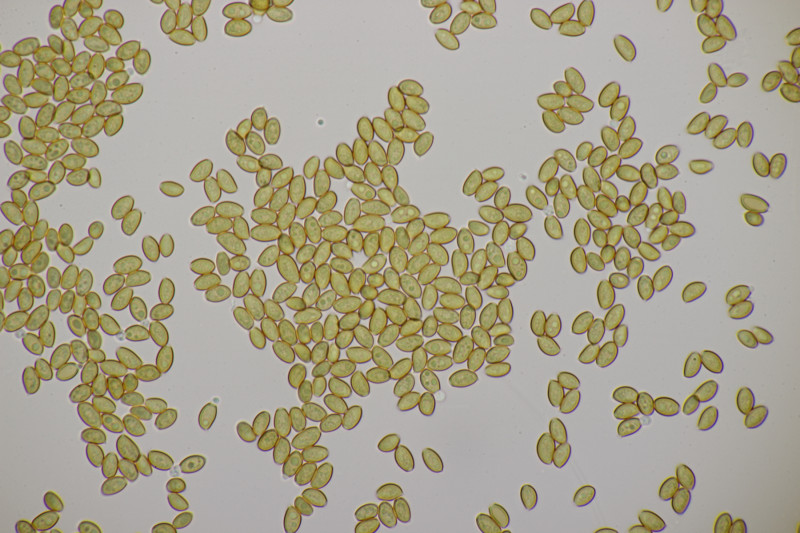

9. Und Ischnoderma resinosum






Björn


