Hallo zusammen,
gestern war ich vormittags auf einer kleinen Runde im Duisburg Süden, Düsseldorfer Norden und auch stellenweise in Ratingen unterwegs. Der Wald dort ist insgesamt recht interessant, es gibt Erlen-Bruchwälder, Buchenwald, einige Stellen mit Waldkiefern und einige Schonungen mit Weymouth-Kiefern und anderen Nadelbaumexoten. Und überall natürlich auch Pilze!
1. Corticium roseum an Salix sp.

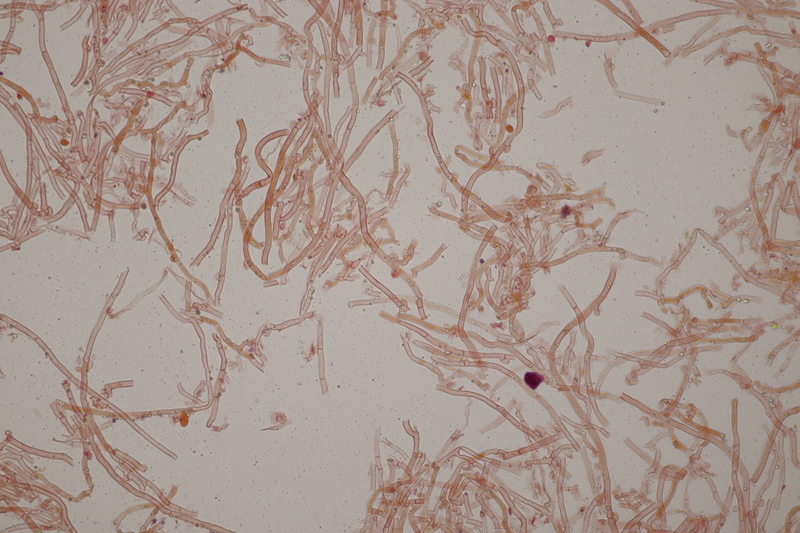

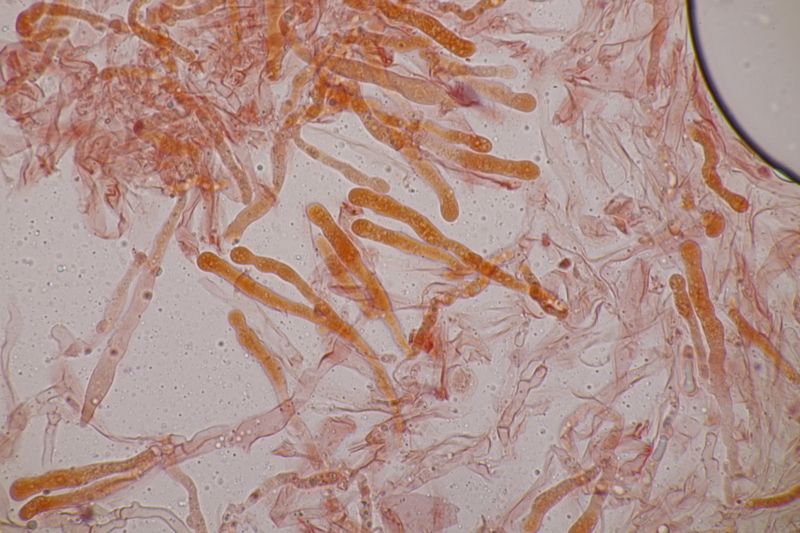

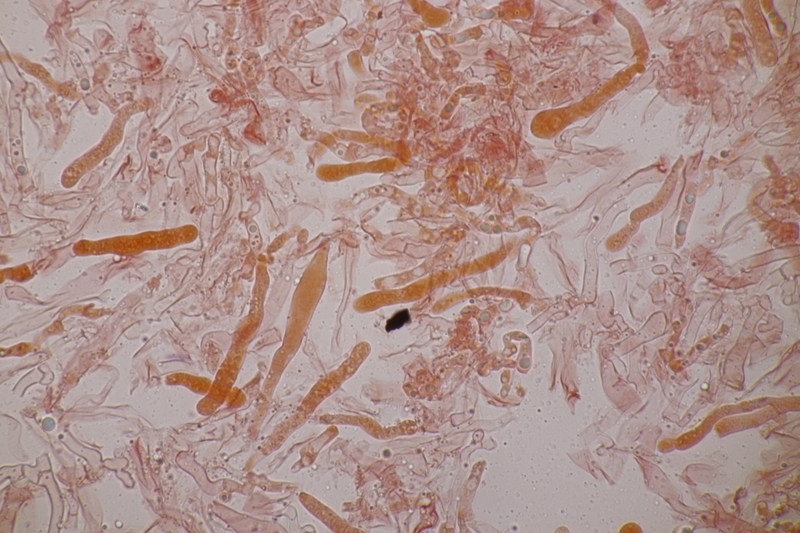

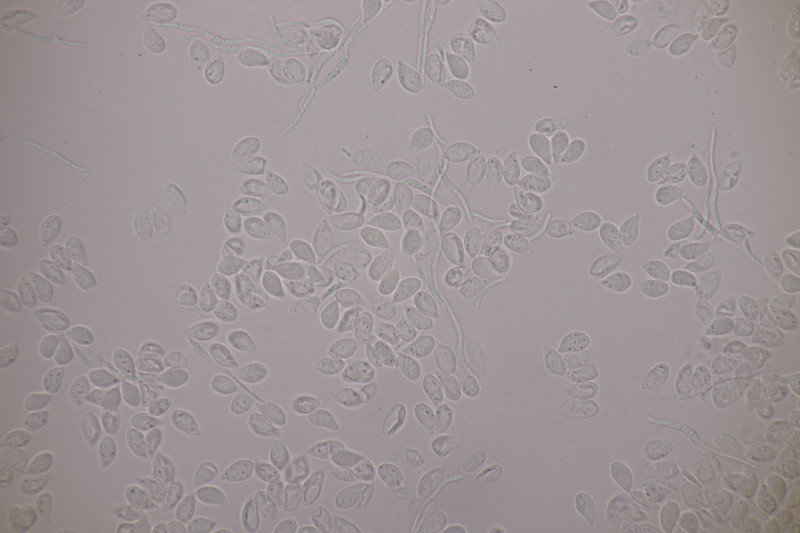
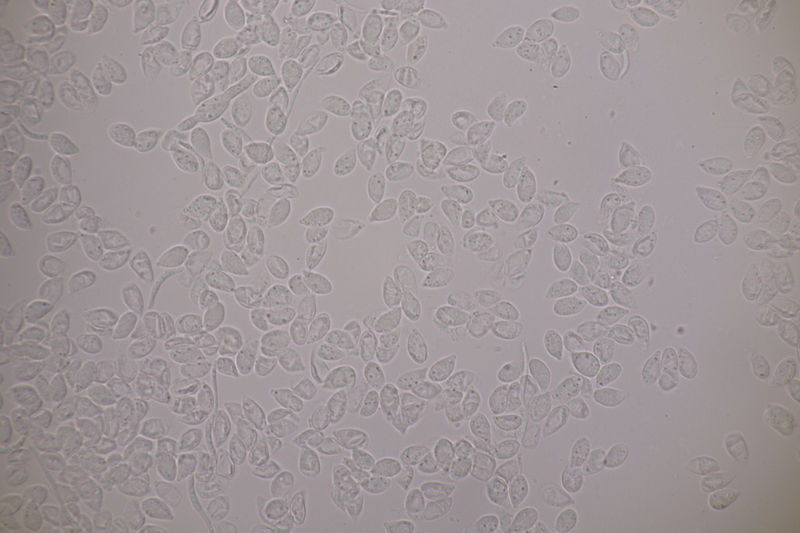
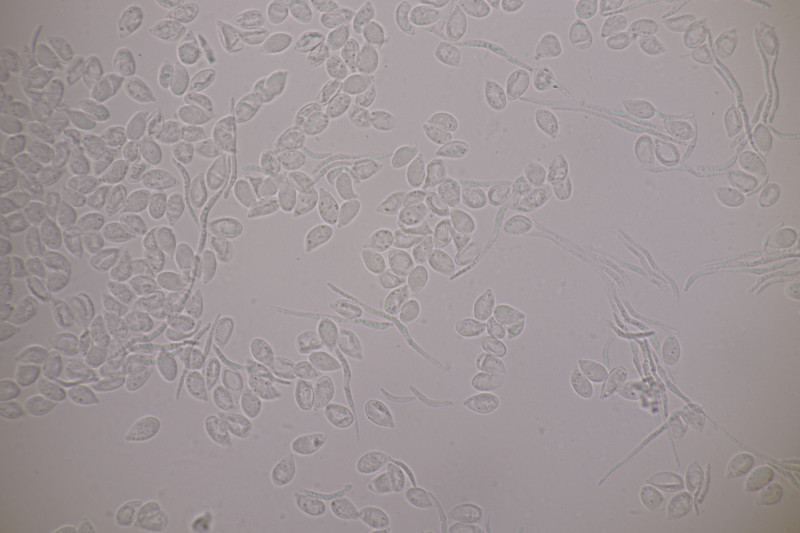
2. Tremella encephala ex Stereum sanguinolentum





3. An Pinus strobus wuchsen diese Gesellen, die aber leider ohne Innenleben waren.


3. Bei den schwarzen Kügelchen handelt es sich um eine nicht näher betrachtete Anamorphe. Die weiße Masse scheint aber die Anamorphe zu den weißen Bechern zu sein. Diese haben ziemlich kleine, elliptische Sporen mit symmetrischen Tropfen, also Lachnellula resinaria var. resinaria









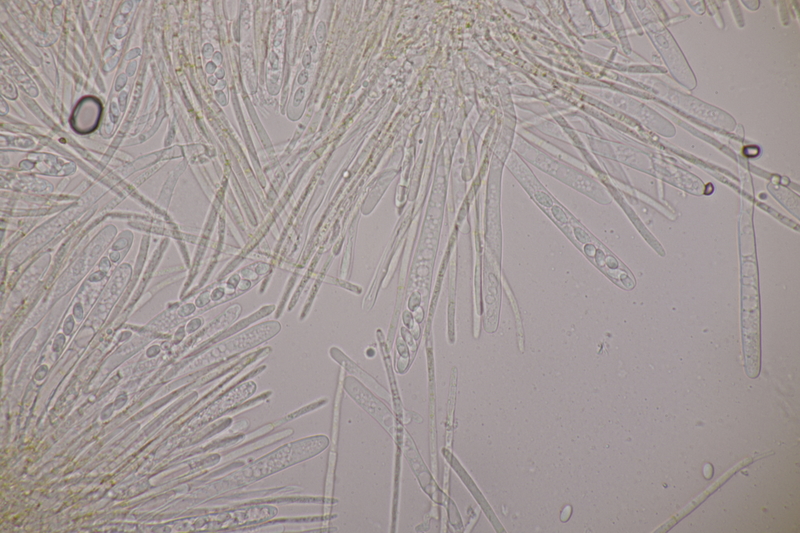



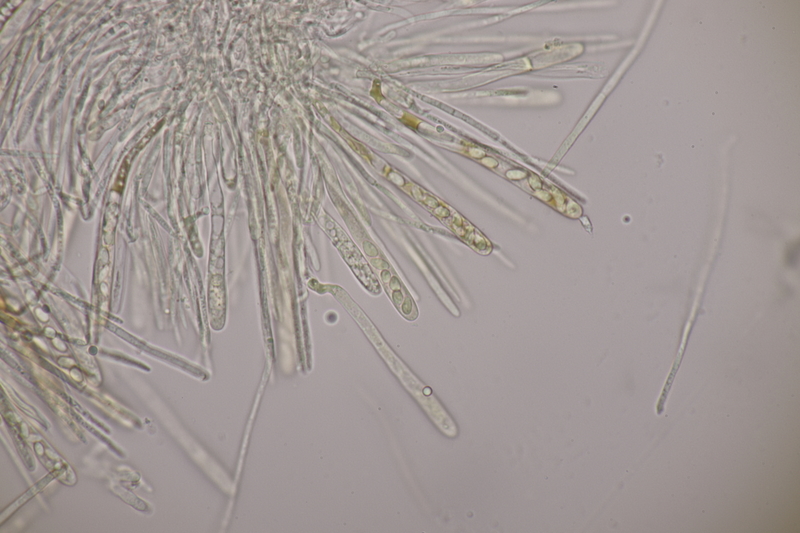
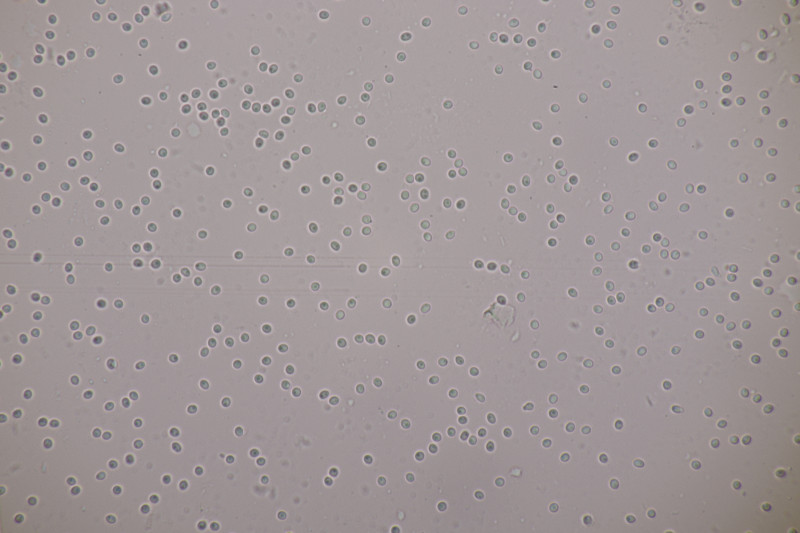

4. Phaeotremella foliacea s. str. Endlich habe ich diesen Pilz auch mal gefunden. Ganz witzig, denn den Tag vorher war ich auf einer 17 km Wanderung von Lembeck nach Haltern genau wegen dieses Pilzes. Jemand hatte bei ObsIdentify eine Phaeotremella an Nadelholz gepostet (dort dann aber falsch als Exidia bestimmt) und ich wollte mir den Pilz natürlich nicht entgehen lassen. Leider konnte ich ihn dann aber an der mutmaßlichen Fundstelle nicht entdecken. Jetzt also fast um die Ecke bei mir.


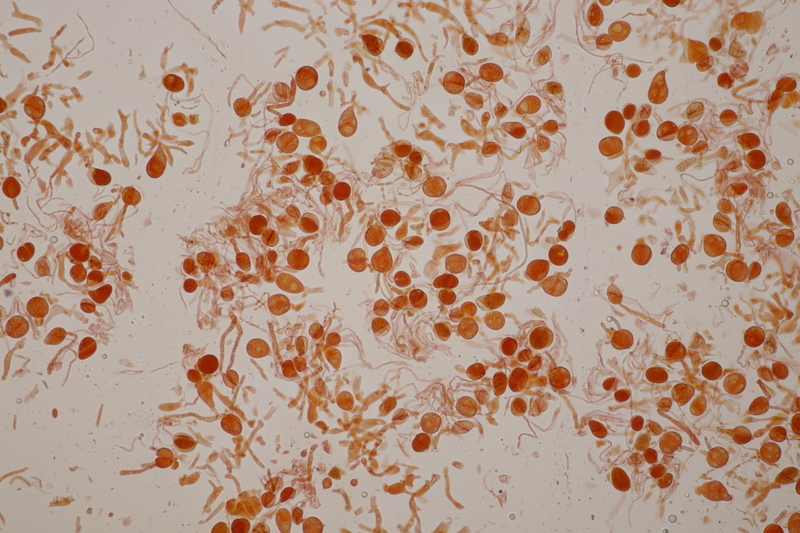
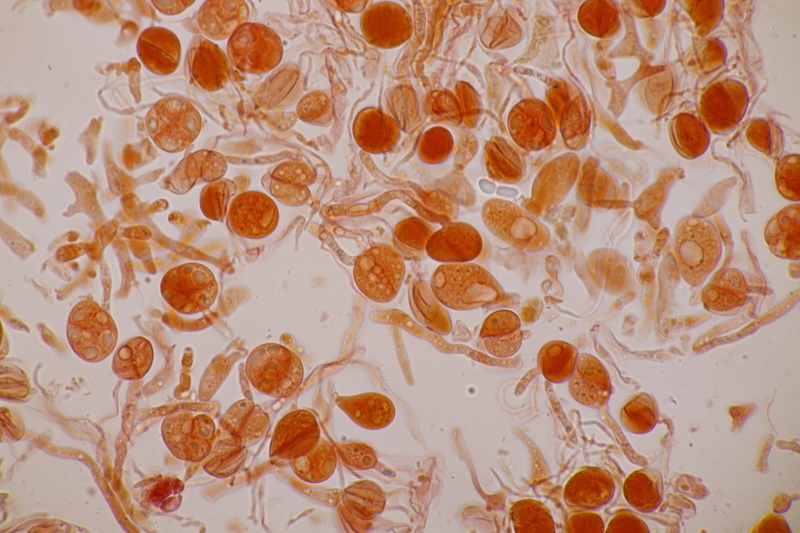
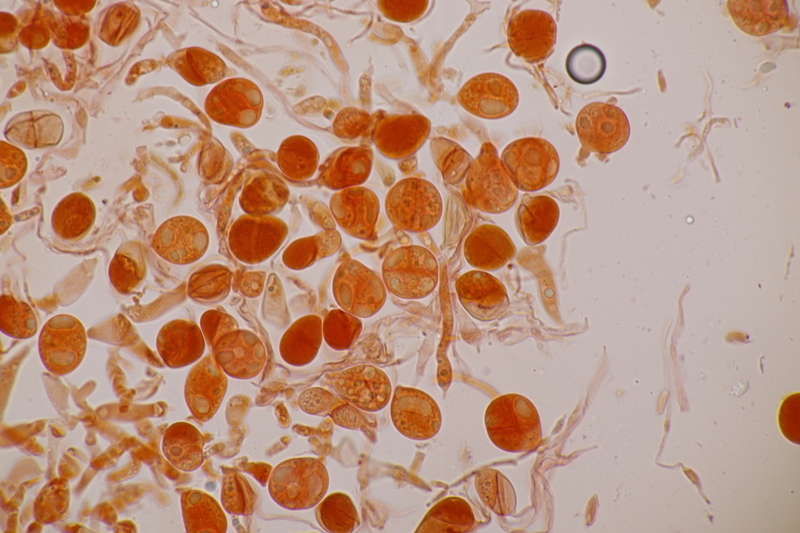
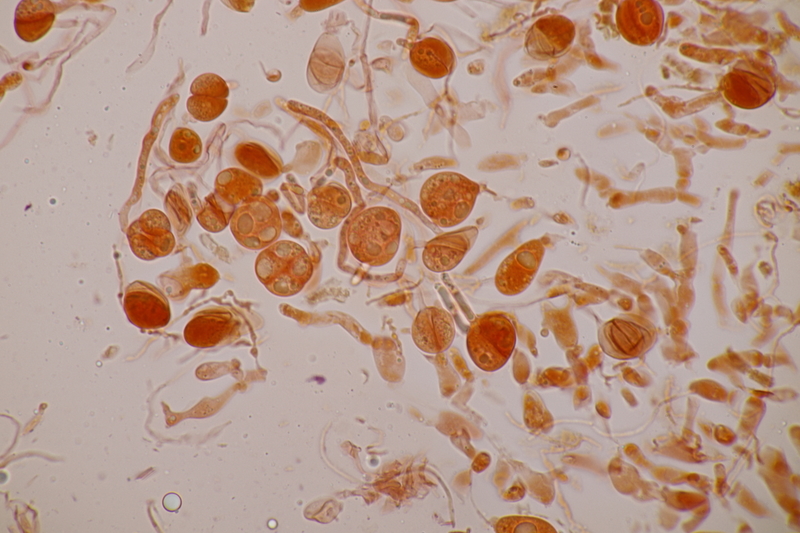


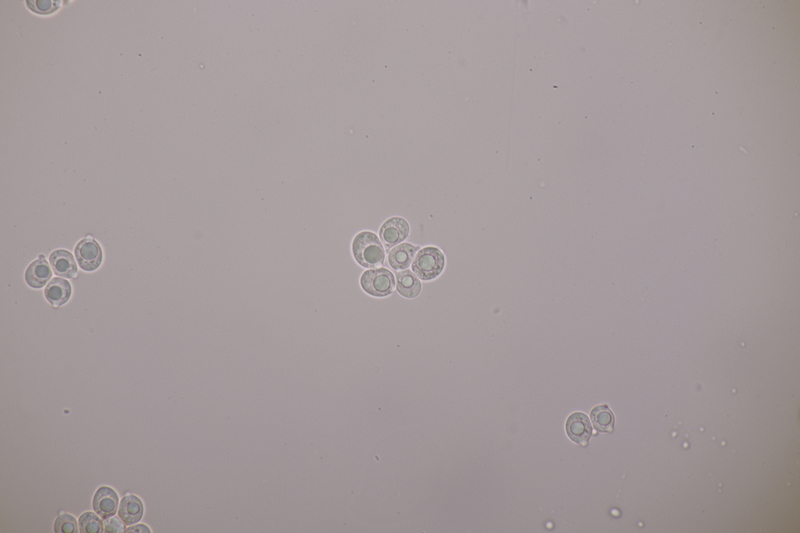
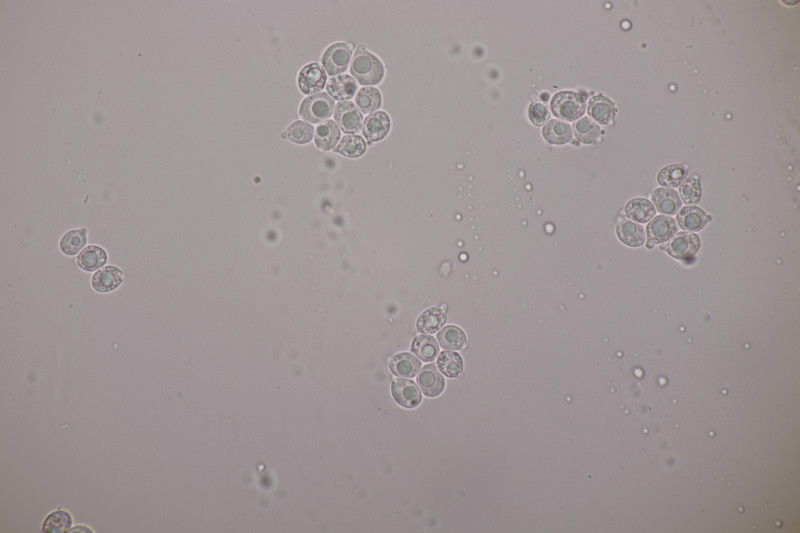
5. Tulasnella violea





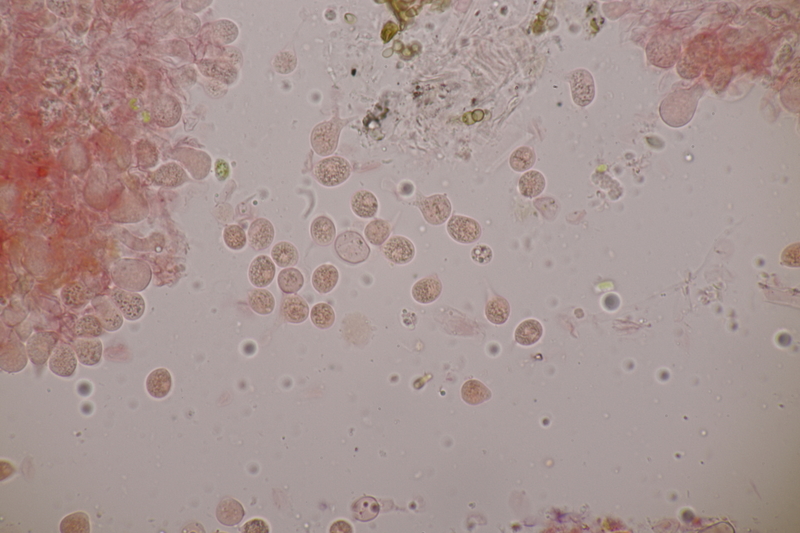







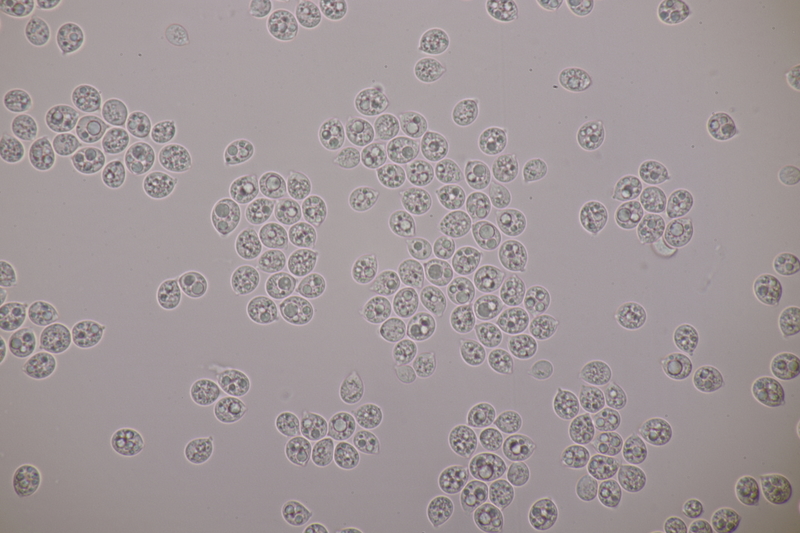
6. Hypoxylon fuscum an Corylus avellana


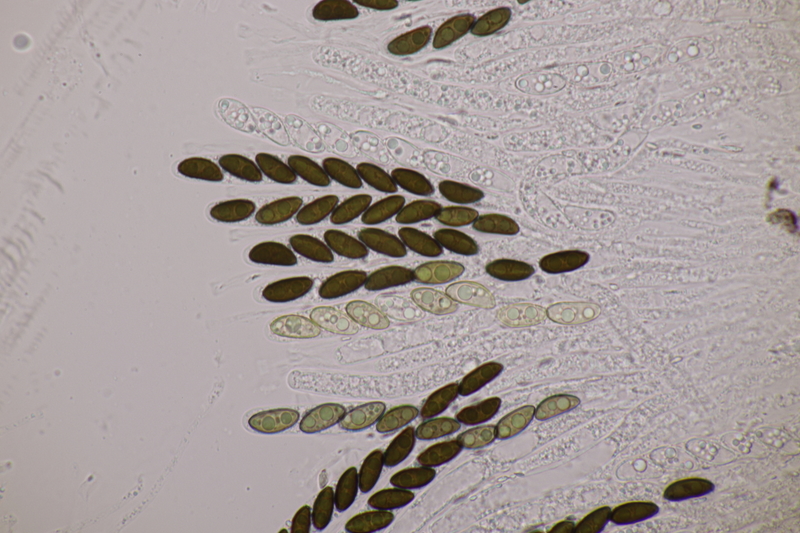






7. Diese Gallerttränen an Halse sind noch nicht reif. Mal schauen, ob sie noch nachreifen.


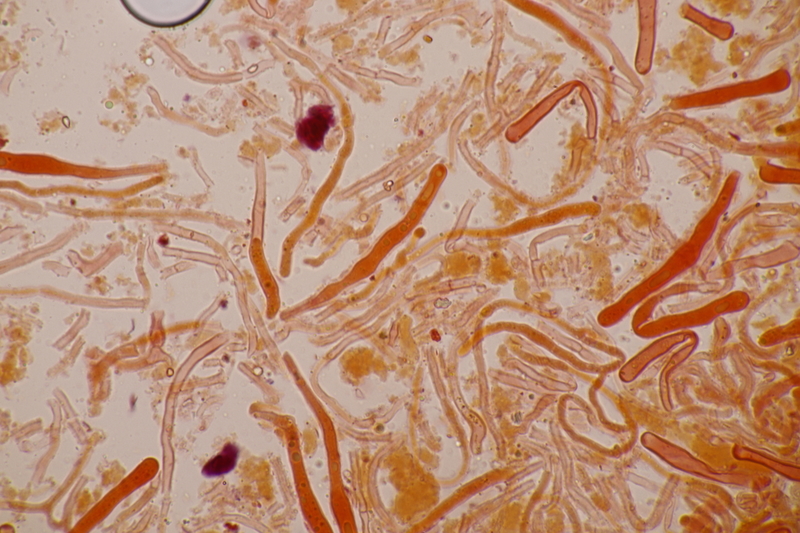
8. Phaeobotryosphaeria visci ex Viscum album

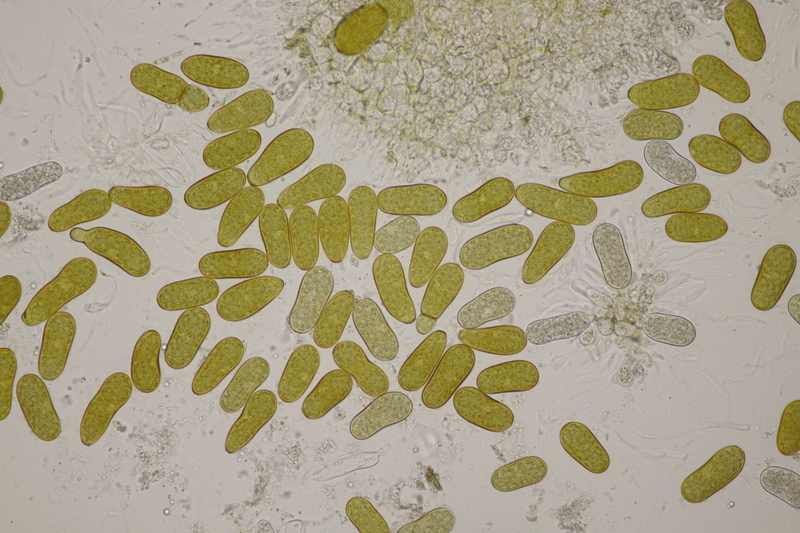


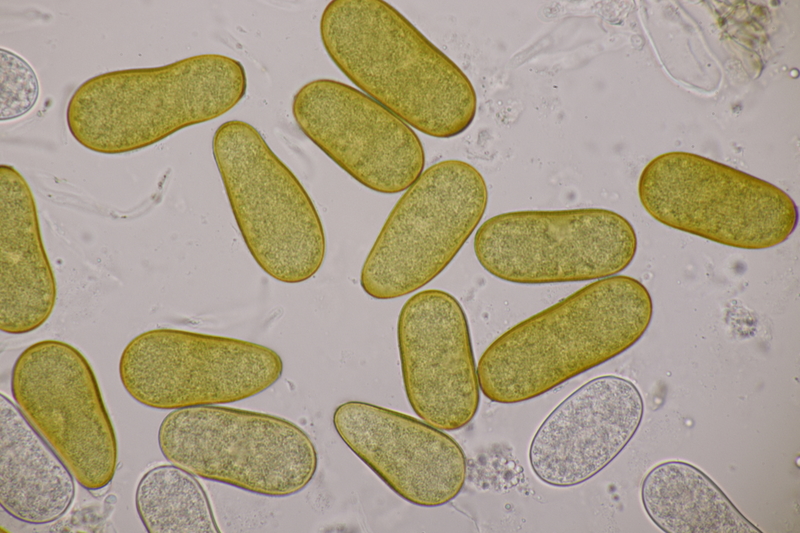
9. Ditopella ditopa ex Alnus glutinosa. Mit den 16-sporigen Asci leicht zu bestimmen.





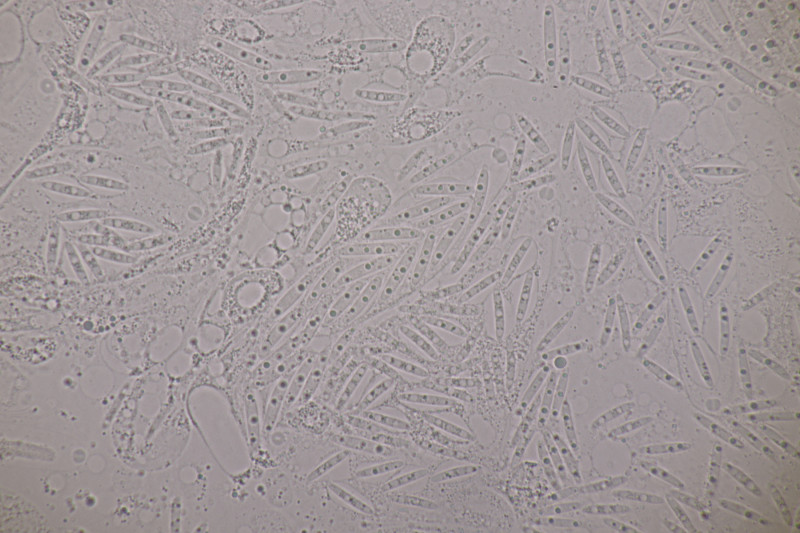




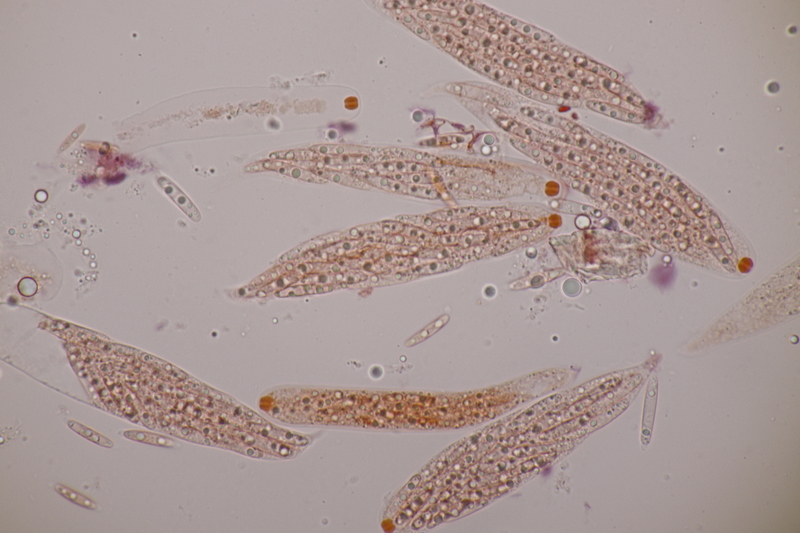
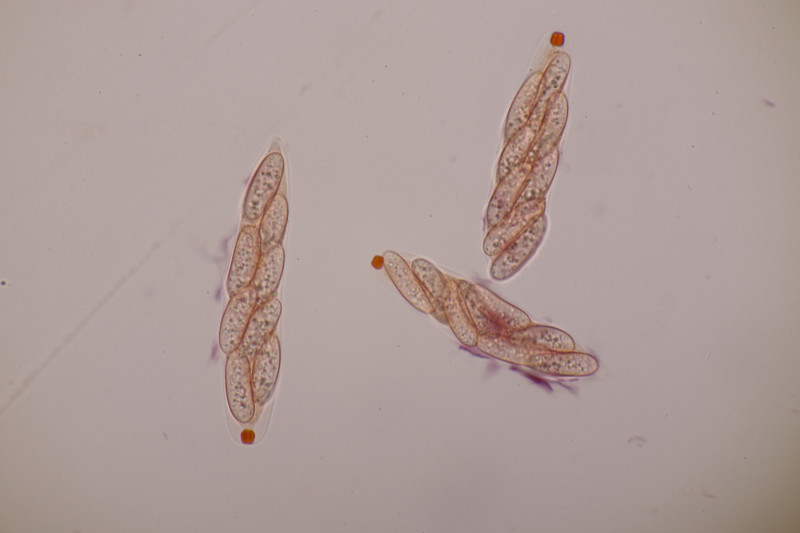
10. Am gleichen Ast und doch etwas anderes: Phragmoporthe conformis



Björn


