Hallo zusammen,
am letzten Samstag war ich eine Runde im Ratinger Stadtwald unterwegs. Der ist zwar ganz bei mir in der Nähe, war mir aber bis dato noch vollkommen unbekannt. Insgesamt ein sehr diverses Gebiet mit Buchenwald, Erlenbruch, Stellen mit Eichen, aber auch diversen Feldern mit mehr oder weniger exotischen Nadelhölzern wie Pinus strobus und dazu überall kleinere Bäche, so daß man insbesondere auch in trockenen Sommern Pilze finden dürfte. Entsprechend gab es auch ein reichhaltiges Pilzangebot:
1. Eine Orbilia an Buche




2. Biscogniauxia nummularia

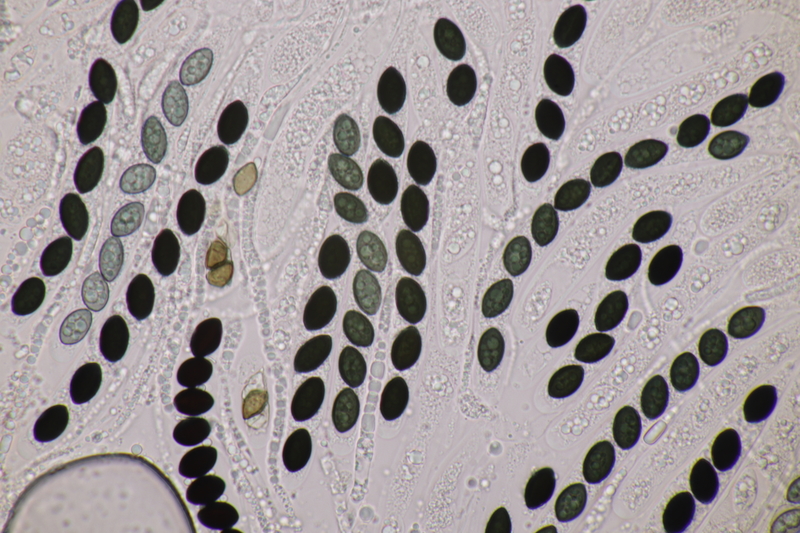
3. Tremella encephala

4. Aleurodiscus aurantius











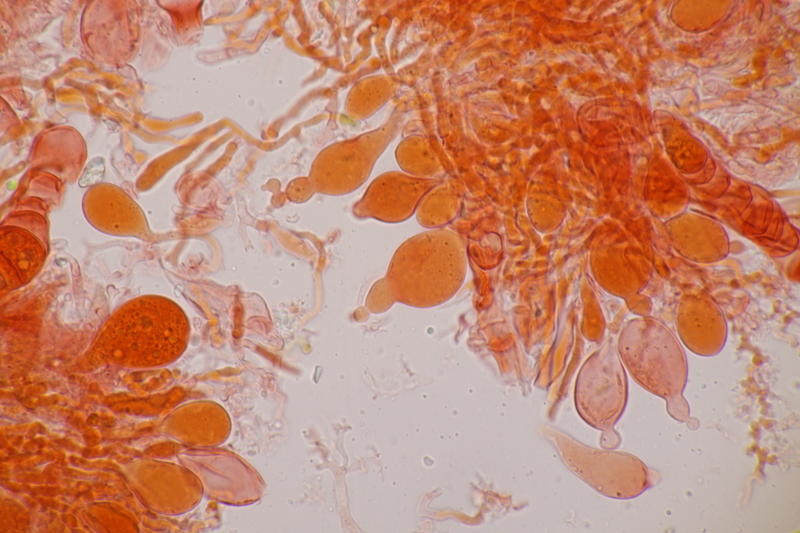

5. Hier hatte ich auf einen Flechtenparasiten gehofft, aber am Ende sind es wohl einfach nur Pyknidien, die zur Flechte gehören



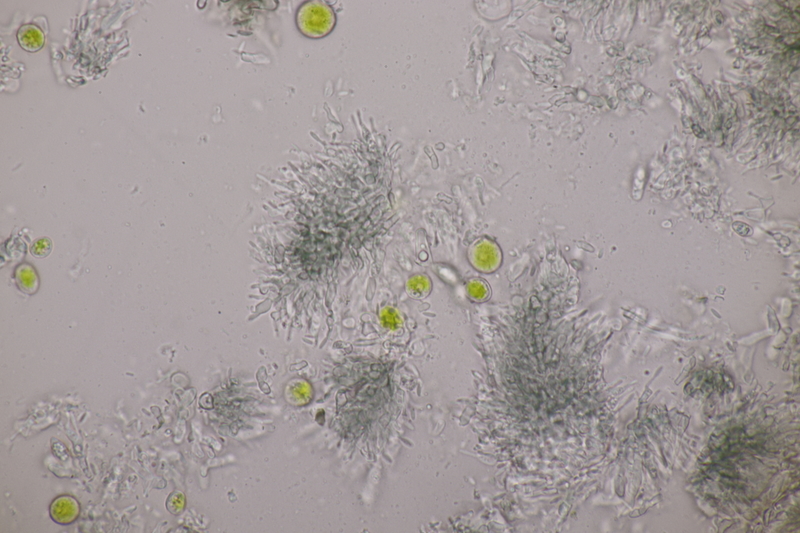
6. Ruzenia spermoides




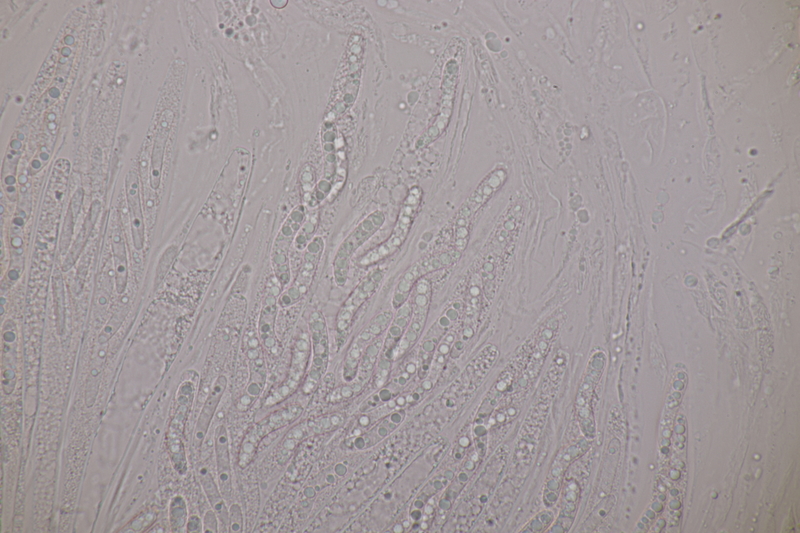


7. Gibberella pulicaris ex Cytisus scoparius





8. Ein Coelomycet auf Cytisus scoparius


9. Stilbospora macrosperma ex Carpinus betulus







IMG_6660.JPG

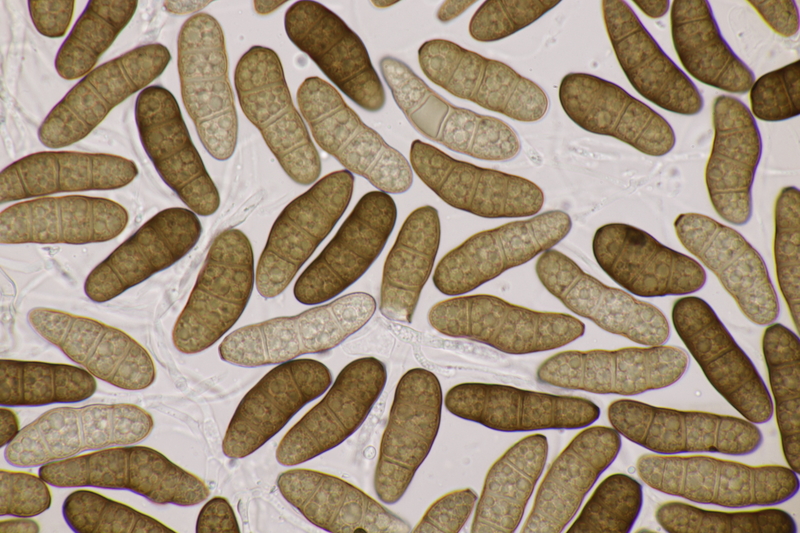


10. Camarographium carpini ex Carpinus betulus
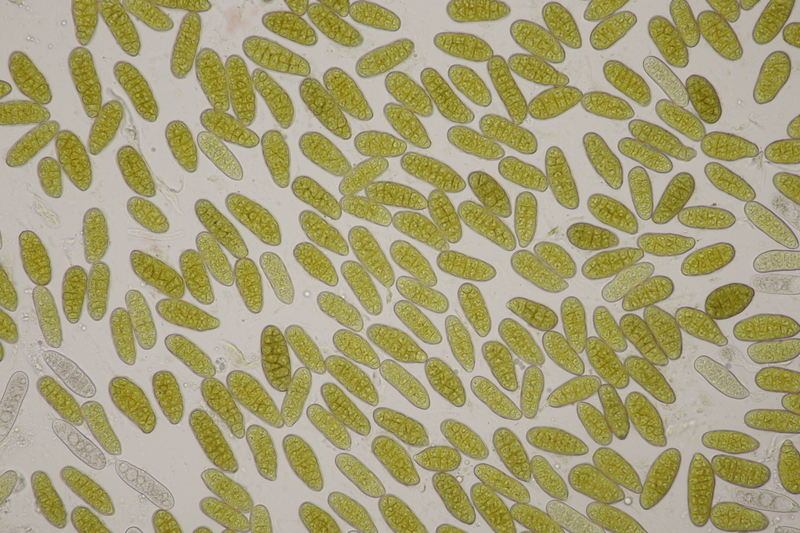


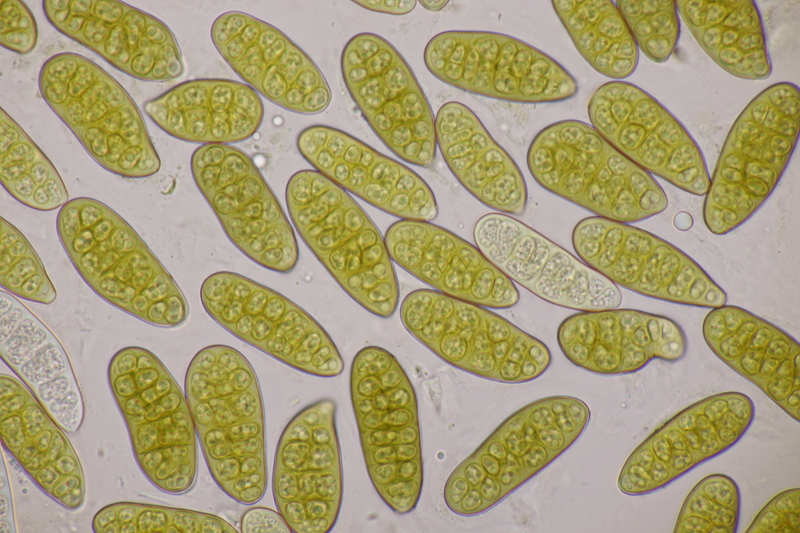

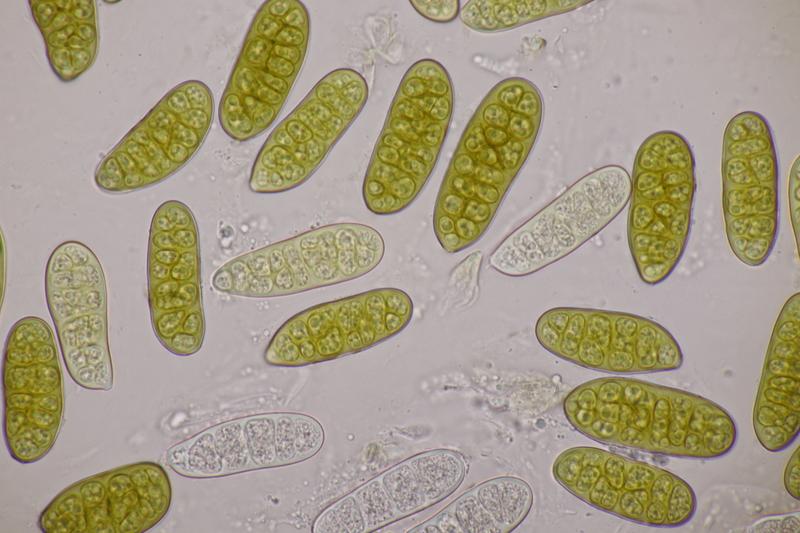
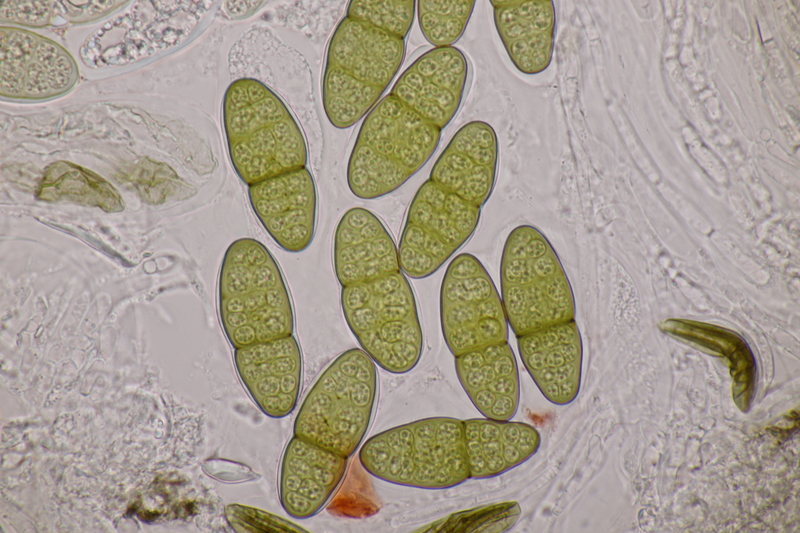
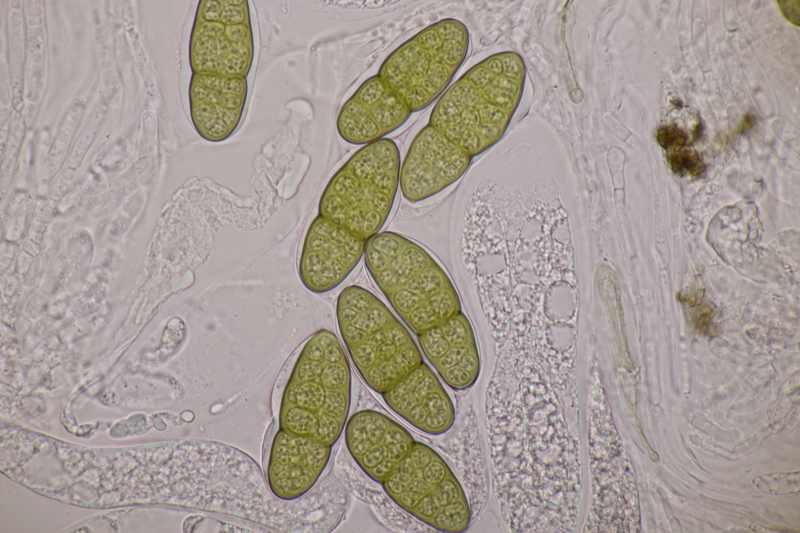
11. Pleomassaria carpini ex Carpinus betulus








Björn


