Hallo zusammen!
Nun, jede Gattung für sich ist ja relativ speziell. Da gibt es schon Unterschiede, wie und was man anwenden kann an Chemikalien.
Bei Boletus kann man noch ergänzen: Melzer.
Es gibt Artengruppen, deren Hyphen an und in der Stielbasis reagieren amyloid, werden also blau, wenn man Melzer drauf tropft. Das ist nicht immer ideal zu sehen makroskopisch, und der Test muss an frischen Fruchtkörpern durchgeführt werden. Auch muss man darauf achten, nicht gleichzeitig mit dem Aufbringen der Reagenz Druck auszuüben. Weil auf Druck wird es ja auch blau.
Es folgt ein Beispiel, wie das aussehen soll bei einer positiven (amyloiiden) Reaktion auf Melzer, hier bei Suillellus mendax:

Ebenso gute Dienste leistet Melzer ganz global bei allen Gattungen, wenn man die amyloidität von Sporen testen will.
Es gibt ja Gattungen mit amyloidem Sporenpulver und solche mit inamyloiden Sporen. So ist das zum Beispiel ein solides Merkmal, um Lepista inamyloid) von Leucopaxillus (amyloid) zu trennen, oder Melanoleuca (amyloid) von zB Tricholoma (inamyloid).
Ein Beispielbild für amlyoides Sporenpulver (bei Leucopaxillus compactus):
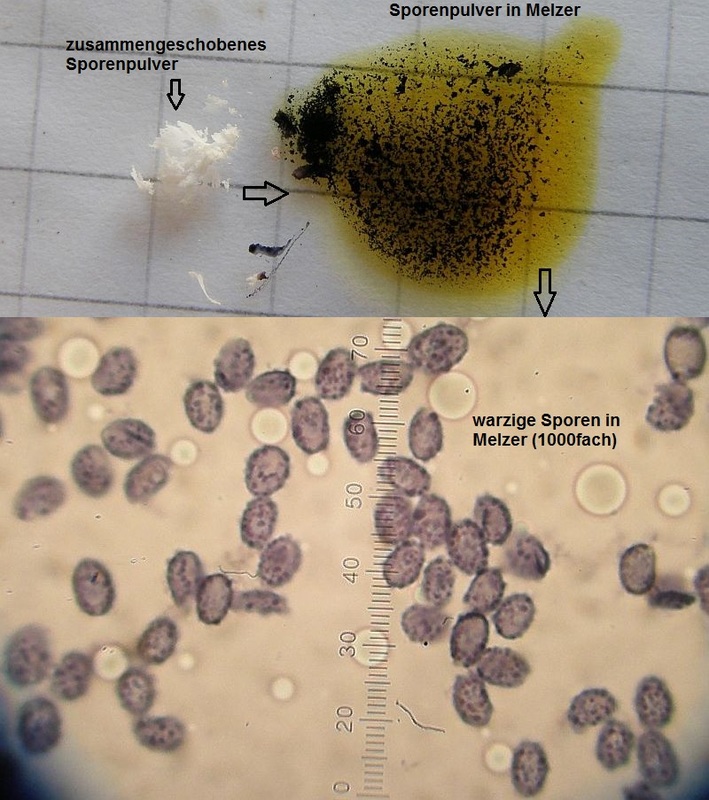
So schön eindeutig ist es nicht immer, es gibt auch Arten mit eher schwach amyloien Sporen. Ein beispiel dazu wäre Leucopaxillus giganteus:

Aber auch da ist es noch makrochemisch gut erkennbar.
Wo es zB nicht mehr funktioniert hat, war Gloiothele citrina. Bei Gloiothele lactescens war es dagegen gut zu sehen.
Wenn amn Pilze mit stark amyloiden Sporen hat, von denen man keinen Abwurf bekommt (weil zB schon vertrocknet), kann man auch mal das Hymenium testen. Funktioniert nicht immer, aber wenn da sehr viele Sporen dran hängen, dann klappt das. Wie hier bei Dentipellis fragilis:
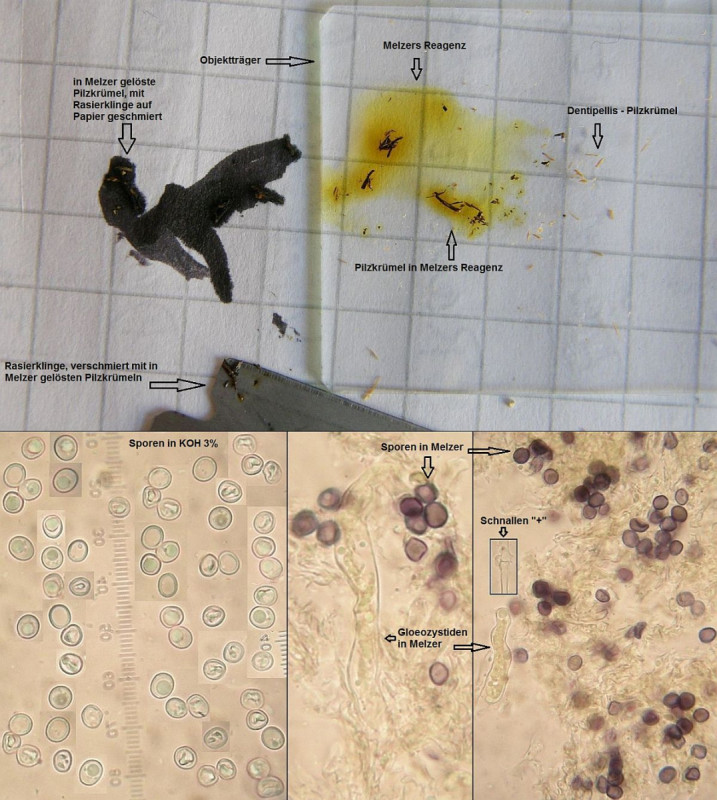
Eine andere Farbreaktion von Sporen mit Melzer wäre "dextrinoid". Da verfärben sich die Sporenwände nicht blau, sondern rotbraun.
Auch das ist makroskopisch nachvollziehbar (wobei ich jetzt aber kein Bild habe, fürchte ich). Kann man aber auch einfach mal prüfen, Leucoagaricus zB hat stark dextrinoide Sporen.
Amyloide und dextrinoide rekationen gibt es nicht nur bei Sporen, sondern auch bei anderen Strukturen wie zB Hyphen.
Stark amyloid sind zB meistens die Hyphen von Cinereomyces lindbladii:

Und oft die von Antrodia xantha und einigen weiteren Antrodias, aber viel schwächer (da ist die Reaktion makrochemisch oft nicht sichtbar).
Es gibt auch dextrinoide Hyphen (analog zu dextrinoiden Sporen), so zB die von Heterobasidium annosum. Auch da kann man oft die Reaktion schon makroskopisch beobachten:

Insofern ist Melzer eben ein Allround - Zaubermittel, mit dem man bei ganz vielen Gattungen ganz unterschiedliche Sachen machen kann.
Auch bei Schleierlingen ist es bisweilen nützlich. So reagieren zB einige Phlegmacien mit Melzer dunkelrot, wie zB hier bei Cortianrius purpurascens:
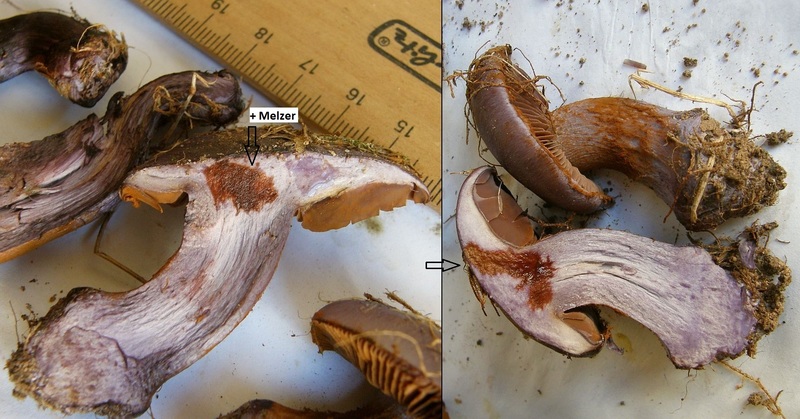
Und Cortinarius scaurus würde das auch so machen.
Für Cortinarius wäre dann aber KOH (mind. 20%) das meistgebrauchte Reagenz, das wird da an drei Stellen aufgetragen: Einmal auf die Huthaut am Hutrand, einmal auf die Trama (mache ich immer im Hutfleisch nahe Hut-Stiel-Übergang) und einmal außen am Rand der Stielbasis.
Eine wunderbare Reaktion am Hutrand hatte ich da mal bei Cortinarius cf olearioides beobachtet:
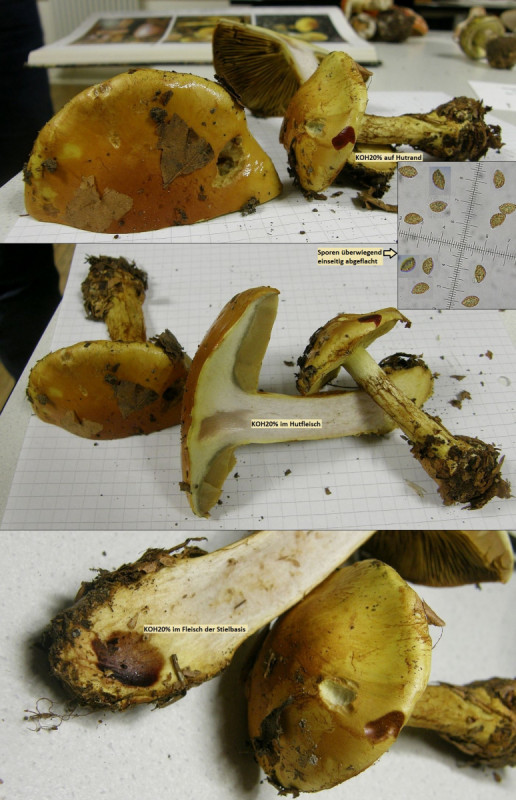
Wogegen zB Cortinarius varius unspektakulär verläuft und nur im Fleisch gelb wird:

Aber auch KOH ist ja ein Wundermittel, man kann es oft und viel gebrauchen, auch bei diversen anderen Gattungen.
Bei Rindenpilzen nehme ich viel niedrigere Dosierungen, da reichen in der Regel 5%, um zu einer Reaktion zu kommen, wie hier bei Phlebia uda:

Auch die rotbraune KOH - Reaktion bei FomPini funktioniert mit 5%iger Lösung:

Bei Stachelingen nehme ich gerne 10% KOH, aber auch da müsste es mit 5% ebenso klappen.
Bei Stachelingen sind dann aber auch die Farbwechsel innerhalb weniger Sekunden interessant, so wie hier bei Hydnellum concrescens:
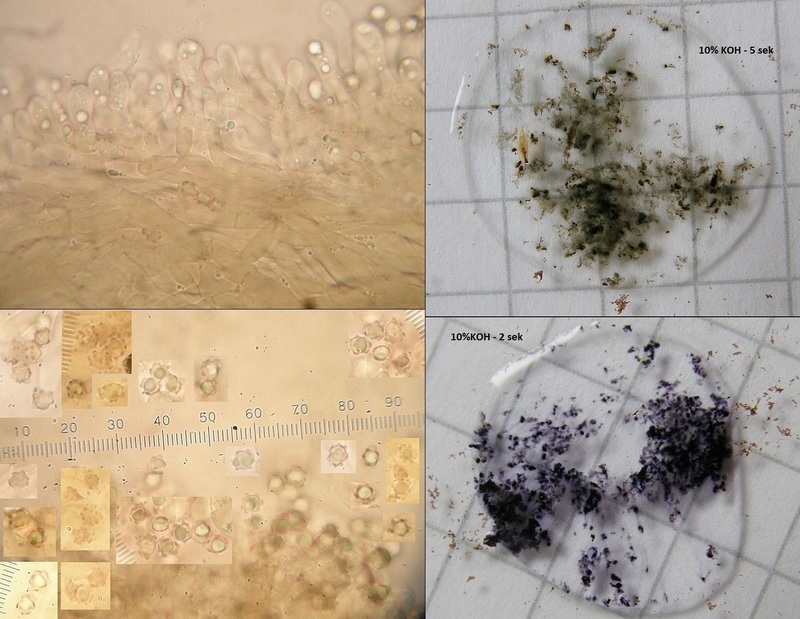
Da muss man quasi schnell sein, beim gucken (und fotografieren).
Wie mit vielem Anderen auch: Man darf sich nicht ausschließlich darauf verlassen. Manchmal machen PIlze komische Sachen. Manches ist auch einfach noch nicht völlig erforscht, wie konstant welche Reaktionen zB sind. So soll sich zB Radulolyces rickii (außer den Sporenform und geringfügig anderen Basidien) auch durch eine gelbe KOH - Reaktion von Radulomyces confluens unterscheiden.
Sieht bei Radulomyces rickii so aus:

Blöd nur, daß auch Radulomyces confluens mal gelblich mit KOH werden kann:

Und das ist auch mit ein Grund, warum ich bei Rindenpilzen nach Möglichkeit die niedrigeren Konzentrationen (5%, maximal 10%) benutze. Sonst kommt man leicht zu falschen Ergebnissen, weil mit 20% KOH ein ganzer Haufen Arten irgendwie reagieren, die es mit KOH5% nicht täten. Solche feinen, putzigen Reaktionen wie das lustige, aber blasse orange bei Fibrodontia gossypina:

...bekomst du mit 20% nicht, da wird die nur irgendwie matschig braun, graubraun, gelbbraun: Und das machen eben mit 20% KOH sehr viele Pilze, die aber mit geringeren Konzentrationen gar nicht reagieren.
So, für heute genug erzählt dazu.
Auch wenn man noch ewig weiter machen könnte...
LG, Pablo.


