Guten Abend!
Denn mal weiter mit ein paar Porlingen.
5.)
Ein Fund vom 23.09.2018
Kaiserstuhl am Nordhang unterm "Totenkopf", Rotbuchenwald auf vulkanischem Löß;
liegender, optimalmorscher Rotbuchenstamm und vergesellschaftet mit Phlebia nothofagi.
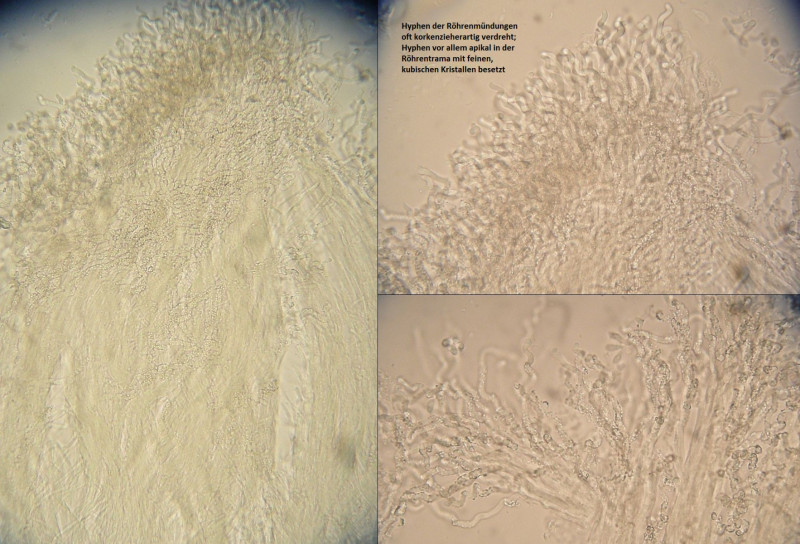
Der Fall sollte eigentlich klar sein, jedenfalls sehe ich keine Alternativen zu Skeletocutis kuehneri, auch wenn die normalerweise eher an Nadelholz wachsen sollte und die Fruchtkörper hier unverhältnismäßig dick und knubbelig sind.
---> Bestimmung von Frank: Skeletocutis odora (hat nix zu tun mit Sidera vulgaris, naturalement)!
Skeletocutis kuehneri demnach an Nadelholz und mit noch etwas schmaleren Sporen





[trennlinie][/trennlinie]
6.)
Nun wird's interessanter.
Die folgenden drei Porlinge stammen allesamt von einer MAK - Exkursion am 27.10.2018
Langental bei Altleiningen / Höningen; ein relativ naturbelassener Talgrund mir recht guter Durchfeuchtung und wechselndem Baumbestand
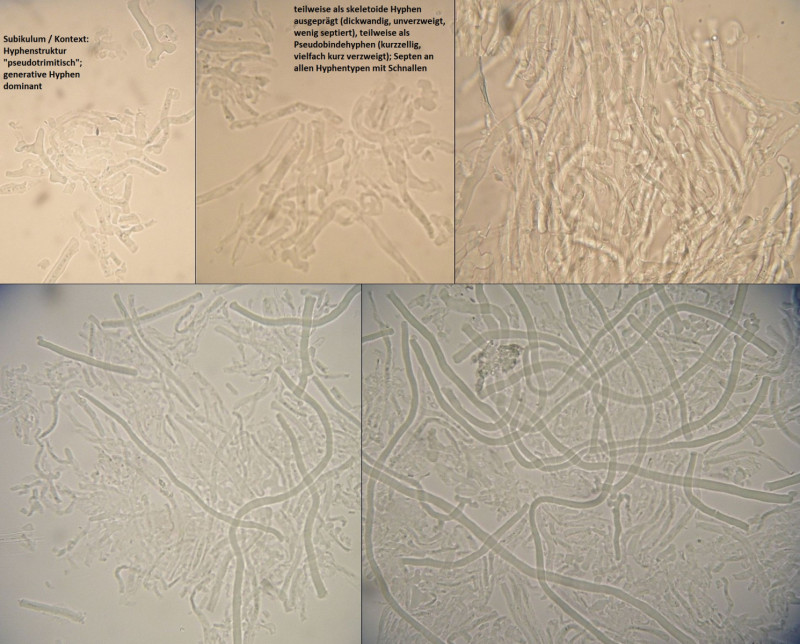
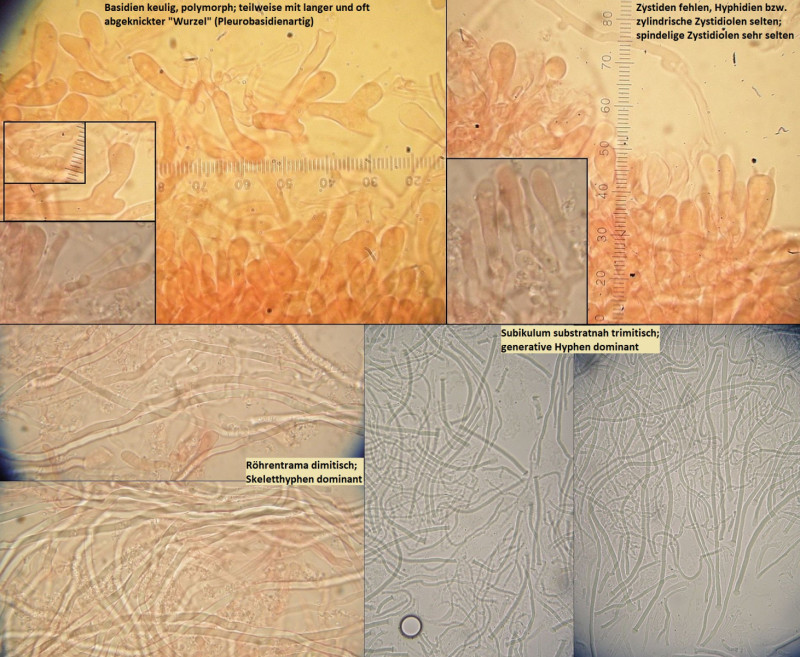
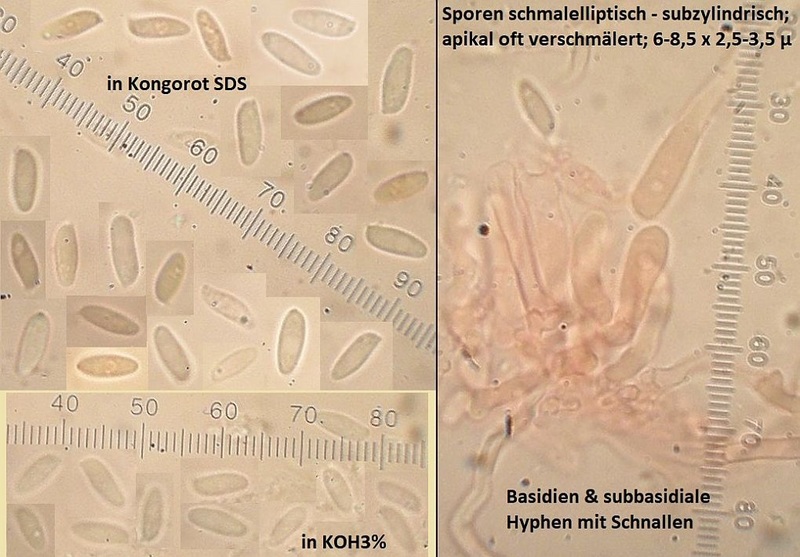
Der erste gehört in die Gruppe von Arten um Antrodia serialis, aber:
Die Fruchtkörper fühlen sich zunächst mal ungewöhnlich an, nämlich in der Haptik im Frischzustand eher wie Rhodonia placenta, warum ich anfangs auch an eine farblose Kollektion dieser Art dachte. Auch im makroskopischen Habitus ist die Ausprägung der Knubbel nicht ganz passend, denke ich, weil auch bei sehr jungen antrodia serialis s.str. schon oberseits blassbräunliche und anders Strukturiete Hutkanten gebildet werden - sobald der Fruchtkörper nicht mehr komplett resupinat wächst.
Mikroskopisch ist das ein schwieriges Pflaster. Nach "Studies in the Antrodia serialis group" von Spirin, Vlasak & Miettinen in Mycologia 2017 käme ich mit dem makroskopischen Aussehen, nahezu fehlenden kristallbeschopften Zystidiolen und zumindest Ansätzen von Bindehyphen im subikulum am ehesten zu Antrodia primaeva, wobei ich die Sporenmerkmale nicht so ganz nachvollziehen kann (auch "typische" Antrodia serialis sind so variabel, daß die da gut passen können).
Ökologisch passt aber Antrodia primaeva nicht wirklich. Das ist halt kein borealer, unberührter Urwald dort...
Also erstmal Antrodia cf serialis, aber schon eiine seltsame Kollektion und wie weit Antrodia primaeva wohl tatsächlich verbreitet ist, und ob immer und überall sauber von Antrodia serialis s.str. getrennt...?
---> Bestimmung von Frank: Antrodia serialis
Wenn auch makroskopisch etwas wunderlich ausgeprägt, was man dem Pilz aber durchaus mal zugestehen sollte in so einem ungewöhnlich trockenen und warmen Jahr.




[trennlinie][/trennlinie]
7.)
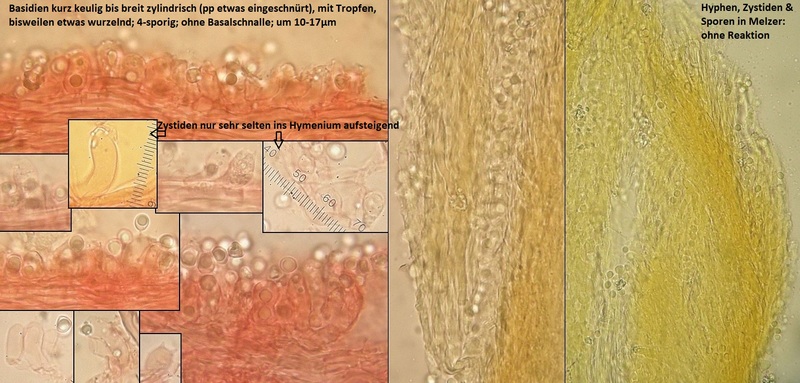
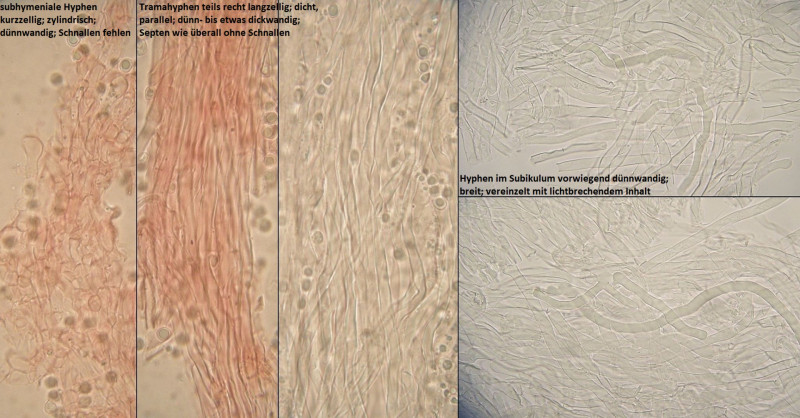
zwei Wochen vor der MAK - Exkursion war ich schon mal mit Freunden in dem Tal unterwegs. Der Folgende Porling fiel mir da auch auf, aber wir waren schon auf dem Rückweg und beim Kratzen wurde es dann auch zögerlich rötlich / rotbraun, also habe ich den mal einfach makroskopisch als Physisporinus sanguinolentus links liegen gelassen. Bei der MAK - Exkursion dann wieder kurz gekratzt, kein Röten mehr feststellbar und irgendwie sah der stellenweise schon komisch aus.
Also eingepackt und reingelinst, und tja... Zystiden soll halt Physisporinus nicht haben. Bei Oxyporus sind die Zystiden eher hymenial ausgeprägt und die Farbverläufe sind anders. Also Rigidoporus, und dann wirds heikel.
Das Substrat ist unbestimmt, ein stark verrotteter Baumstumpf im Talgrund, ziemlich feucht, Laubholz, würde ich sagen, Erle wäre naheliegend, aber das ist Spekulation.
Nach Vampola & Vlasak in Czech Mycology 2012 bin ich irgendwie bei Rigidoporus pouzarii hängen geblieben. Auch, weil Makroaufnahmen in der Erstbeschreibung einfach so gut passen. Was nicht ganz passt, sind die Sporengrößen; bei Rigidoporus undatus und R. ulmarius hatte ich aber auch jeweils irgednwelche Porbleme. Kein Wunder, das sind alles ziemlich seltene Arten, zu denen man kaum schöne Dokumentationen findet.
Also als persönlicher Arbeitstitel erstmal Rigidoporus cf pouzarii.
Bestimmung von Frank: Physisporinus vitreus
Oha. Demnach hatte ich bisher nur deutlich jüngere Kollektionen untersucht, und die Ausprägung der zystidenartigen Elemente darf nach Ryvarden wohl fakultativ so vorkommen. Interessant, macht aber die Erkennung einiger Rigidoporus - Arten nicht unbedingt leichter.






[trennlinie][/trennlinie]
8.)
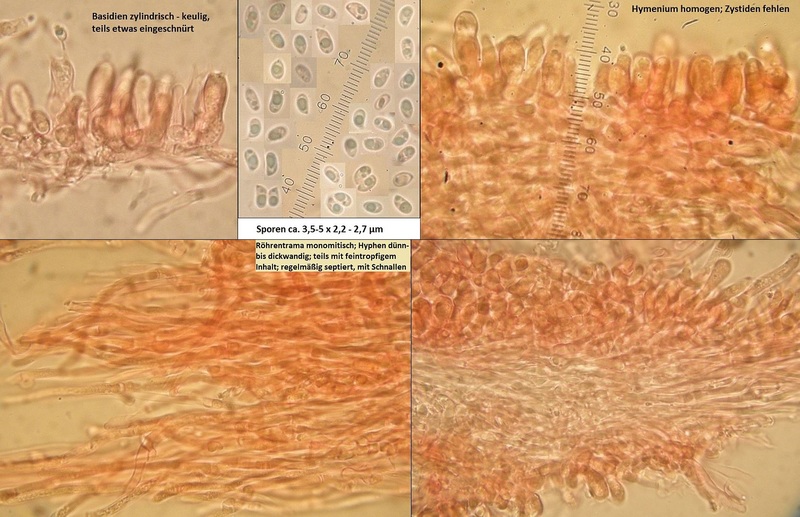
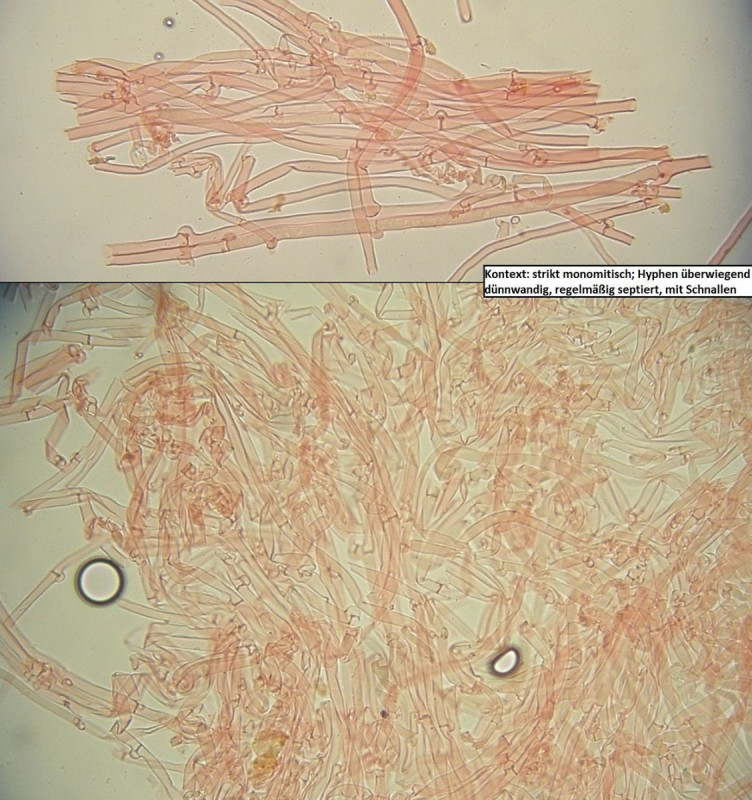
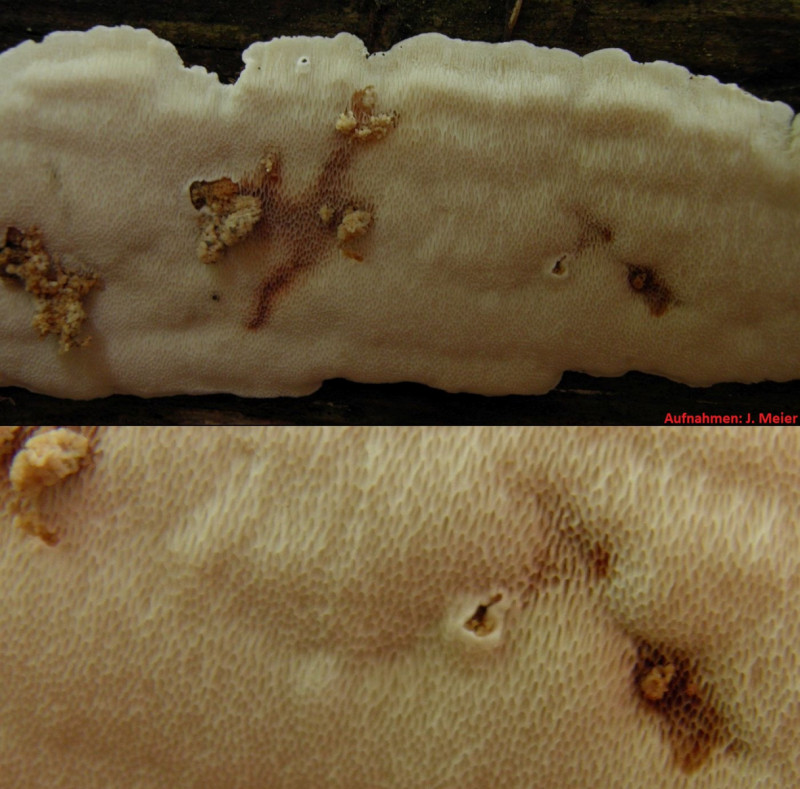
Der Dritte von der Exkursion am 27.10, auch unten im Talgrund, diesmal oben auf einem liegenden, stark morschen und teils bemoosten Nadelholzstamm.
Den würde ich im Grunde ziemlich sicher für Oligoporus floriformis halten, auch wenn die Fruchtkörper oberseits etwas komisch ockerbraun sind.
Der hat - vor allem mikroskopisch - aber seine Tücken, und sieht durch die Linsen ja aus wie...
...aber erstmal zum Oligoporus floriformis aus dem Langental im Pfälzer Wald.
Bestimmung von Frank: Passt, trotz ungewöhnlich brauner Färbung, was aber bei dem wohl beim Antrocknen passieren darf, und Trockenheit gab's da ja mehr als reichlich.





[trennlinie][/trennlinie]
9.)
Mikroskopisch erinnert mich das total an zwei Funde, die ich zugeschickt bekommen habe. Und zwar der erste mal von Beli 1, den ich hier nochmal im Bild zusammenfassen will.
Also Belis von vom 06.09.2018;
Gaden bei Waging am See, an liegendem "Zaunpfahl" in einem Waldstückchen.
Da bleibe ich schon wieder irgendwie bei Tyromyces cf wakefieldiae hängen. Interessant, daß der sich von Oligoporus floriformis mikroskopisch kaum unterscheidet, sondern vorwiegend durch Farbverläufe, Fäuletyp und eine möglicherweise etwas andere Konsistenz.
Die Aufnahmen vom Frischmaterial sind von Beli, habe ich nur mal ein wenig "zusammengefasst".
---> Bestimmung von Frank: Oligoporus balsameus
Hatte sich ja schon angedeutet, siehe weiter unten wegen übersehenen Zystiden.







Mikroskopisch erkenne ich als einzigen, signifikanten Unterschied die durchgehend (in Kontext und Trama) überwiegend dickwandigen Hyphen, sowie makroskopisch eine etwas andere Haptik und ein anderes spezifisches Gewicht im Exsikat, nach den Bildern fällt auch eine andere Farbgestaltung der frischen, vitalen Fruchtkörper auf.
Kann natürlich trotzdem sein, daß beides das Gleiche ist, aber irgendwie glaube ich schon, daß 8.) und 9.) zu verschiedenen Arten gehören.
Zu 9.) gehört meiner Ansicht nach übrigens noch ein anderer Pilz, den ich vorletztes Jahr zugeschickt bekommen hatte, und den ich fast schon wieder vergaß.
Und zwar das, was Matthias >im Nachbarforum< gefunden hatte. Die Angabe des Finders zur Größe ("30cm") müsste man in Gedanken wohl mit einem "cf" versehen, das Stückchen Pilz, das ich habe, lässt doch auf einen etwas kleineren Pilz schließen. Mikroskopisch ist es ein Zwilling von Belis Fund, farblich können die Frischen Pilze jeweils schon Extremausprägungen von unterschiedlichen Enden der Variationsbreite einer einzigen Art sein.
---> Bestimmung von Frank: Da passt Tyromyces wakefieldiae.
[trennlinie][/trennlinie]
10.)
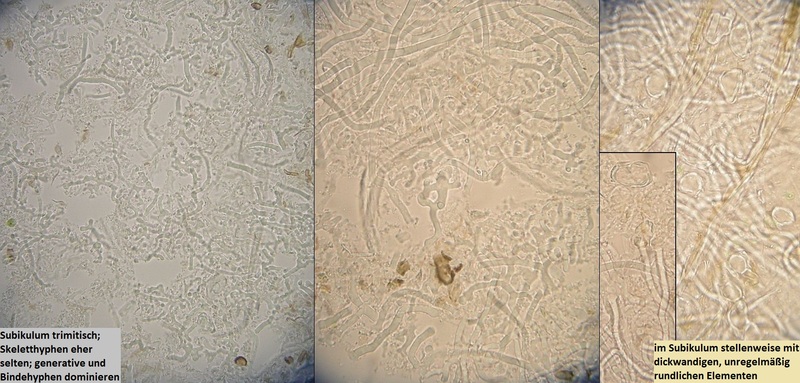
Also, einer wäre da noch, den mir Joe geschickt hatte, nur leider fürchte ich fast, daß der seine Identität nicht presigeben wird, ohne mehr über Substrat und Begleitpilze zu erfahren (von denen wir nichts wissen). Die Gattung ist ziemlich klar, es ist eine Antrodiella spec., aber nach etlichen Stunden, die ich mit der kleinen Gattungsmonografie von Miettinen, Niemelä und Spirin in Mycotaxon 2006 gekämpf habe, ist mir der Kopf geplatzt, und ich schwimme verwirrt zwischen diversen Arten, die sich teils nur anhand Wirtspilz, Nuancen in den Hyphenstrukturen und Sporengrößen und Formen unterscheiden. Details, die schweirig zu beurteilen sind, ohne entsprechende Arten schon mehrmals selbst beobachtet zu haben.
---> Einschätzung von Frank: Antrodiella spec.
Macht makroskopisch den eindruck einer Antrodia, gehört mikroskopisch aber zu Antrodiella. Durchaus wunderlicher Fruchtkörper, der aber vermutlich unbestimmbar bleiben wird.


[trennlinie][/trennlinie]
Das also wären für's erste die übriggebliebenen Probleme des letzten Jahres...
Vielleicht können wir da was rausreduzieren, Frank, was nicht zwingend untersucht werden muss (weil zB schon nach Bildern absehbar, auf was es hinausläuft oder weil absehbar, daß keine morphologische Bestimmung möglich ist).
Andere Problemfälle sammeln sich leider schon wieder an, aber manchmal klären sich Funde auch auf, wenn man sie etwas sacken lässt und dann nochmal unvoreingenommen beobachtet. Pilze brauchen halt auch Zeit.
Lg; pablo.


