Hallo Pablo!
Ui, dein Vorschlagpilz zum Vergleichen (Perenniporia medulla-panis, Ockerfarbener Dauerporling) gleicht meinem Fund tatsächlich über weite Strecken!
Neben der übereinstimmenden Sporen- und Wuchsform erinnern mich auch das Hyphenwirrwar sehr an meine Mikroskopiererfahrung mit dem Pilz.
An eine so kräftige Braunfärbung in Lugol kann ich mich nicht erinneren, muss ich noch mal ausprobieren.
Bei der Gelegenheit messe ich auch mehr Sporen!
So getan: Sporenmaße liegen bei 4,8-5,5-6,2 x 3,5-4,0-4,5, Q = 1,4, N = 22 (50% in KOH, 50% in Lugol gemessen, hier etwa 0,1µm im Mittel kleinere Maße).
Die Abmessungen stimmen mit denen von P. medulla-panis gut überein.
Die alten Poren von P.m.-p. verfärben sich schwärz. Passt auch.
Sehr dünnes Subiculum sehe ich in Bildern N2. Passt
Dimitisches Hyphensystem - wenn ich die dickwandigen Hyphen mitzählen darf, passt das auch.
Schnallen konnte ich allerdings keine finden! - Vielleicht übersehen...
Arboriforme vegetative Hyphen? - Nicht gefunden...
Arboriforme Skelett-Bindehyphen? - Fehlanzeige.
Hmmm...
Die Sporen sind definitiv inamyloid und indextrinoid.

Bild Lugol 1
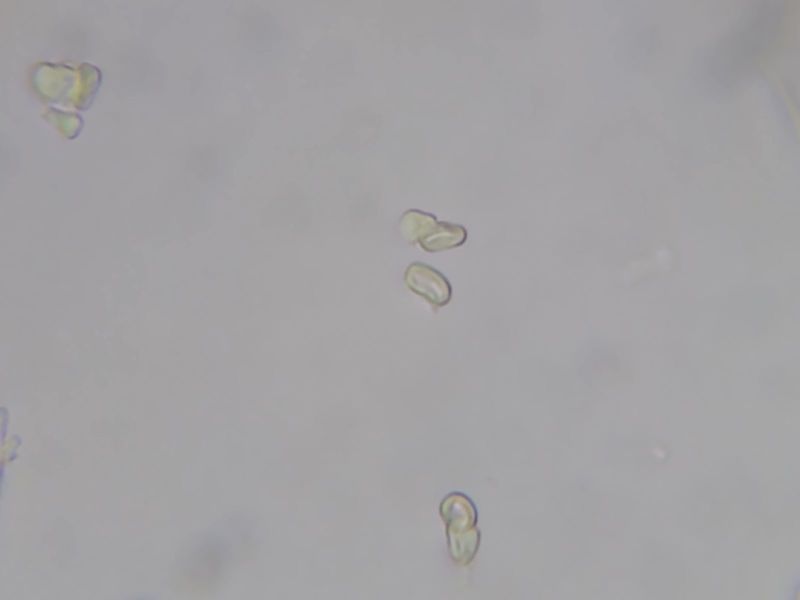
Bild Sporen in Lugol => inamyloid, indextrinoid
Querschnitt durch Poren mit Sporenpfropfen in Lugol, Sporenmasse bleibt gelb.
Nach dem Trocknen wirkt die Lugol-benetzte Schnittfläche des Porlings silbergrau, sicher nicht blau oder violett.
Wenn überhaupt färben sich die Hyphen ganz leicht grauviolett:

Bild im Makroskop nach Lugol, leichte violette Töne erkennbar

Bild 20% KOH => Hyphen gelb, Sporenmasse braun
Dickwandige Hyphen konnte ich mittlerweile entdecken.
Die geschwollenen, bauchigen, zystidenartigen Strukturen konnte ich heute (in KOH) in großer Zahl entdecken.
sie befinden sich immer in der Nähe der gelben Sporenpfropfen, also vermutlich im Hymenium.
Nach Basidien sehen sie mir allerdings nicht aus, Sterigmen sind nicht ansatzweise zu erkennen.
Sie wirken birnenförmig (vgl Bild N6) bis flaschenförmig (vgl. Bild N7), auch sehr langgezogen, mit allen Übergangsformen, teile auch mit einer Art schmaler Platte oder einem Haken am oberen Ende. Allesamt wirken sie recht dickwandig (Bilder Z1-5 unten).
In Hyphengewebe lassen sich immer wieder große Kristalle finden (Bilder Z6).
So ganz passt P. medulla-panis wohl nicht, aber er kommt der Sache vielleicht nahe.
LG, Martin
Bilder:
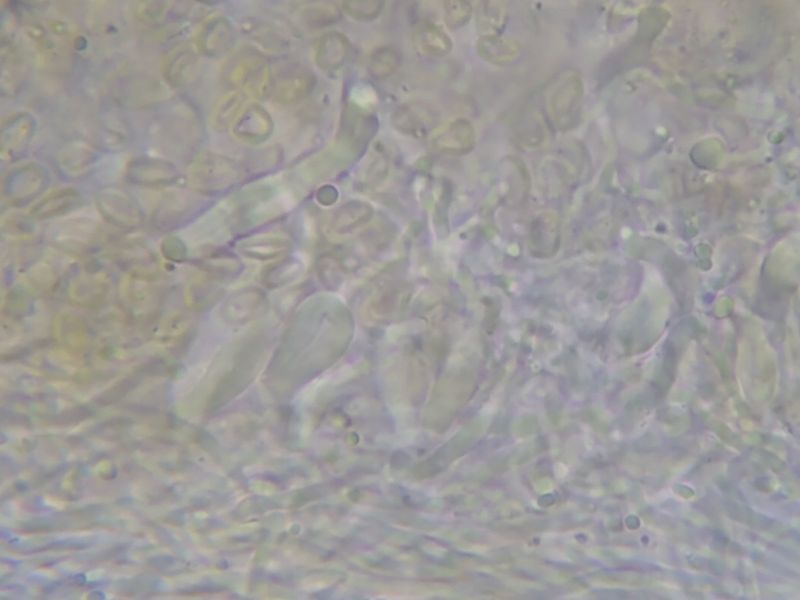
Bild Z1
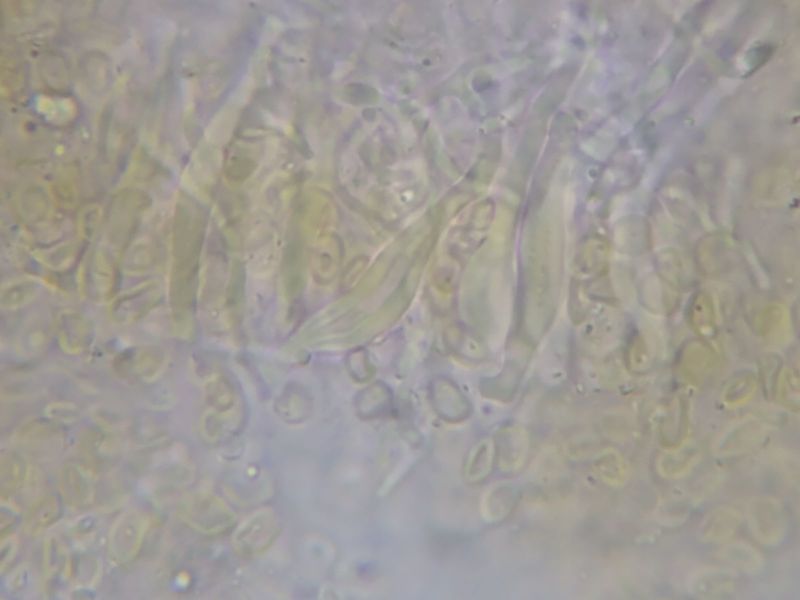
Bild Z2
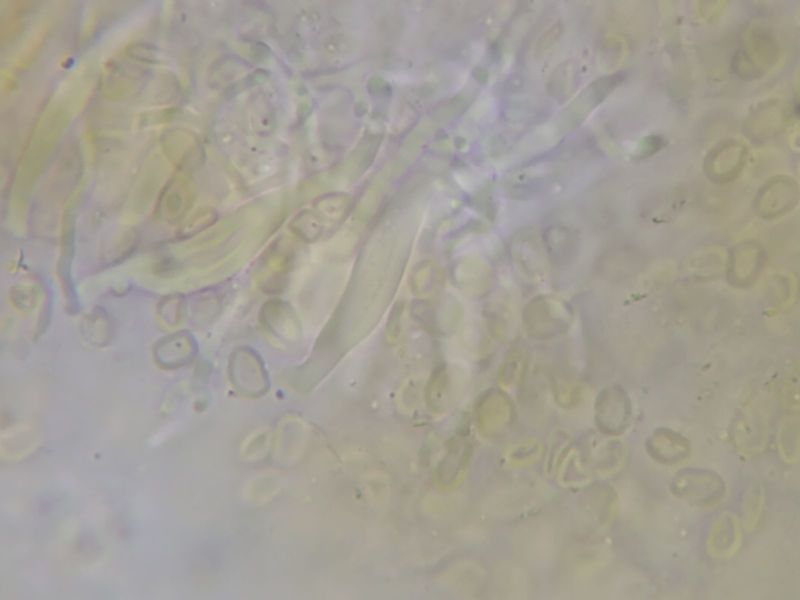
Bild Z3
20220222 181703106 KOH_autoscaled.jpg
Bild Z4
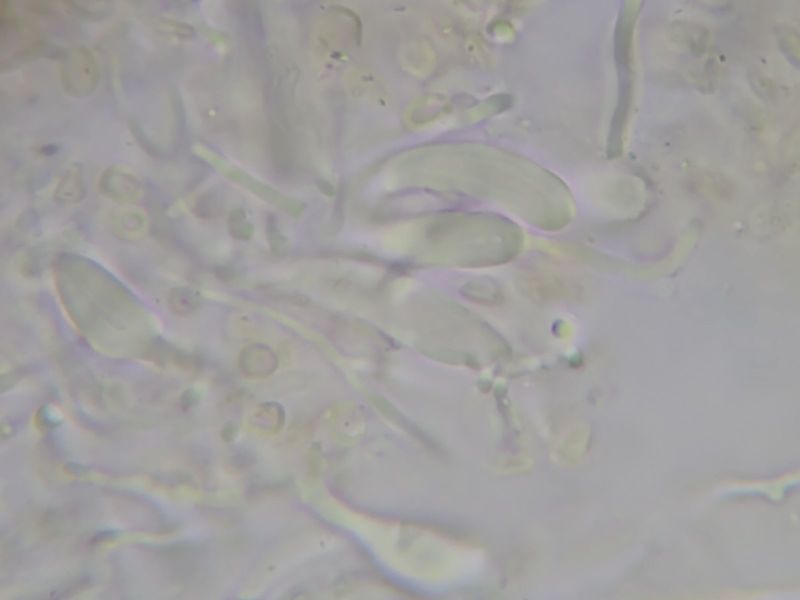
Bild Z5
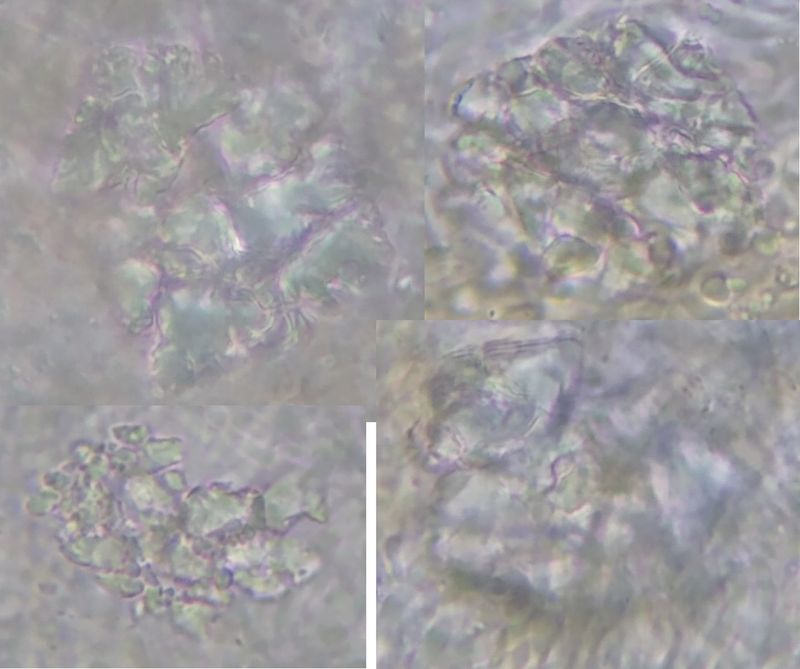
Bild Z6 Klumpen im Hyphengeflecht (Kristalle)


