Hallo Andreas,
super, vielen Dank für den Hinweis auf nemorensis, den hatte ich so nicht auf dem Schirm und Vergleichsbilder könnten tatsächlich in diese Richtung weisen. C. variecolor hatte ich ausgeschlossen, weil ich auch bei den jungen Fruchtkörpern keinerlei lila in den Lamellen gefunden habe. Vielleicht hätte ich dann aber noch ein Babystadium finden müssen für das Lila? Den jüngsten Fruchtkörper den ich dort finden konnte war der auf Bild 4, wo man das Velum noch schon sieht. Der hatte aber keinerlei Lila in den Lamellen. Eher Cremefarben, auch am Hutrand. Deswegen wäre die Frage an die Gattungsspezialisten: Ist es wahrscheinlicher das nemorensis (in diesem Stadium) mit solchen Lamellen daherkommt oder das C balteatocumatilis mit solchen Hutfarben daherkommt. Ich denke es wird dann auf C. nemorensis hinauslaufen, die Hutfarben und Strukturen passen da schon sehr gut. Und der gezeigte in dieses Aggregat (das man das hier so sagen - also in diesen "Kreis" in dieser Sektion) gehört, ist glaube ich unbestritten. Dafür sind die chemischen Reaktionen ja ganz deutlich.
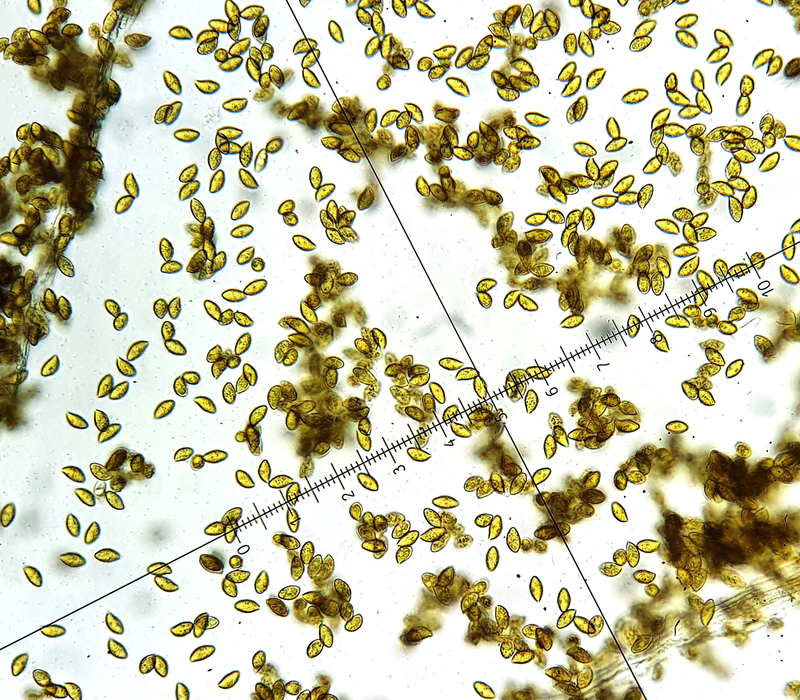
Bei der Sporenform muss ich mich in deinem Sinne korrigieren, tatsächlich gibt es vereinzelt Sporen die eher zitriform daherkommen, habe aber heute morgen nochmal Cortina vom Stiel (und damit reife Sporen) unters Mikroskop gelegt. Und da kann man im Überblick sehen das der weit überwiegende Teil amygdaliform daherkommt. Letztlich schließt das aber auch nichts aus. Ludwig beschreibt das genauso für Largus beispielsweise: "mandelförmig, vereinzelt sublimoniform". Finde die Abgrenzung zwischen sublimoniform und subfusoid (das wiederrum ist für variecolor beschrieben) ziemlich schwierig.
Also, die Sporenform finde ich zur Abgrenzung schwierig, dann eher Sporengröße (reife hier regelhaft 11x6, gelegentlich 10x5,5), die hier eigentlich auch balteatocumatilis ausschließt. Da sollten sie etwas kleiner sein (regelhaft 9-10,5 nach Ludwig).
@ Günther: zum Vorkommen hatte ich ja oben beschrieben "in einem großen Hexenring". Das wirklich sehr viele Fruchtkörper, die dann immer wieder auch an manchen Stellen mit mehreren Fruchtkörpern zusammenstanden in diesem deutlichen Hexenring.
Geruch fand ich schwierig. Erdig würde ich den jedenfalls nicht nennen. Am Fundort war der Geruch eigentlich gar nicht zu erkennen, weil die "kalten" Fruchtkörper nichts hergeben (das Phänomen kenne ich aber). Nach antauen war ein leichter, für mich aber schlecht zu definierender Geruch vorhanden. Heute ist der aber auch kaum noch nachzuvollziehen, nach einem Tag liegen eher muffig.
Herzliche Grüße
Sebastian


