Wenn die Pilze einfach die Bücher nicht lesen, dann erscheint auf einmal Pluteus romellii, der gelbstielige Dachpilz mit großen, prächtigsten Fruchtkörpern mitten im März und dann auch noch auf dem Boden:






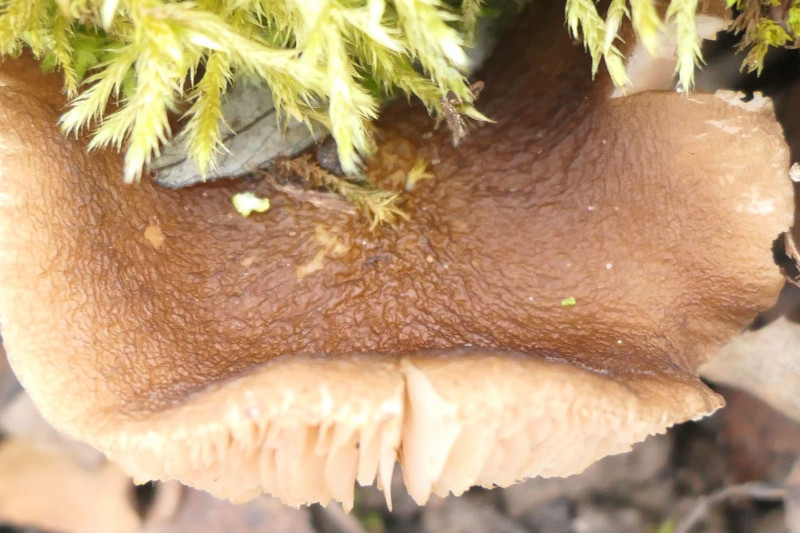
und noch ein Küken:

Sporen:

Cheilos:



HDS
Beschäftigt hat mich allerdings eher eine Psathyrella - der habe ich jetzt mal den Arbeitstitel P. salina gegeben, aber mit einem ganz dicken CF.
Vielleicht wisst ihr etwas, hier die Details
Am Rande des Kies-Sees, im Sand bei Pappel und Weide folgende Fruchtkörper:



Hüte ein blasses braun, stark hygrophan, der große Fruchtkörper knappe 3cm.
Lamellen ohne farbige Schneide.
Stiele erwartungsgemäß stark brüchig.
SPP im Abwurf schwarz, auf Objektträger im Gegenlicht dunkel tabakbraun.
Mikroskopisch:
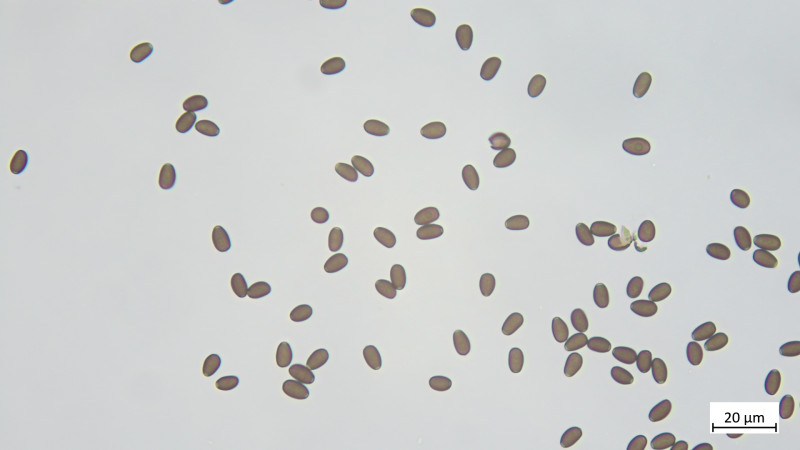
Sporen (in KOH3%) ellipsoid bis angedeutet apfelkernförmig: 7,5-8,8 µm (av. 8,2 µm, SD 0,3 µm) x 4,6-5,4 µm (av. 4,9 µm, SD 0,2 µm); Q = 1,5-1,8 (av. 1,7, SD 0,1)(n = 25)
Prominenter Keimporus mit ca. 2µm


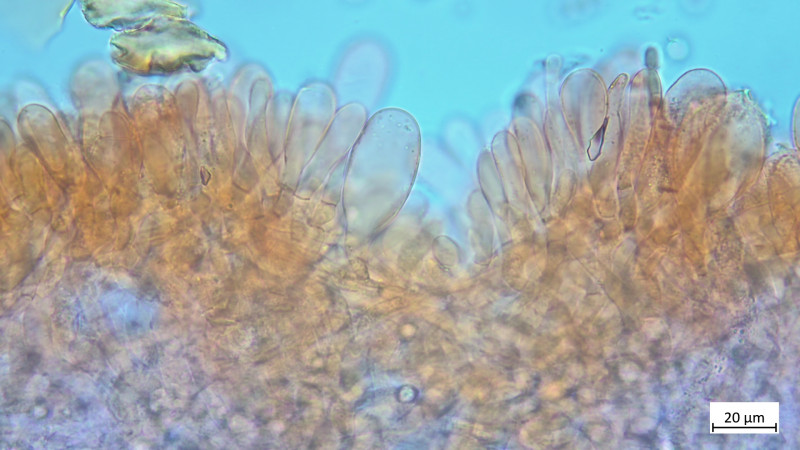
Cheilozystiden und Parzystiden:

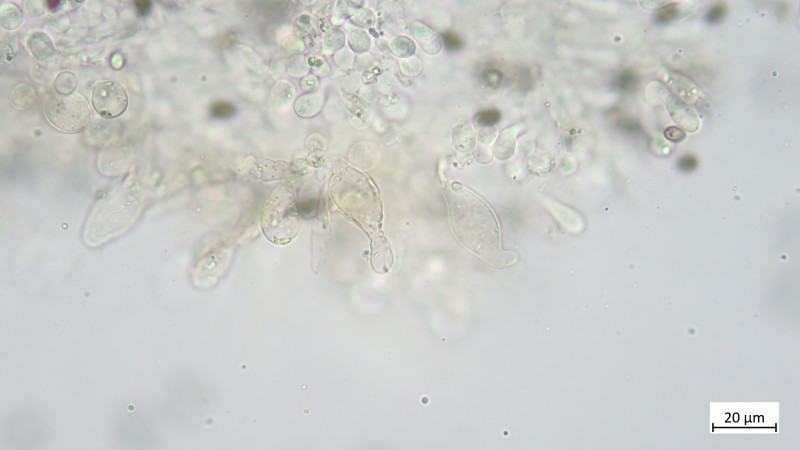

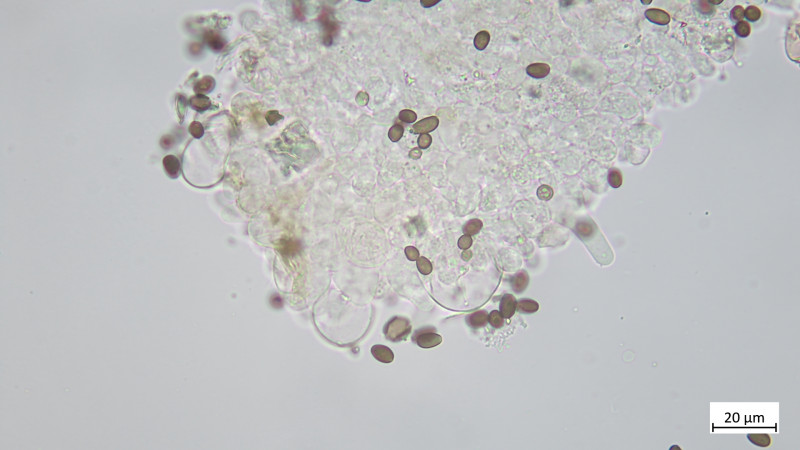
Ansonsten zahlreiche Cheilos auch Doppelköpfig
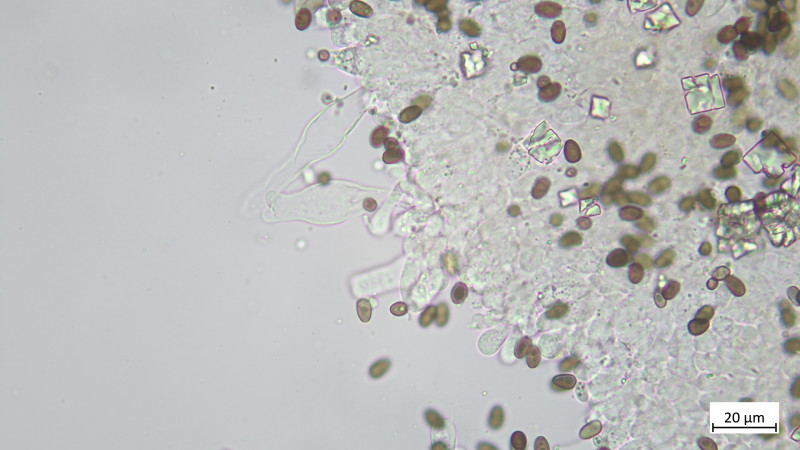


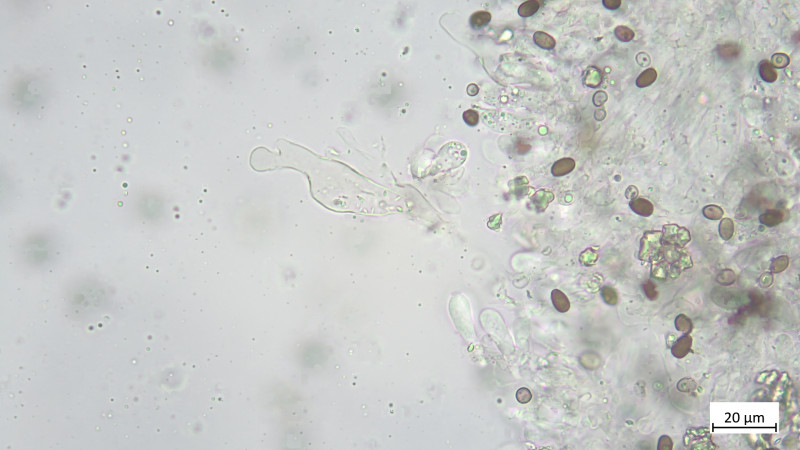
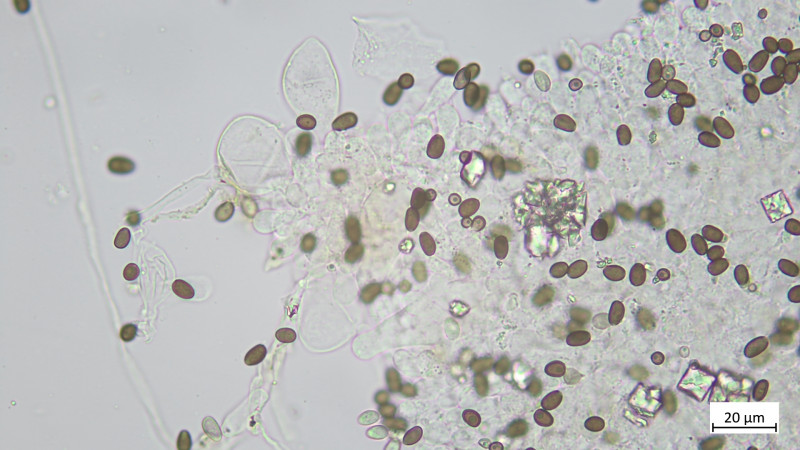
Pleurozystiden vorhanden, lageniform, apikal oft abgeflacht:

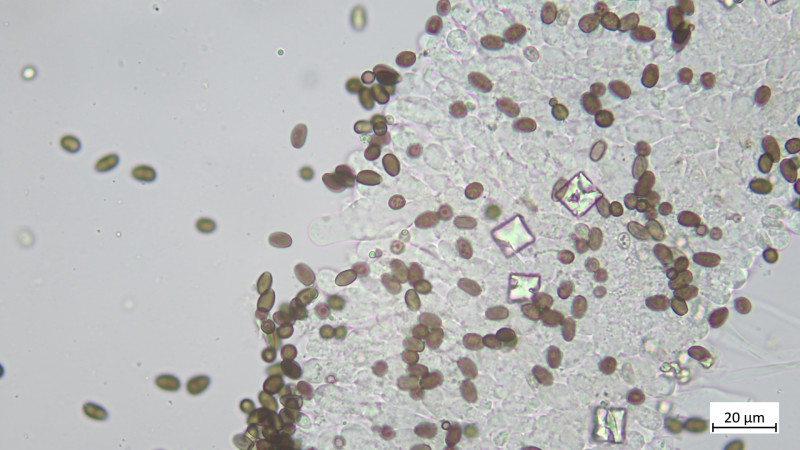

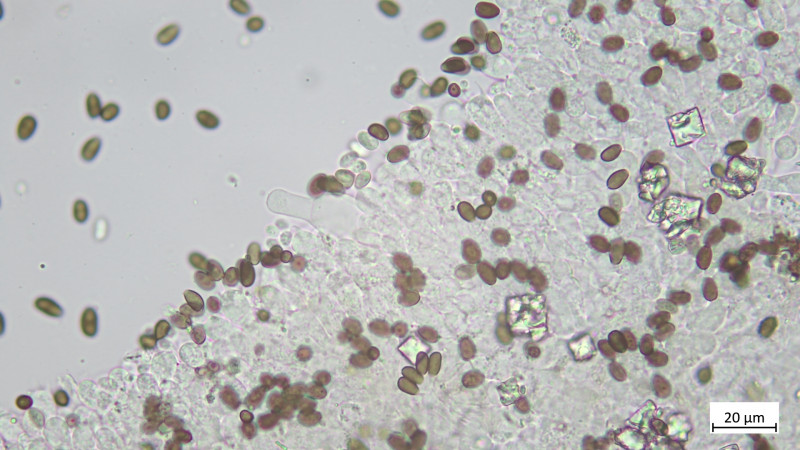

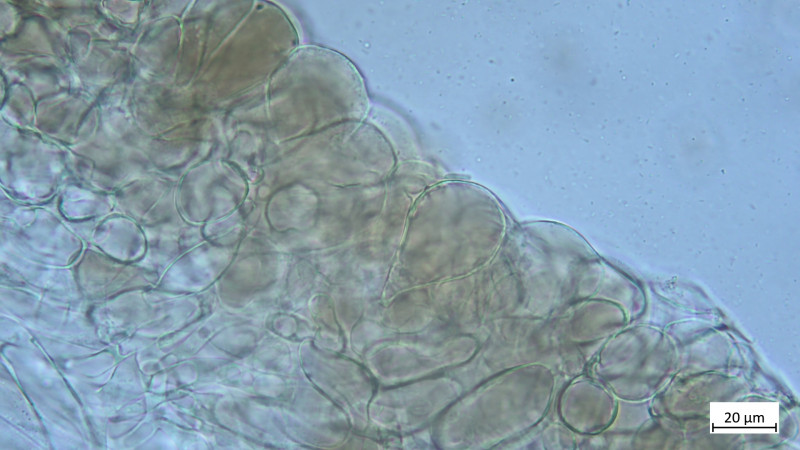
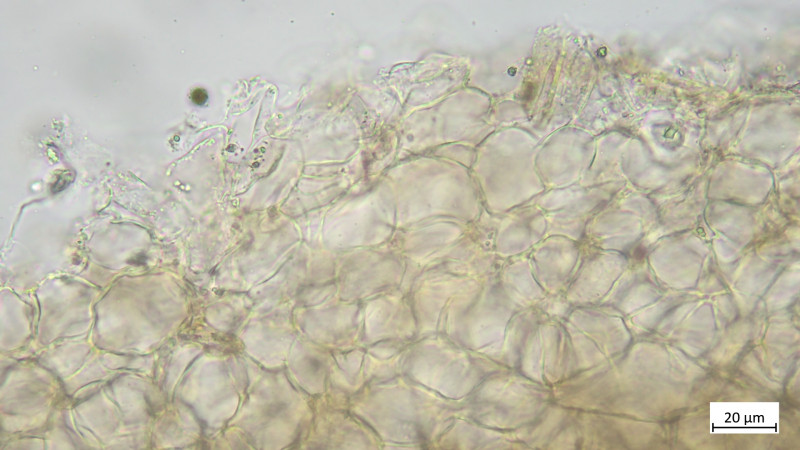
Huddeckschicht aus meiner Sicht rein zellig:

Tja, im Ludwig habe ich die "Sandarten" abgegrast, in der Hoffnung so vielleicht schon schnell zu einem Ergebnis zu kommen.
Psathyrella ammophilia passt aber nicht, da die Sporen bei dieser Art größer (deswegen scheidet auch halophila und flexispora aus)
Psathyrella dunensis hat wohl Sporen mit kleinerem Keimporus
P. dunarum könnte vielleicht noch passen, zu diesem habe ich ein Portrait von Melzer verglichen, da im Ludwig nicht abgebildet:
https://www.zobodat.at/pdf/OestZPilz_19_0013-0017.pdf
Aber diese doppelköpfigen Zystiden habe ich in dem Portrait auch nicht gefunden.
P. seymourensis hätte wohl als Sandart kräftiges Velum. Das war hier nicht der Fall. Eher spärlich, auch bei dem ganz jungen Exemplar.
Mit dem Schlüssel von Melzer lande ich am ehesten noch bei Salina (allerdings zeigt mein Fund keine Auflagerungen auf den Zystiden, was dann wieder sehr verunsichert, Ökologie könnte passen)
Diese doppelköpfigen Zystiden habe ich in den Abbildungen bei Ludwig (Strohhalm  nur bei suavissima gefunden. Das passt aber die Ökologie nicht. Sowie bei niveobadia, dass passt auch überhaupt nicht, schon von den Sporen passt dies nicht.
nur bei suavissima gefunden. Das passt aber die Ökologie nicht. Sowie bei niveobadia, dass passt auch überhaupt nicht, schon von den Sporen passt dies nicht.
Nun ja, alles sehr unzufriedenstellend mit diesen Faserlingen, vielleicht habt ihr noch eine Idee?
Ansonsten gabs noch viel Gewöhnliches, aber schönes nach langer Flaute:
03 Pholiotina aporos - der Frühlingsglockenschüppling zeigt sich endlich:

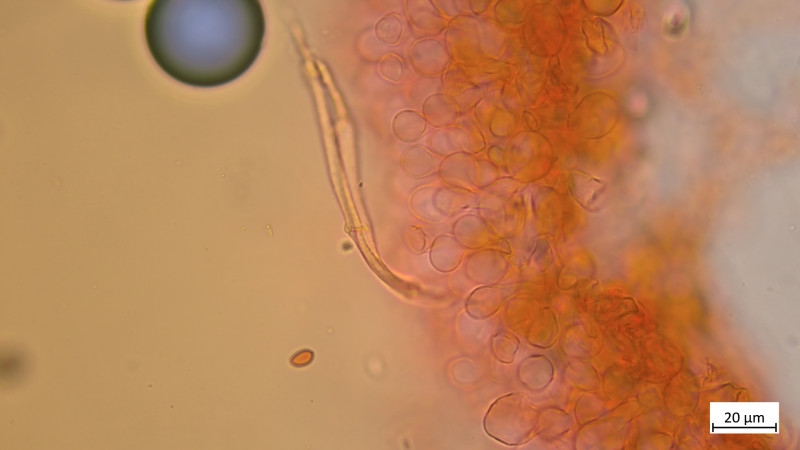
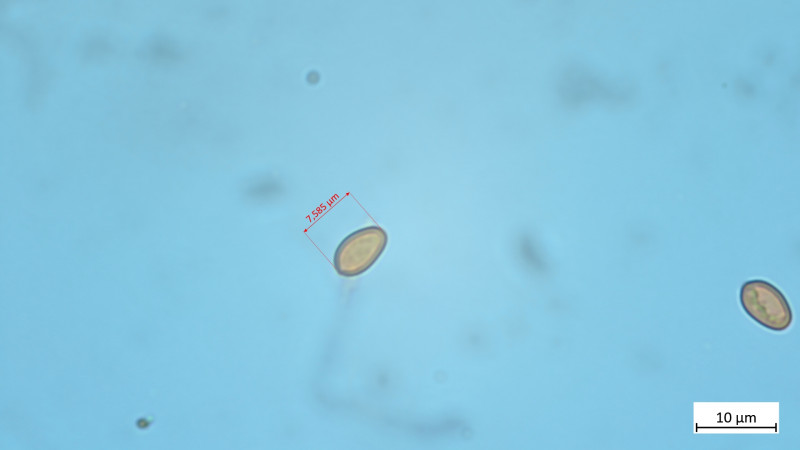
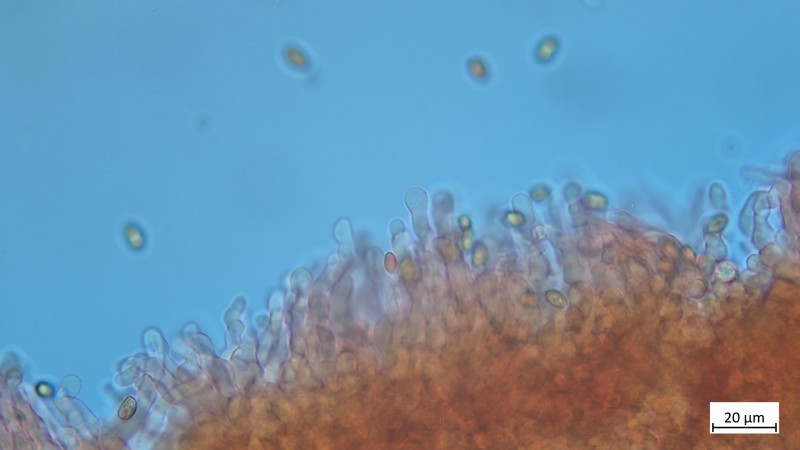
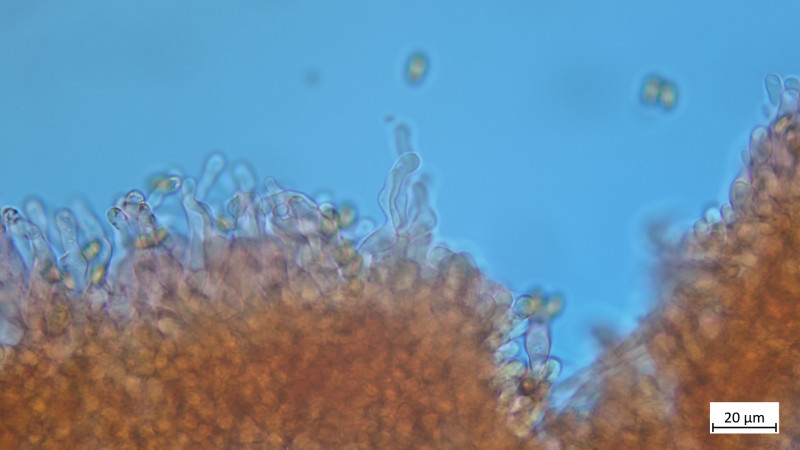
04 Tubaria furfuracea

05 Judasohren in rauhen Mengen:

Schleimpilze, leider aus Zeitgründen nicht weiter untersucht, aber hübsch:

Noch etwas Kleines, bei dem ich noch keine Chance hatte ... an Laubholz:

Und Kiefernzapfenrüblinge:

So genug vom Spaziergang, freue mich, dass es nun wohl wieder losgeht!!!
Gruß Sebastian


