Hallo zusammen,
Ende Oktober war ich mal wieder in den Borkenbergen unterwegs. Auch wenn das Pilzwachstum nicht überragend war, kam am Ende doch eine ganze Menge von Arten zusammen:
1. Russula recondita, IIc, Guajak nach 8 Sekunden verfärbend, dann dunkelblau, Stielbasis ohne KOH-Reaktion, unter Eiche



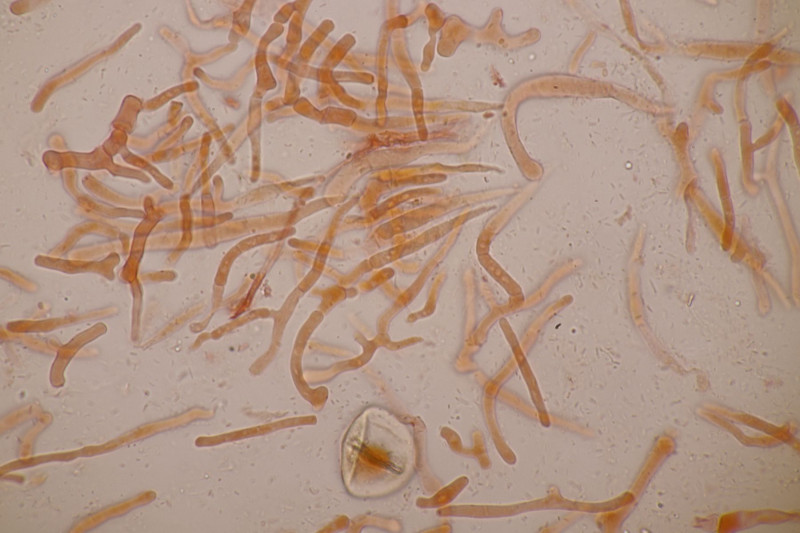
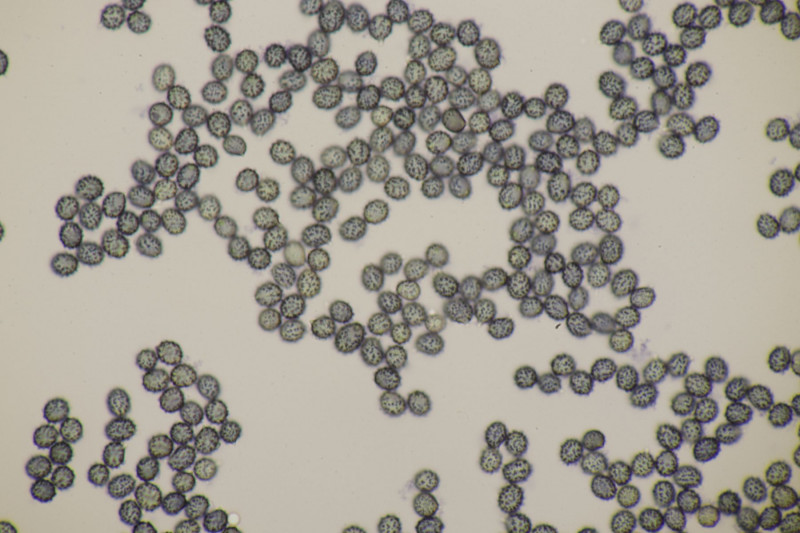

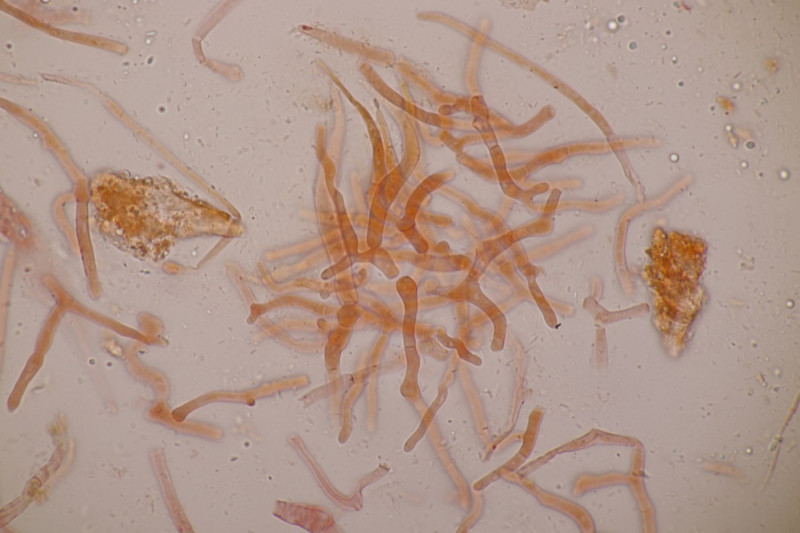

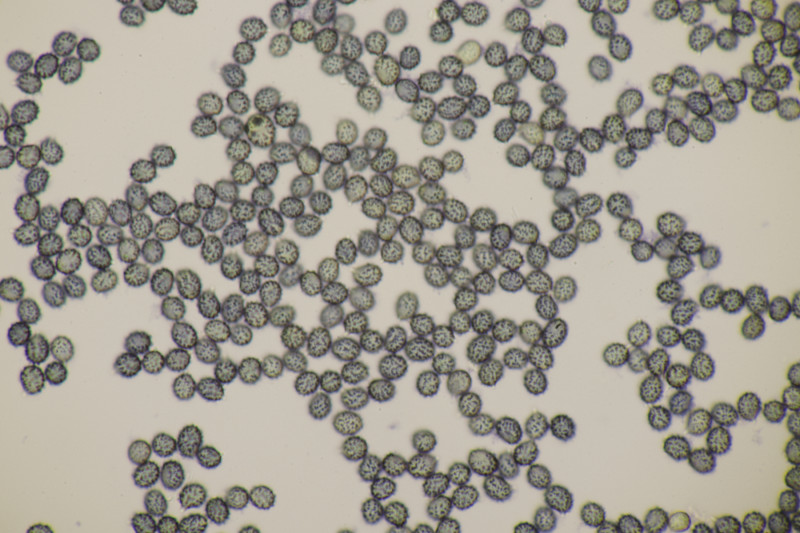
2. Arrhenia retiruga


3. Amanita phalloides


4. Arrhenia rickenii

5. Omphalina pyxidata

6. Macrolepiota procera


7. Spilopodia nervisequa ex Plantago lanceolata

8. Lepista nuda

9. Hygrocybe conica

10. Ein kleiner Täubling bei Betula und Pinus. Guajak negativ, Sporenpulver IVa, leicht scharf, gilbend, nicht grauend, lange, septierte Pileozystiden. Ich schwanke zwischen Russula cessans und Russula versicolor. Was sagen de Täublingsexperten?

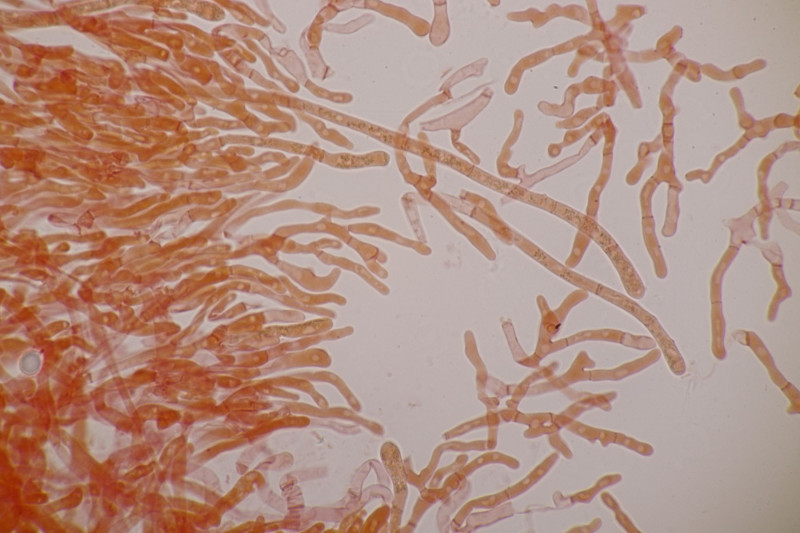
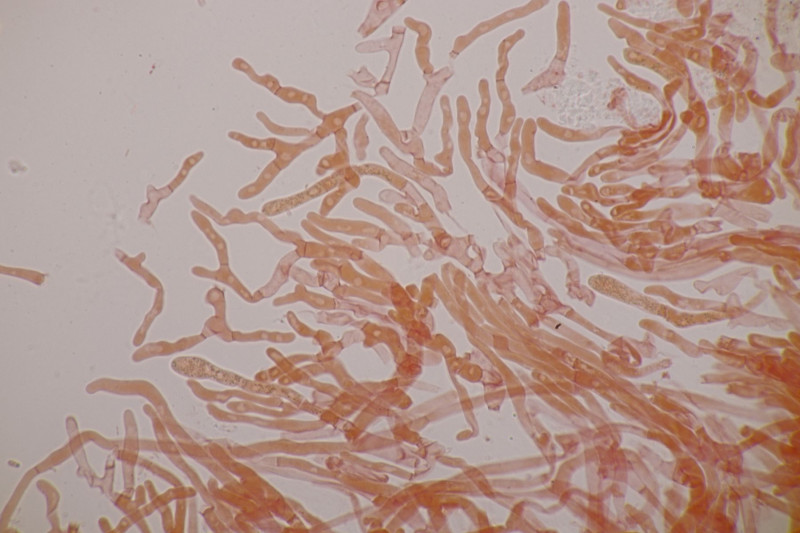
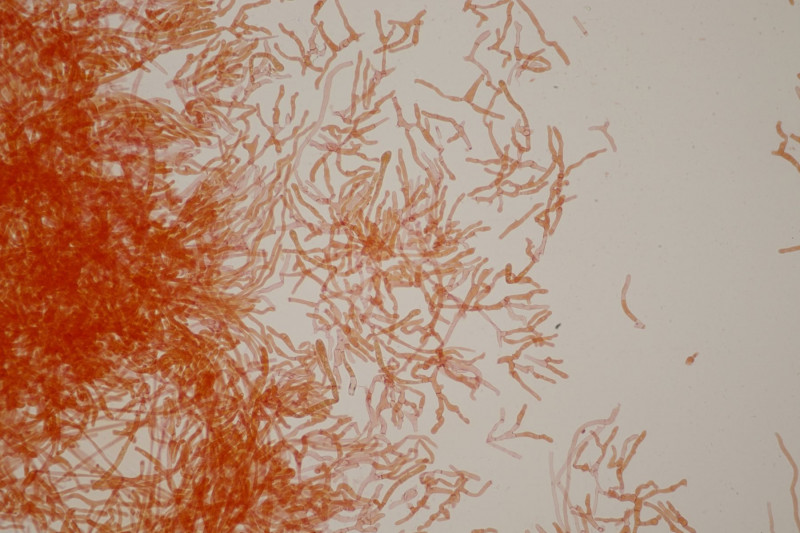
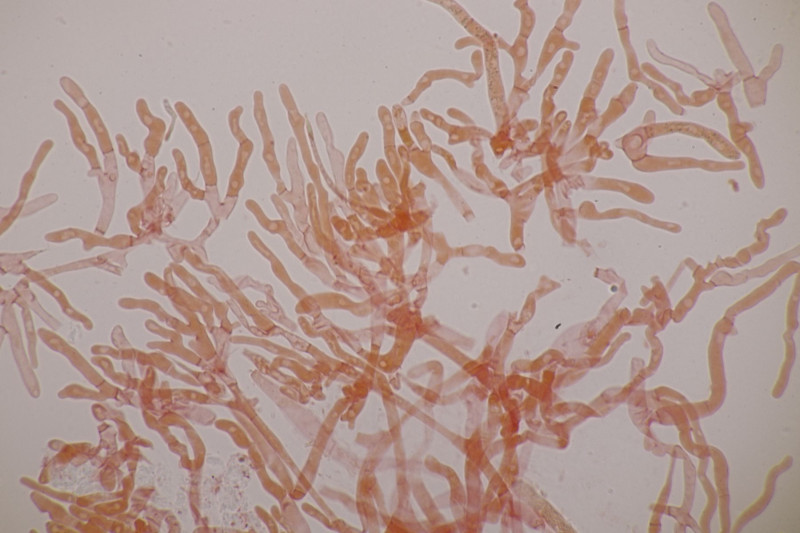

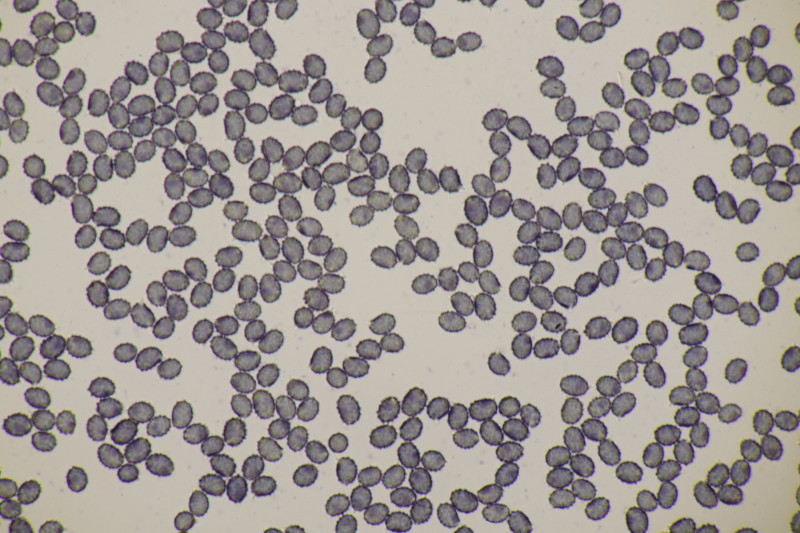
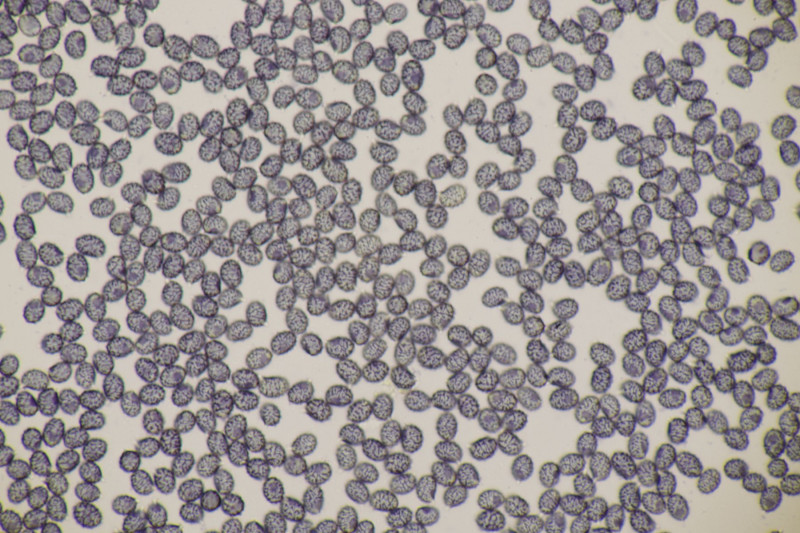

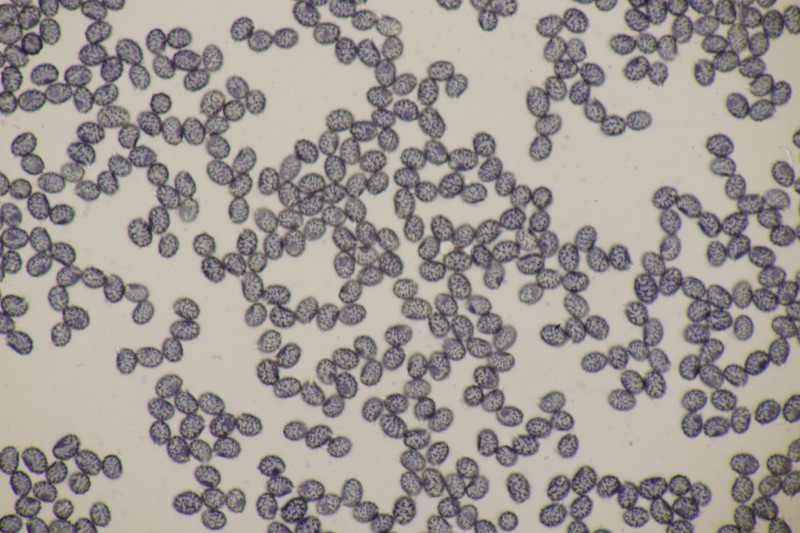
11. Früher hätte man das direkt im Feld als Entoloma sericeum abgehakt. Jetzt mikroskopiert man, weiß trotzdem nicht genau, wie man E. sericeum und E. vindobonense trennen soll und erkennt dann zu Hause auf dm Foto auch noch, daß man offensichtlich eine Mischkollektion zusammengesteckt hat: Einer der Hüte ist deutlich bereift. Ansonsten inkrustierte Hyphen in der Huthaut, Basidien 4-sporig mit Basalschnalle.




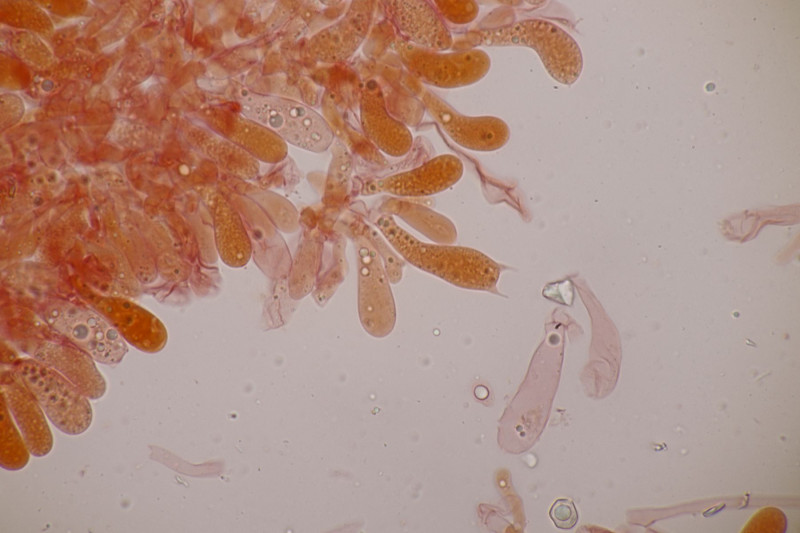






12. Arrhenia peltigerina



13. Hygrocybe conica



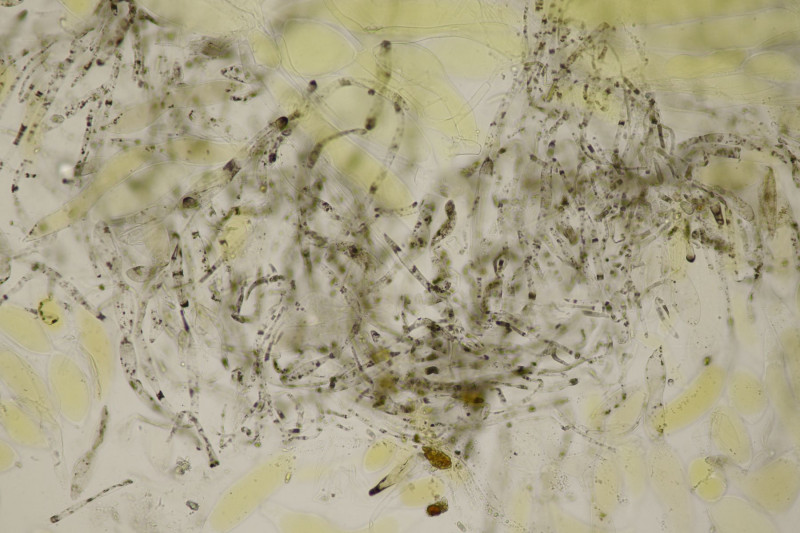
14. Suillus bovinus



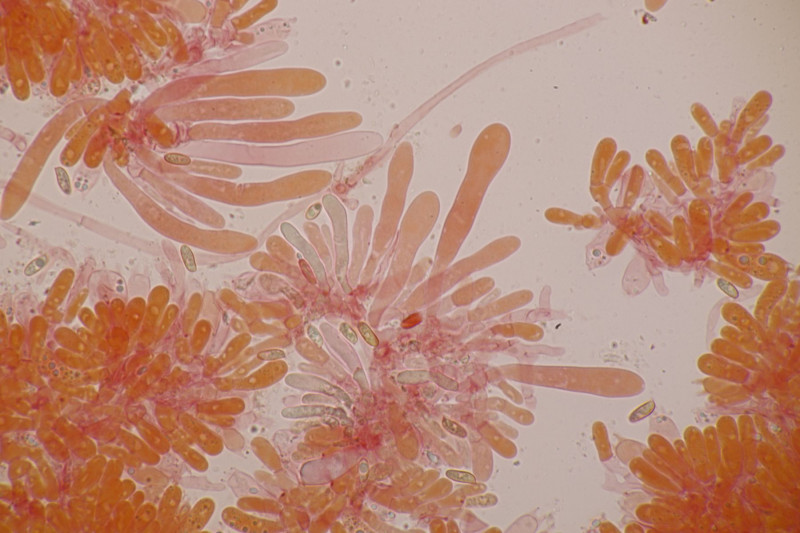


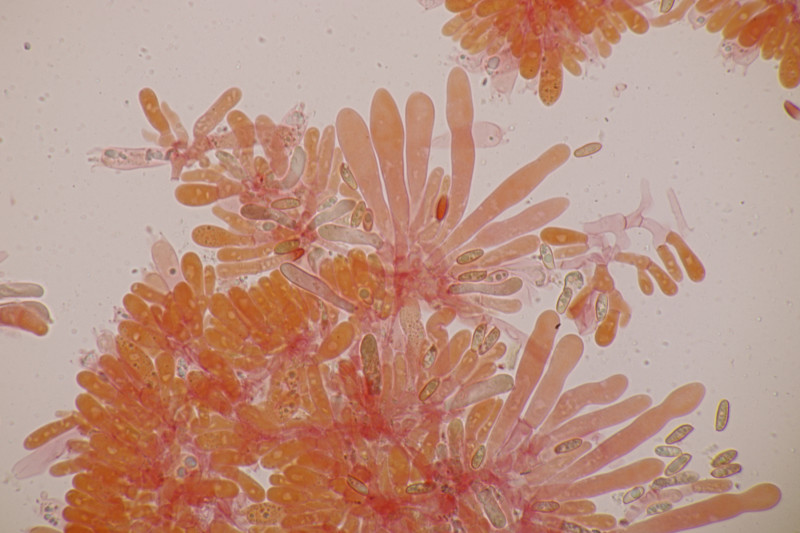

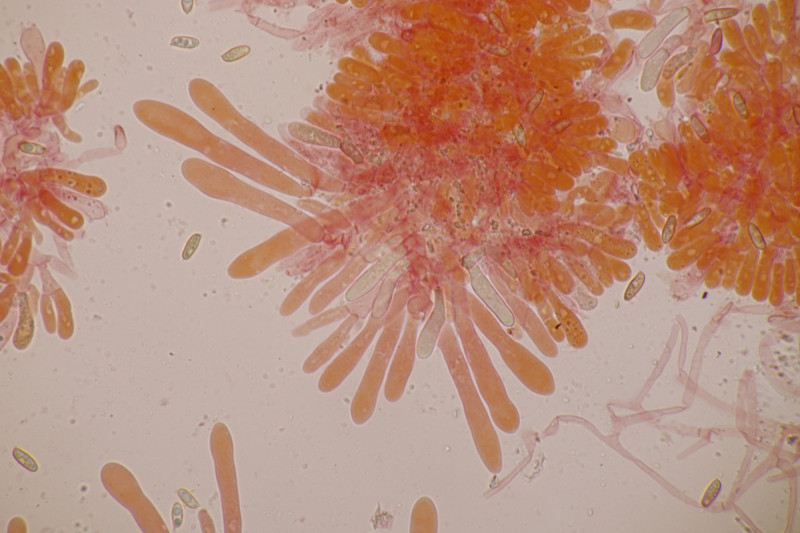
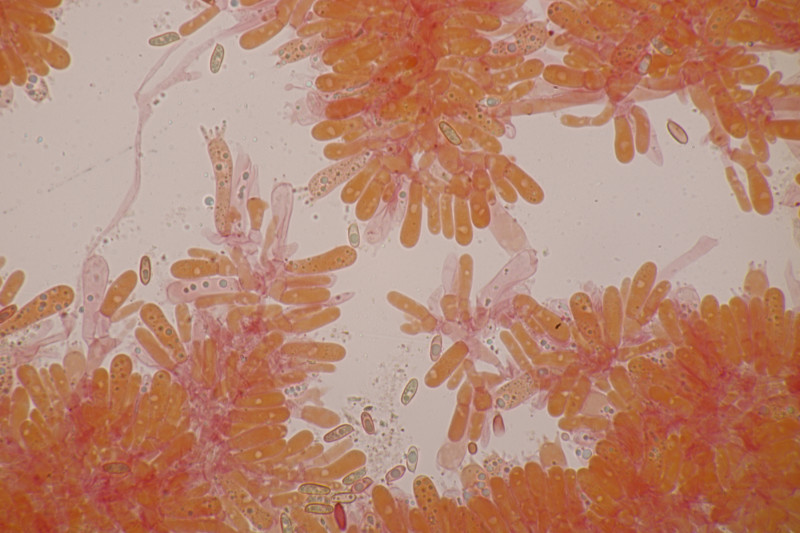
15. Tricholoma fulvum

16. Tricholoma albobrunneum

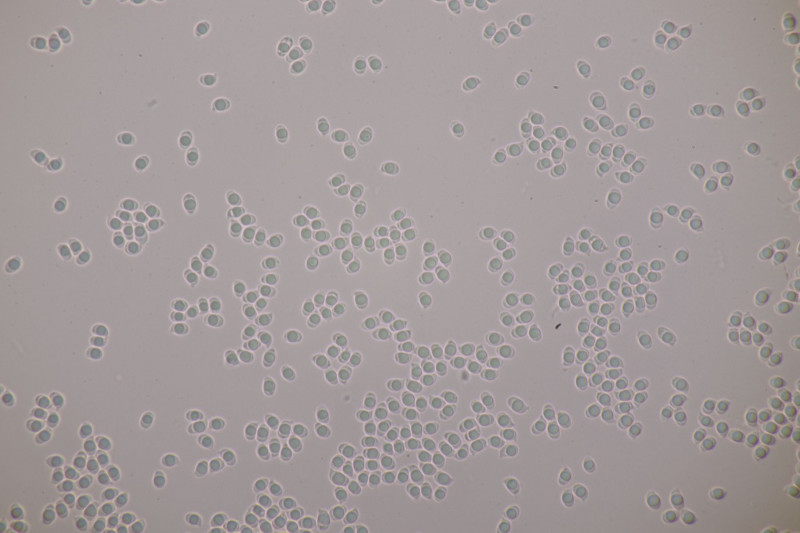

17. Imleria badia

18. Hebeloma mesophaeum, meine erste selbstbestimmte Hebeloma, Sporen messen 9.5+-0.4 x 5.6+-0.3 µm, Q=1.7+-0.1, 8.5-10.3 x 5.1-6.2 µm, Q=1.6-1.9



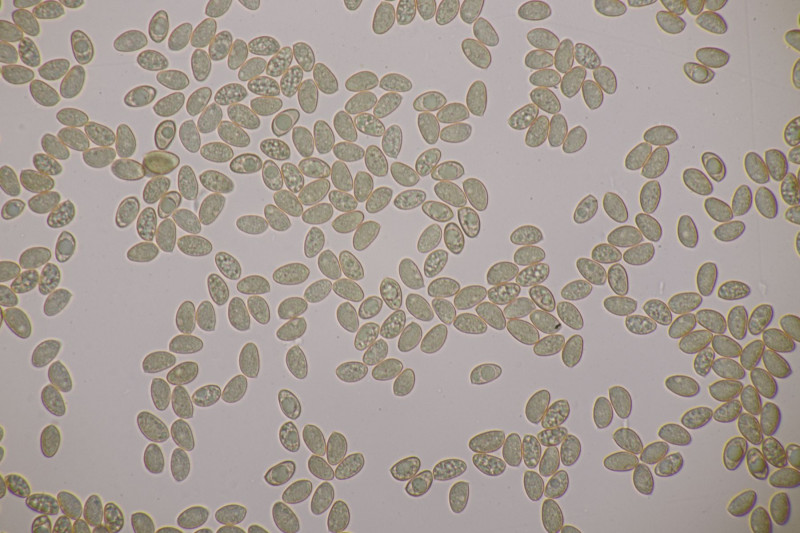
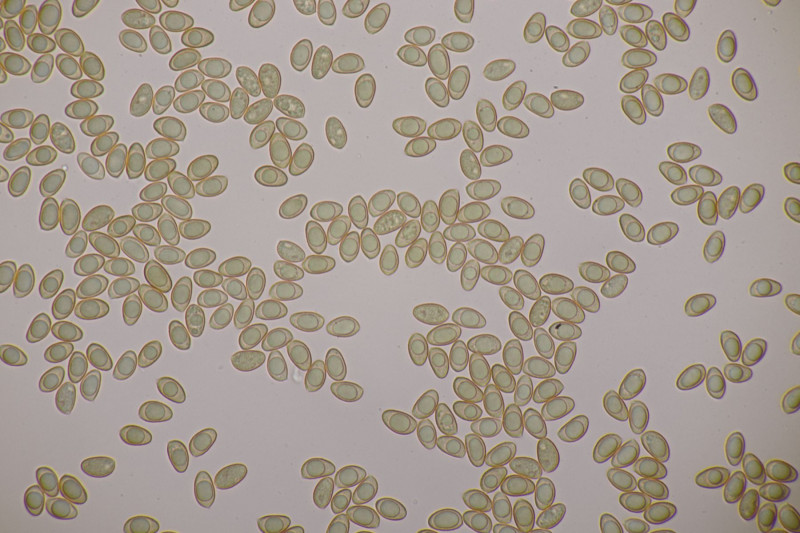



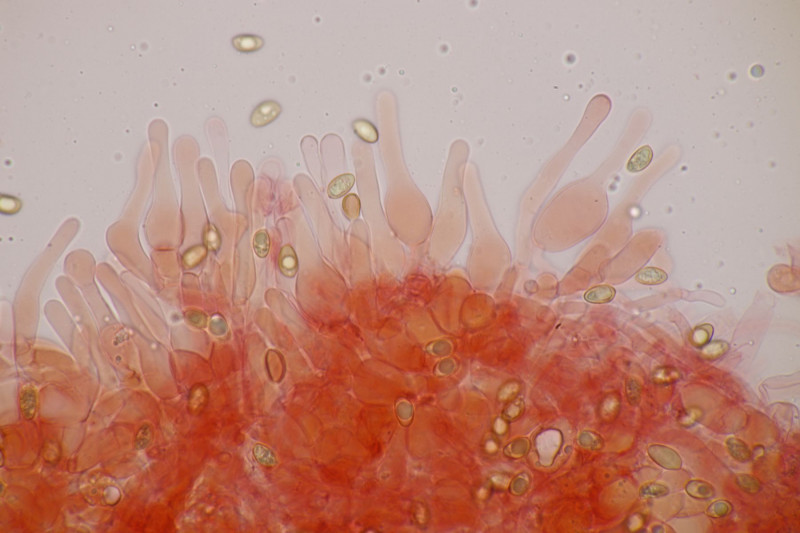
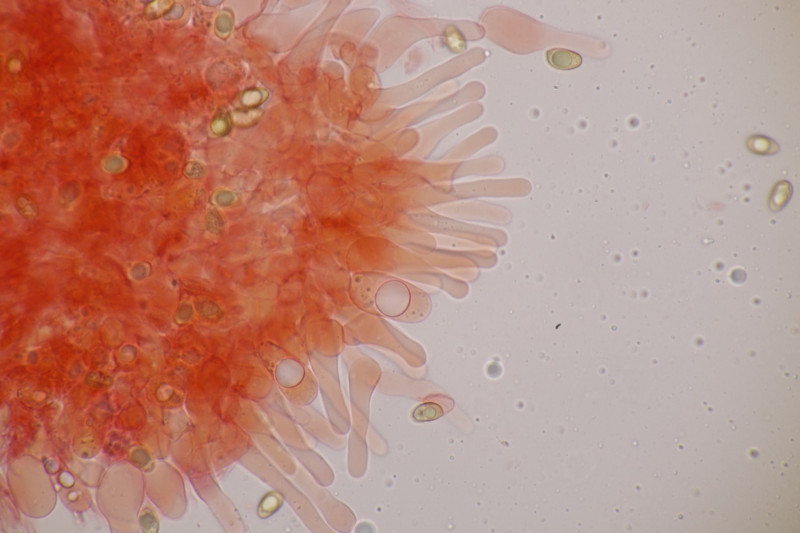
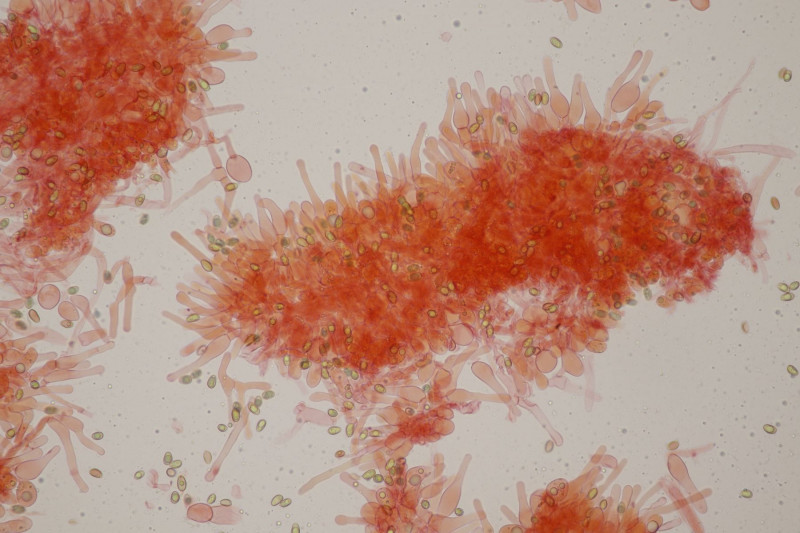
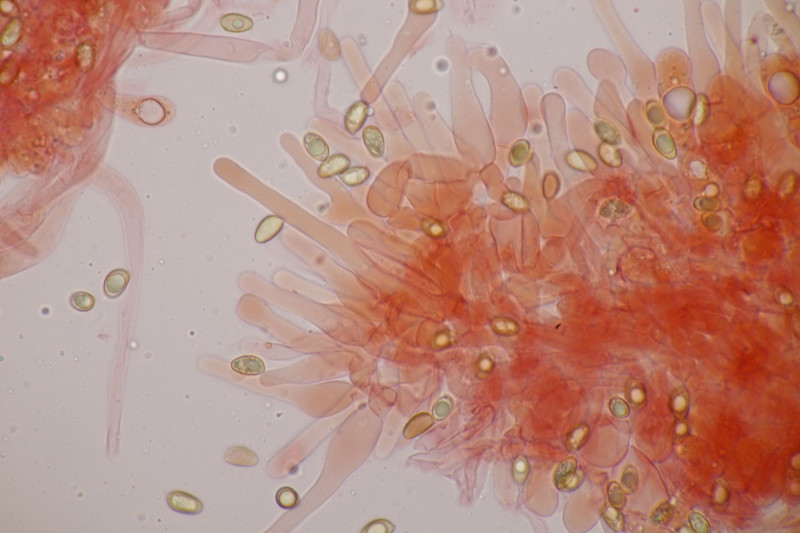
19. Eine Russula unter Pinus. Geschmack mild, Guajak negativ bis schwach, aber leider ohne Sporen, also wahrscheinlich nicht bestimmbar. Auffällig die roten Lamellenschneiden



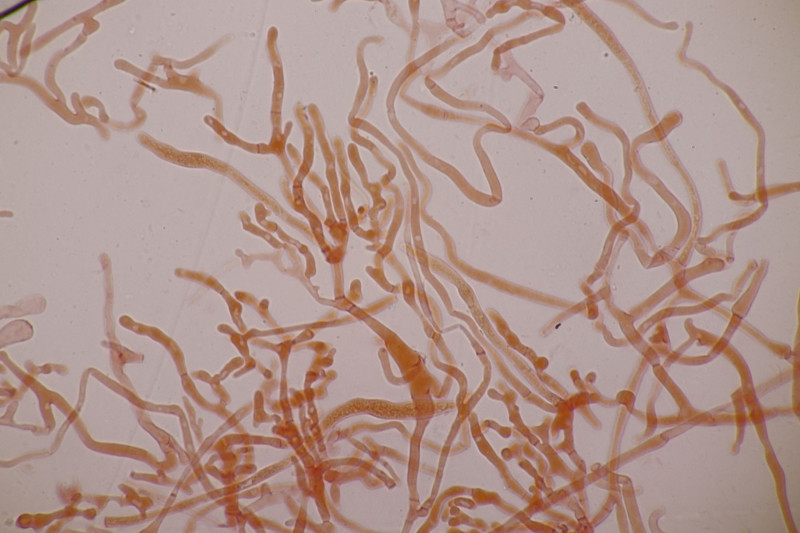
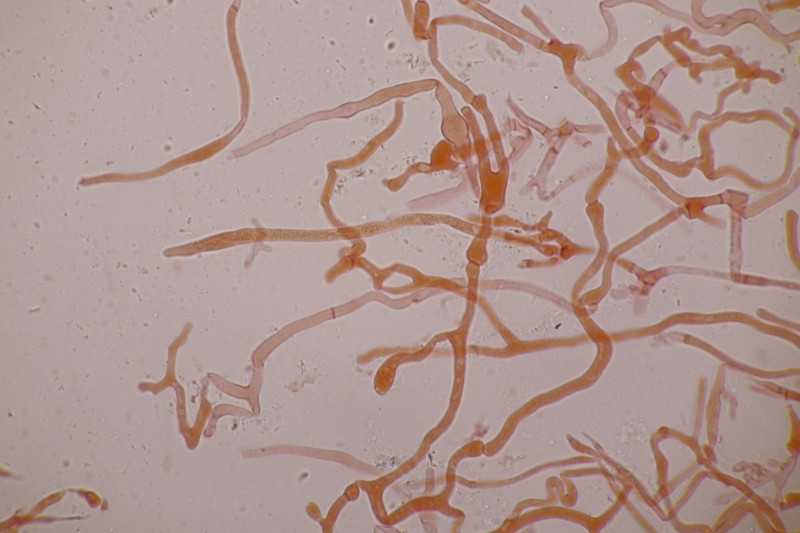

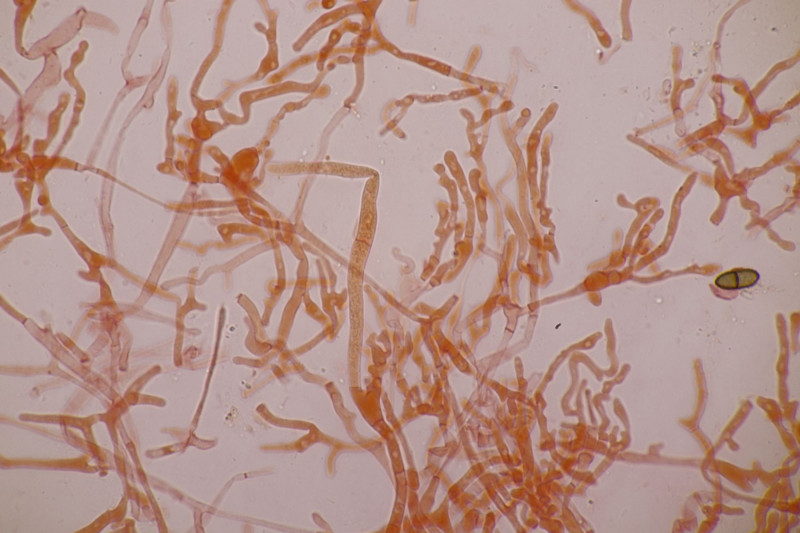

20. Mal wieder Hygrocybe conica


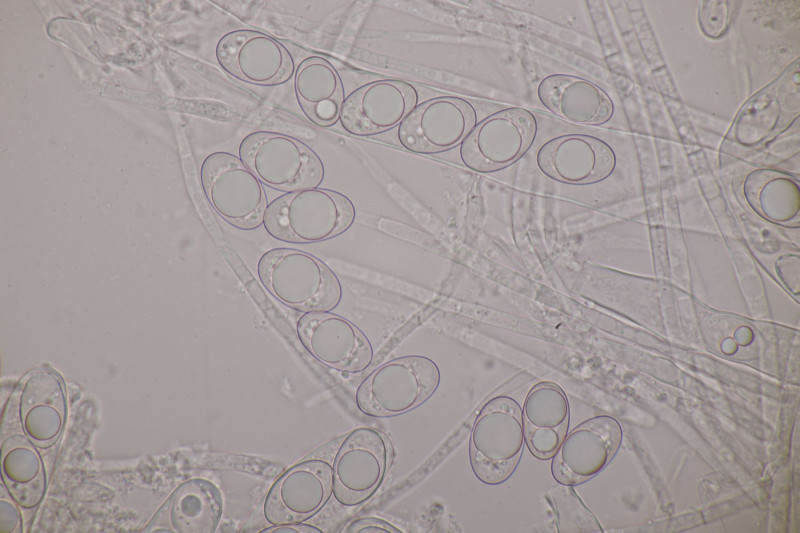
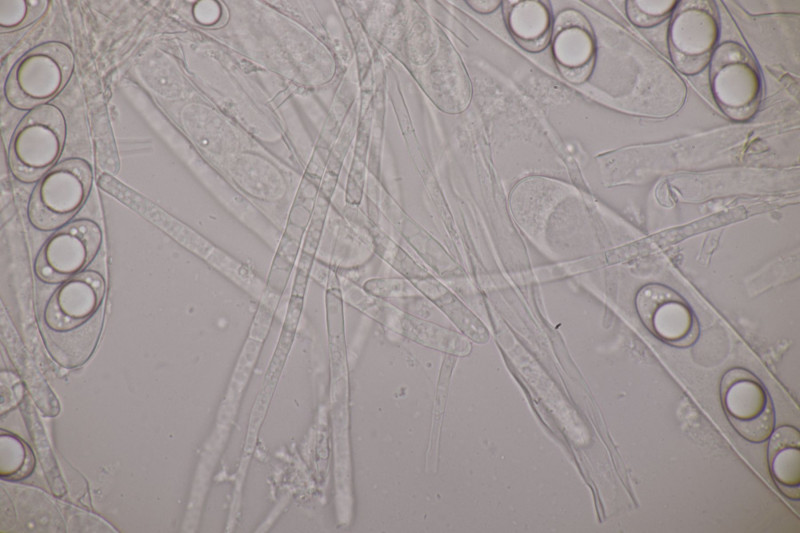
21. Geopora arenicola







Björn


