Hallo Dungpilzfans,
hier eine Coprinopsis, die in größerer Zahl an der mir von Eike zugesandten Proben von Galloway-Dung erschien und immer noch nachwächst.
Die Art ist extrem winzig, zumindest die meisten Exemplare davon.


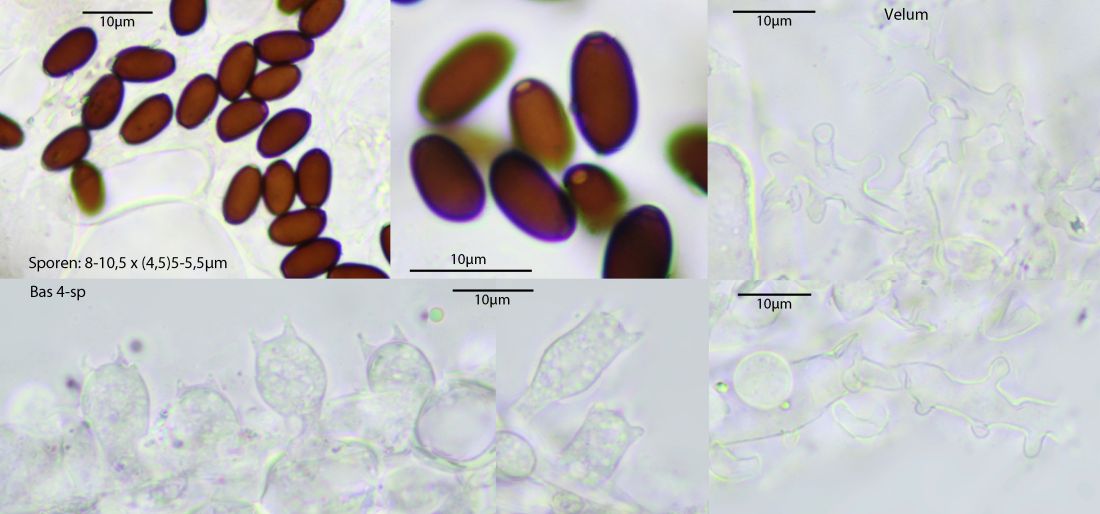
Mikroskopisch auffällig die verzweigten Velumzellen und das Fehlen von Schnallen. Die Sporengröße passt nicht zur anfangs vermuteten xenobia, so variabel darf die dann wohl doch nicht sein, auch wenn Sporengrößen bei Tintlingen ja gerne mal etwas abweichen. C. filamentifera hätte ganz anders geformte Sporen.
Bleibt eigentlich nur noch candidolanata, die Nobi per PN auch noch genannt hat und an die ich erst wegen Seltenheit nicht richtig glauben wollte. Aber alles andere passt eben nicht.
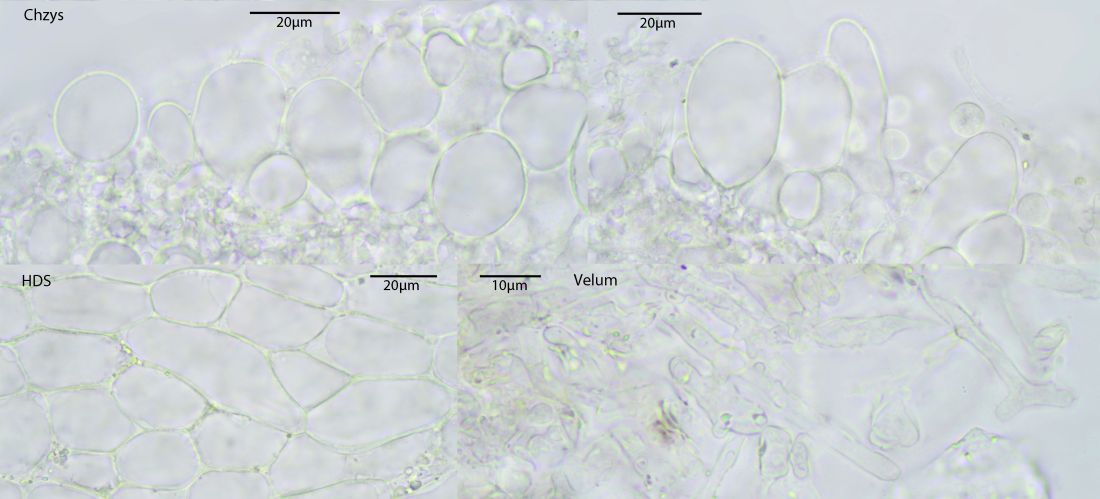
Nun müsste man bei candidolanata unterschiedlich geformtes Velum finden, also große längliche Zellen in Ketten und eben die kleinen verzweigten Elemente, die auch oben schon zu sehen sind. Bei letzteren gibt es keinen Zweifel, die großen Elemente sind oft schwer von der HDS zu unterscheiden und bei der Winzigkeit der Fruchtkörper ist es recht schwer, das Velum separat zu bekommen. Werde mal noch versuchen das im Auflicht bei 100-fach zu bekommen, da ist die Struktur klarer als im Quetschpräparat.
Zum Vergleich mal noch die Zeichnungen von Andreas Melzer, die leider nicht mehr online sind:

Solche Zellen fanden sich auf dem Hut, das würde gut zum Velum von candidolanata passen, sofern ich das hier nicht mit HDS-Zellen verwechsle. Die hier waren aber schon recht lose:
Coprinopsis candidolanata #7656 (10).jpg
Hier ist mir auch noch etwas unklar, was das genau darstellt, vielleicht sind hier auch Tramazellen mit reingerutscht:

Sporen:

Bei den Sporen gibt es in der Literatur auch ganz schön große Abwechungen.
Andreas Melzers Beschreibung: 9,5-12,5 x 5-7,5 µm, im Mittel 10,4-11,5 x 6,2-6,6 µm, mittlerer Q=1,68-1,74
Gröger-Schlüssel:7,5-10,5 x 5-7 Q 1,25-1,75
grzyby.pl: 7.3-10.7 x 4.8-7.2 µm; Q = 1.25-1.75; av. Q = 1.45-1.55; av. L = 8.7-9.6 µm, av. B = 5.8-6.5 µm
Die unteren Beschreibungen passen von der Sporengröße her sehr gut zu diesem Fund, Andreas' Größenangaben eher weniger.
Insgesamt würde ich hier candidolanata sehen, wenn auch mit kleiner Restunsicherheit wegen des Velums, aber das lässt sich hoffentlich noch klären, es wachsen ja noch genug nach.
Viele Grüße,
Matthias


