Soooooo...
Dann wollen wir mal weiter sehen.
Ein paar Pilzchen stehen hier ja noch aus. Unter anderem hatte ich mir ja erlaubt, Ingo mit einer etwas ungewöhnlichen Anistramete aufs Glatteis zu führen.
Das hier:

Sieht zugegeben erstmal anders aus, als es wirklich ist. Weil das ist keine resupinat gewachsene Porenschicht auf der Rinde. Sondern man muss sich das so vorstellen:

Also ein Fruchtkörper, der vom Stamm weg nach vorne einen Hut ausbilden will, das aber nicht kann, weil die Rinde im Weg ist und ihn platt drückt.
Und auch wenn's hier keinen Anisgeruch gab, ist es dennoch Trametes suaveolens, weil ein dimitischer Porling ohne Zystiden mit schon in der Trama sehr ausgeprägten Skeletthyphen und passenden Sporen bei ebenfalls passenden makroskopischen Leitmerkmalen...

Bestätigt hat sich auch Allophylaria macrospora:

War ja auch der selbe Fundort wie in "10 Arten/m", wenn auch ein anderes Holzstück.
Mikros siehe dort, bei diesem Fund zeigen sich keine Abweichungen.
Abweichungen zeigen sich bei folgendem Becherchen:

Der wächst zusammen mit Lasiobelonium und Allophylaria auf feucht liegenden Holzstücken, manche dick und manche ehemals dick (nur eben auseinandergefallen). Erinnert mich sehr an Lachnum impudicum, passt auch mit IKI - reaktion und auch Hakenverhältnissen. Komisch dabei, daß die Haken teils ganz deutlich sind, an anderen Asci (auch und vor allem Jungasci) aber fehlen. Und die fehlen da sicher. Hier würde ich also sagen: Hakenverhältnisse gemischt.
Was eben noch gemischt ist, ist die Form der Randhaare: Die sind sowohl lanzettlich als auch keulig, aber jedenfalls bis ganz oben fein borstig. Komisch: Die keuligen und die lanzettlichen stehen jeweils für sich in Gruppen. Allerdings alles innerhalb eines Apotheciums.
Dann sind da auch noch Sporen, die sich durch (hohe kinetische Energie und) Längen bis 10 µm auszeichnen. Und das sind nicht 2 Ausreißersporen von 30, die da auf 9,5 oder 10 kommen, sondern schon ein paar mehr.


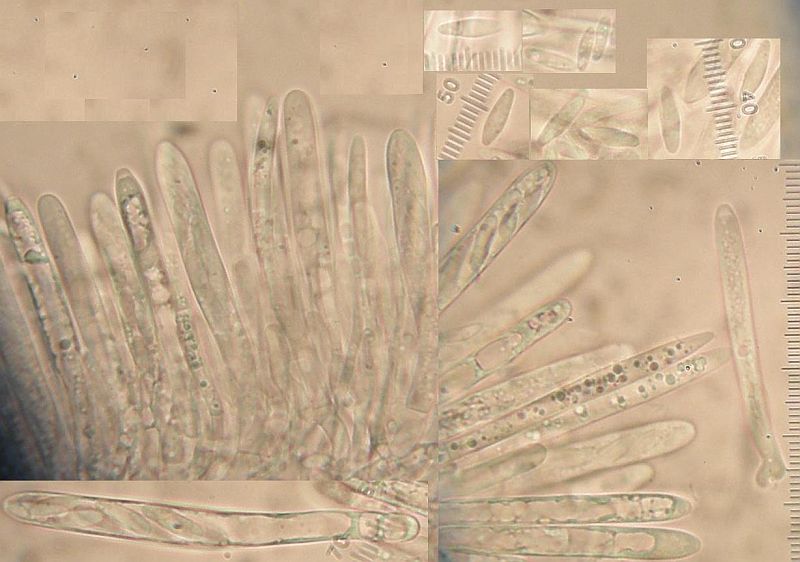
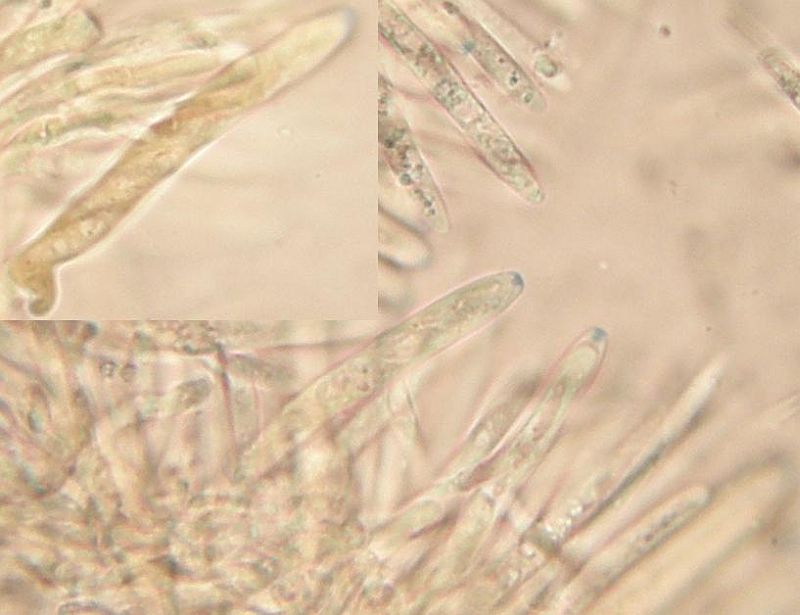
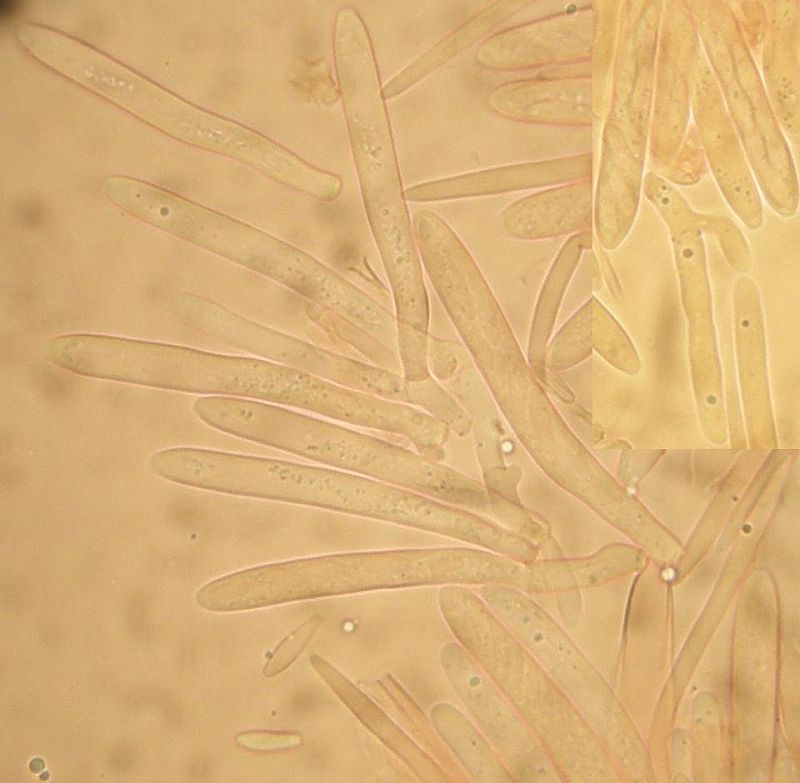
Irgendwie mag ich den nicht Lachnum impudicum nennen, oder passt das noch in die Variationsbreite der Art?
Was sich übrigens nicht mehr darstellen lies, war ein Ausschwämmen von gelbem Exsudat aus den Haaren von Lasiobelonium variegatum. Ich bin nun gar nicht mehr so sicher, ob ich mir das nicht beim ersten Versuch eingebildet hatte? Bei den jketzt getesteten Becherchen löst sich zwar schon was. Aber es wird nichts Gelbes ausgeschwemmt. Nur der Krust auf den haaren wird etwas geschmeidiger und gelblicher. Aber ohne sichtbaren, gelösten farbstoff. Vielleicht ist die Reaktion eben auch nur bei manchen Bechern noch viel schwächer als bei anderen.

Schön zu untersuchen war in der Tat die Propolis farinosa.
Die riesigen Sporen sind schon ein Hingucker, aber auch die komisch verästelten Paraphysen. Erinnert mich an Dendrohyphidien bei Rindenpilz - Arten.
Und da ist die mikrochemische Reaktion mal echt eine Wucht: Da steigen ganze Wolken an gelöstem, nun violett gefärbten Pigment von den Paraphysen auf.
Toll. 



Das ganze dient so mehr oder weniger dem Herantasten an die erste Untersuchung einer Mollisia.
Das soll die an dem Tag zuerst gefundene sein. Stammt aus dem berühmt - berüchtigten Weidengebüsch und bevölkert das andere Ende des liegenden Astes, auf dem auch Propolis farinosa saß.
Den Platz muss sie sich aber mit einem Kernpilzchen teilen, den ich mal Lasiosphaeria strigosa getauft habe.


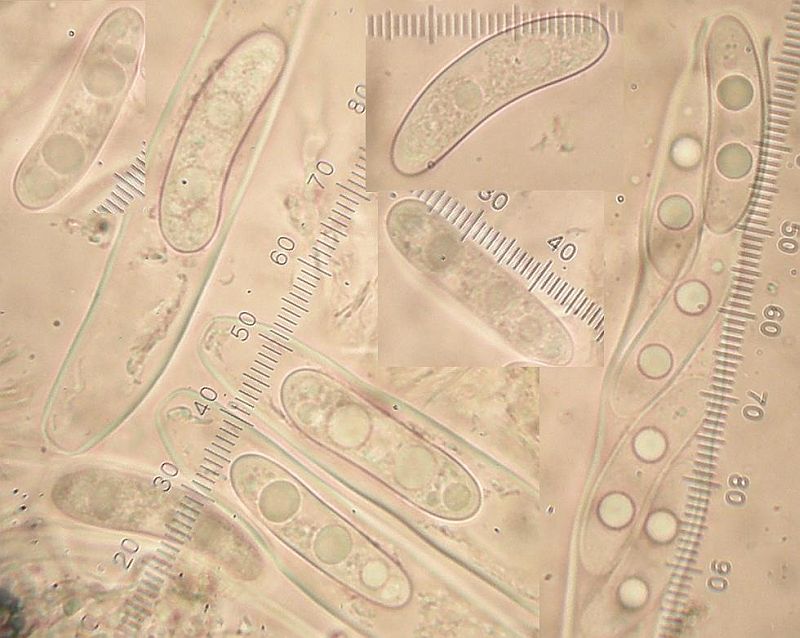
Die Lasiosphaeria strigosa kurz und knapp in wenigen Bildern vorgestellt:


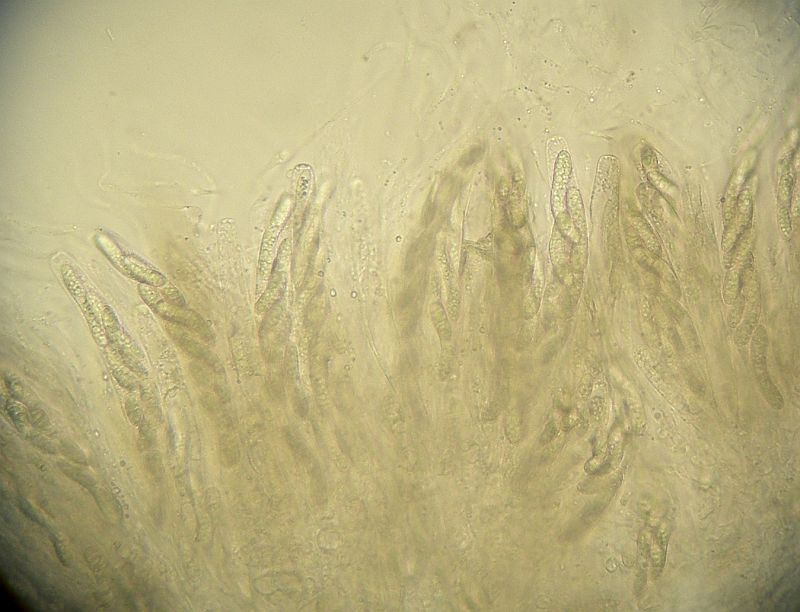
Und nachdem nun die Gesellschaft bekannt ist, schauen wir mal nach der Mollisia.

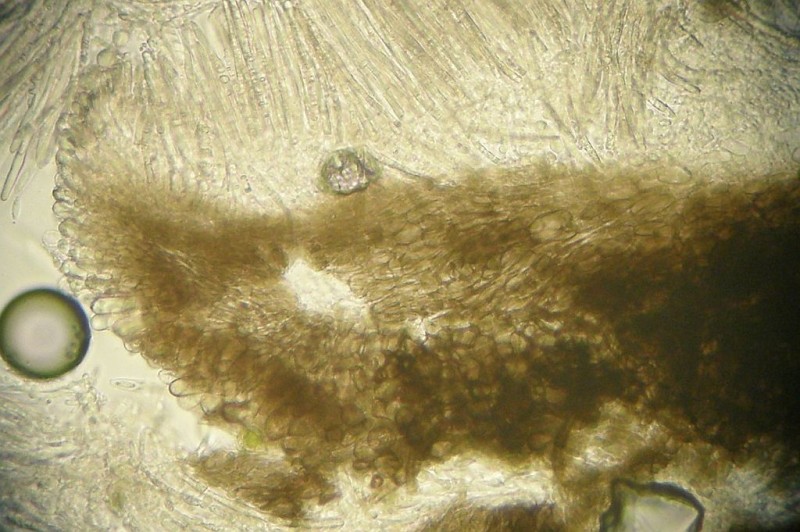
Erstmal fällt mir auf, daß der Becher im Querschnitt ganz schön flach ist im Vergleich zu anderen Becherchen.
Die Hyphen der Außenseite (Ectal - Excipulum) sind irgendwie klobig, nicht wirklich rundig sondern mehr unregelmäßig rundlich - eckig. Zum Becherrand hin eher kleinzellig, zur Mitte hin dicker. Also alles, wie Ingo prophezeit hat.
Über den in diesem Fall fast durchgehend winkligen Zellen (wenige rundliche eingestreut) liegt eine Schicht aus länglichen Hyphen, die sozusagen das Schälchen auskleidet und auf der das Subhymenium sitzt. Alle Schichten sind ganz schön dünn.
Zum Rand hin wird die unterste, zellige Schicht ganz dünn, am Becherrand selbst sitzen Randzellen, die aber von den Hyphen der länglichzelligen Zwischenschicht ausgehen. Diese Marginalzellen haben eine Ähnlichkeit mit den Paraphysen, haben auch einen vergleichbaren Inhalt, sind aber kürzer und dicker.
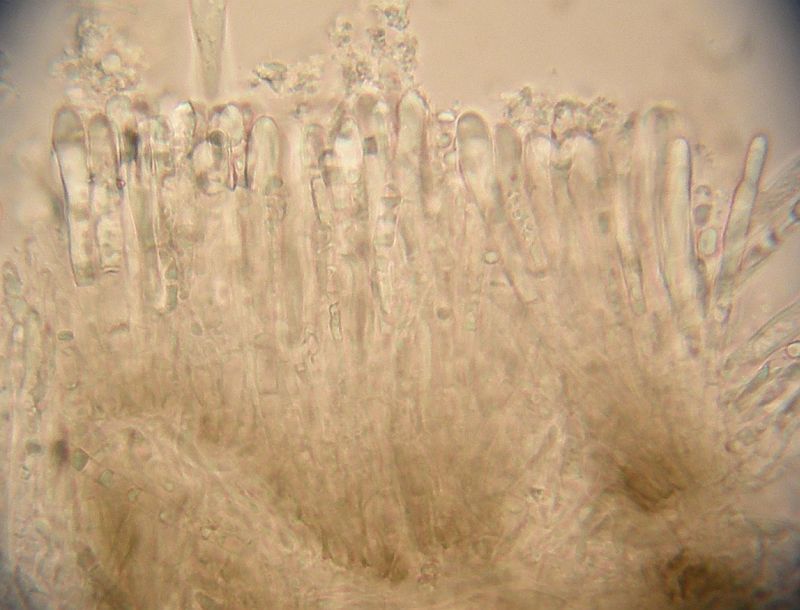
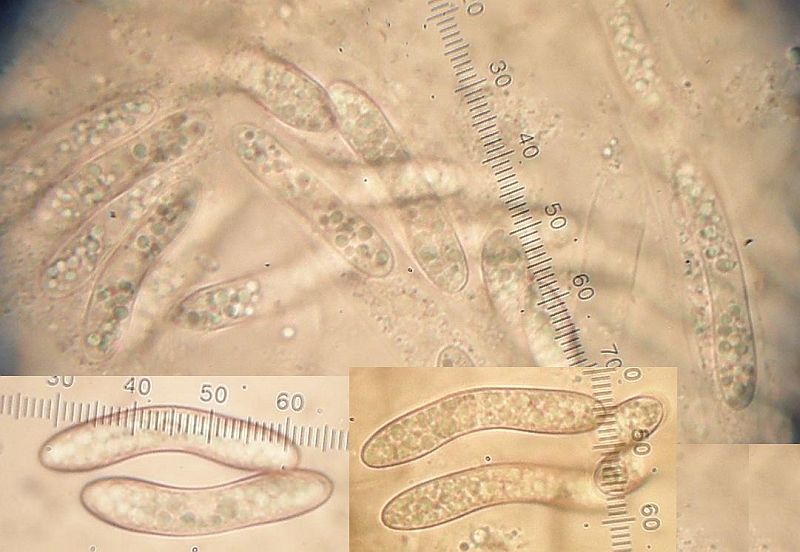
Asci und Paraphysen in Wasser:
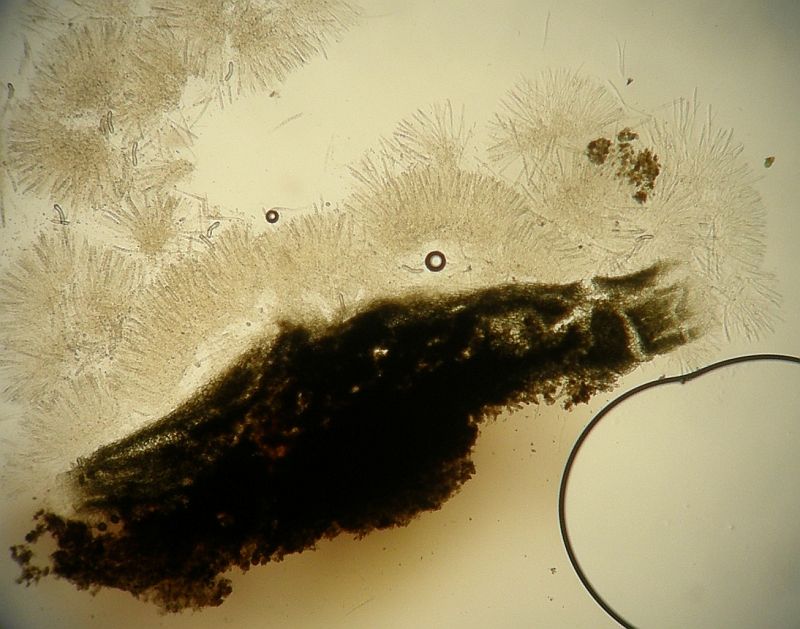
Nun kommt das KOH, ich habe 3% genommen, scheint zu reichen. Die Excipulumzellen werden wie versprochen grün, der gelöste Farbstoff entweicht auch hier gelblich ins Medium.
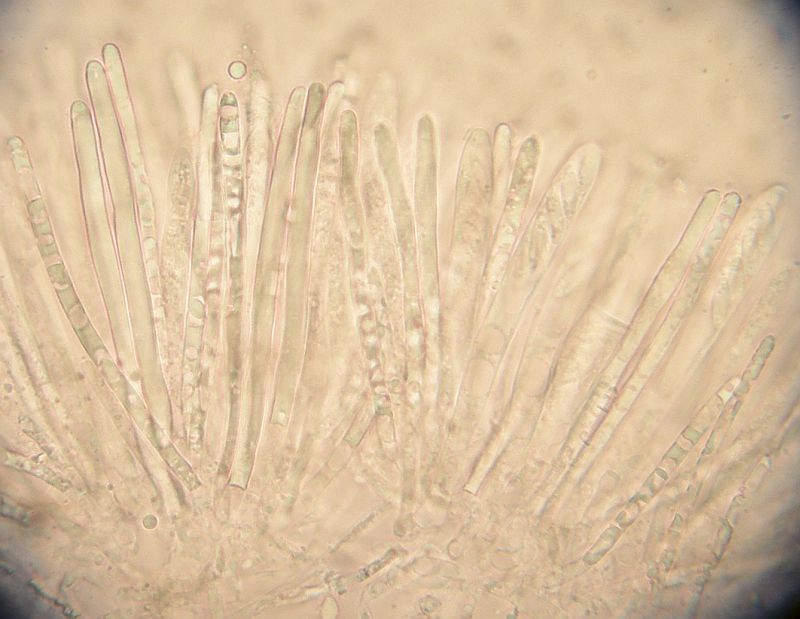
Asci und Paraphysen in KOH:

Ein Glückspilz - Bild, weil da hat man gleich noch die deutlichen Haken mit drauf.
Das, was vorher zylindrisch bis unterbrochen - zylindrisch als lichtbrechende Masse in den Paraphysen stand, hat sich entweder vollständig aufgelöst oder bis auf ein paar ganz winzige Tröpfchen.
Ascusporus in Lugol = blau, wobei sich nur der Porus anfärbt, nicht aber der apikale Ring.

Was für mich mit dem Messokular etwas schwierig ist, sind "exakte" Messungen. Das ist recht aufwendig und sowas wie "3,64 µm bis 7,29 µm" gibt es bei mir nicht. Es wird immer in 0,5er Schritten gerundet.
Hier messe ich: 7,5-12 x 2-3 µm.
Der Inhalt ist nicht in allen Sporen superdeutlich zu sehen, aber in allen Sporen vorhanden und sehr ähnlich.

Geht da schon was oder brauchen wir noch mehr?
LG, Pablo.


