Hallo zusammen!
Gestern bin ich auf einem Waldweg ...

Bild 0 Der Wald
... an strahlend weißen Flecken auf Holz vorbeigekommen und habe mich deshalb noch einmal umgedreht.
Da muss sich unsereins natürlich mal bücken und genauer schauen.

Bild 1 Heller Fleck auf Holz
Ein Schleimpilz, der gerade beim Ausbilden seiner Fruchtkörper ist, weich und feucht.

Bild 2 Fruchtkörperbildung
Nur ein wenige Zentimeter weiter, vom Kraut überdeckt, stehen reife, braune Fruchtkörper einer Stemonitis-Art, die eventuell zum unreifen, weißen Stadium daneben gehören.
Diese reifen Fruchtkörper hätte ich beim Vorbeigehen natürlich nie entdecken können.

Bild 3 Reife Stemonitis auf Moos über Holz
Die Fruchtkörper sind etwa 6-7 mm lang, zuzüglich einem kurzen, etwa 2 mm langem, schwärzlichem Stiel.
Die Stiele sitzen mit einer verzeigten Struktur in einem bräunlichen Hypothallus, ohne sich am unteren Ende zu verdicken.

Bild 4 Übergang Stiel / Hypothallus
Der Fruchtkörper ist an der Stielbasis wie rund, wie auch am oberen Ende!

Bild 5 Hypothallus
Das obere Ende des Fruchtkörpers scheint sich auf die Spitze zu leicht zu verjüngen (sieh Bild 3 oben)...
Die Columella löst sich am oberen Ende verzweigend auf.

Bild 6a
20220514 105201289.jpg
Bild 6b
Das hellbraune Capillitium scheint mir hauptsächlich am Rand des Fruchtkörpers zu existieren.
Es zeigt keine Dornen, aber verbreiterte Verzeigungen.
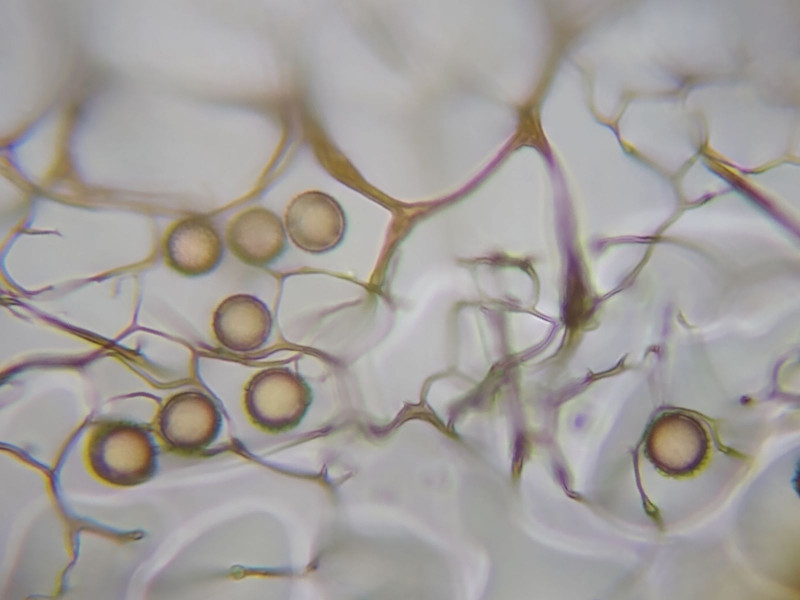
Bild 7 Capillitium mit Sporen
Die Sporen sind kugelrund und ornamentiert.
Ihr Durchmesser liegt bei etwa 8,0 - 8,5µm. Es lassen sich aber auch etwas größere und kleinere Sporen (7,5-9,0) finden.
Einen Keimporus kann ich nicht erkennen, was nicht heißt, dass er nicht existiert.. 
Der Fokus lässt sich so einstellen, dass man meint, ein Netz zu sehen oder doch Dornen, die etwas zusammenhängen.
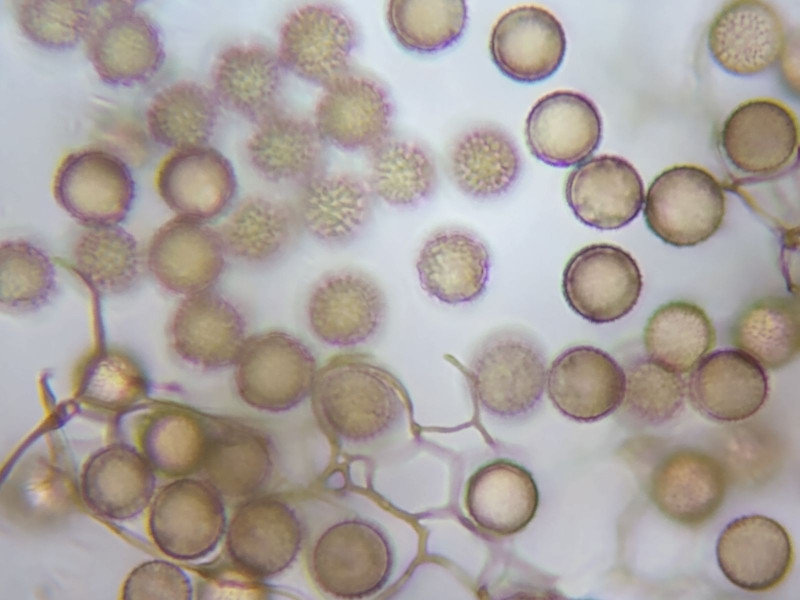
Bild 8 Sporen in unterschiedlichen Ebenen

Bild 9 Blick auf Stielbasen
Meinen kleinen Geib bemühend, schließe ich S.fusca aus, da das Capillitium dornenfrei ist.
Sporen größer als max. 8µm sprechen eventuell gegen S.axifera, vor allem ist das untere Ende nicht spindelförmig, sondern rund. Die Stiele müssten wohl länger sein.
Der gerade, nicht verbreiterte Stiel passt nicht zu S.smithii.
Bliebe S.herbatica von den vier in M.Geibs Buch zur Auswahl stehenden Arten. Gefällt mir aber auch nicht so recht...
Wenn ich mir die SEM-Aufnahmen vom Capillitium im Artikel von G.Moreno vergleiche, dann ist mir das von S.herbatica zudem viel zu feinmaschig; eventuell würde das von S.splendens besser passen.
Rottöne finde ich auch weder an Stiel noch anderen Teilen.
Gerne würde ich das Capillitium über die gesamte Sporocarplänge begutachten, aber es sitzt noch voller Sporen.
Wie bekomme ich die wohl am besten los?
LG, Martin
![]()


