Bonsoir, ich habe das Experiment mal fortgeführt und noch mal 2 Wochen gewartet. Mittlerweile schaut das Teil schon so aus wie die von Karl und Ralph. Also vermutlich kurz vorm Übergang in Schleimsuppe.. 'Na denn' dachte ich mir schaun wir mal ob ich nun ein paar Asci finde!
Nun die Suche war erfolgreich, jedoch wurde ich "gefotobombed". Hä was bitte? (Ein Phänomen der Smartphone Generation, wer Kinder im Schulalter hat wird den Begriff kennen, für die anderen erschliesst er sich denke ich ganz gut)
Seht selbst:
Nichtsahnend warten diese Sporen in ihrer gemütlichen Ascusröhre auf ihre Freisetzung und träumen von der großen weiten Welt. Oder zumindest einem warmen Frühlingswind.

Diese Spore hat den Sprung geschafft und glänzt in der künstlichen Sonne meiner Halogenbirne.

Doch halt - was ist denn da plötzlich mit im Bild? Das war doch gerade noch nicht da?!
Da geh ich doch schnell mal mit der Vergrößerung runter...

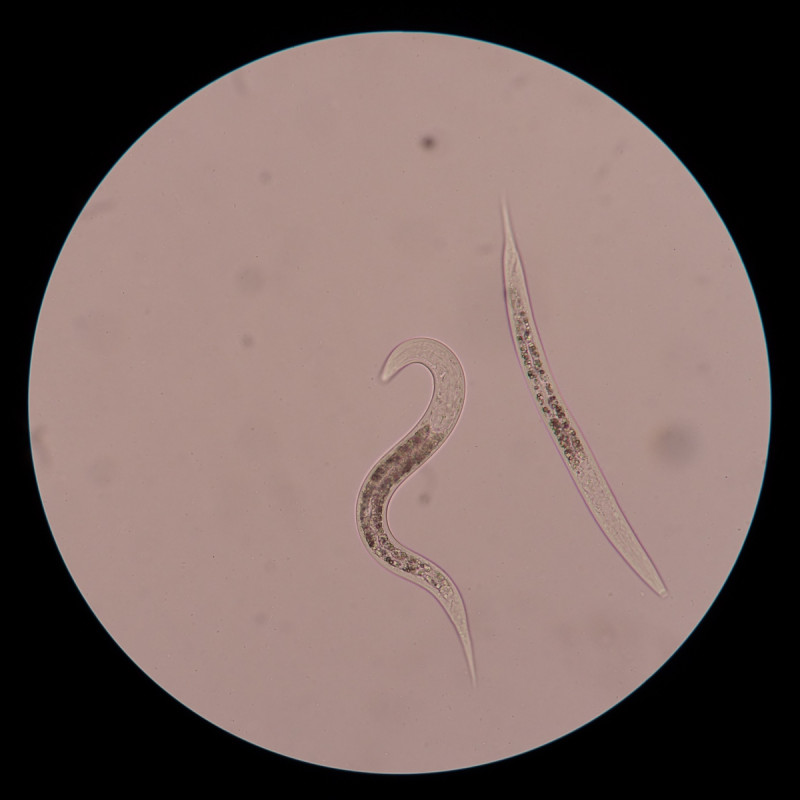
Ja Hallöchen, das ist ja mal eine willkommene Abwechslung bei der sonst eher statischen Pilzmikroskopie. Da geht ja richtig die Post ab unter dem Deckglas!

Darf ich vorstellen: Frau Nema Tode, samt Gemahl, quicklebendig.
Hier ist was Tolles passiert- nachdem ich meine Fotos per Hand durch das Okular mache, kam ich durch mein Gezittere in den Randbereich wo das Bild Farbsäume bekommt und plötzlich abschattet. Durch Zufall habe ich aber offenbar genau einen Sekundenbruchteil bevor es schwarz wird abgedrückt und dadurch ein fast phasenkontrastartiges Bild bekommen. Zumindest wirkt es ziemlich dreidimensional. Geil!
Weiss jemand zufällig ob man den Effekt bei der Fotographie bewusst nutzen kann? zB an einem Fototubus? Dann könnte man sich ja eine Phakoeinrichtung am Mikroskop sparen

Ich hoff es hat euch gefallen, ich vermute der Anblick dürfte Mikroskopikern, die schon länger im Geschäft sind durchaus bekannt sein.
PS falls jemand nun einen flauen Magen hat : die Bilder sind alle bei 400x entstanden, die Tierchen sind also wirklich winzig, ein kleines Bisschen länger als ein Ascus. Mit blossem Auge waren sie nicht zu erkennen. Außerdem dürften sie eher an den das Pilzmaterial zersetzenden Bakterien oder demselbigen interessiert sein, sodass jeglicher Ekel in diesem Fall unbegründet ist. Die tun euch nix
: die Bilder sind alle bei 400x entstanden, die Tierchen sind also wirklich winzig, ein kleines Bisschen länger als ein Ascus. Mit blossem Auge waren sie nicht zu erkennen. Außerdem dürften sie eher an den das Pilzmaterial zersetzenden Bakterien oder demselbigen interessiert sein, sodass jeglicher Ekel in diesem Fall unbegründet ist. Die tun euch nix 
Was ich bisher nicht wusste: Nematoden sind wohl zahlenmässig die häufigsten mehrzelligen Organismen auf der Erde. Nicht Ameisen, nicht Fruchtfliegen und auch nicht Kriebelmücken, kaum zu glauben
![]() . Die Poren fein, polygonal. So von weitem hätte ich auf einen Feuerschwamm getippt. So fein waren die Poren dann allerdings doch nicht, sodass es vielleicht in Richtung Fuscoporia (cf viticola) gehen könnte?
. Die Poren fein, polygonal. So von weitem hätte ich auf einen Feuerschwamm getippt. So fein waren die Poren dann allerdings doch nicht, sodass es vielleicht in Richtung Fuscoporia (cf viticola) gehen könnte?

