Hallo zusammen,
gestern sah ich am Wegesrand etwas "braunhütiges" was mich bei flüchtigem Blick von oben an den rehbraunen Dachpilz erinnerte. Zwar auf dem Boden befindet sich dort viel Holz auch im Boden.
Ein Blick unter den Hut zeigte jedoch schnell, das passt nicht: reinweiße Lamellen mit ausgebuchtet angewachsenen Lamellen, mit Zahn herablaufend. Einen besonderen Geruch konnte ich auch nicht feststellen. Dazu weicher und überfaserter Stiel, das Gesamtbild wies schnell in Richtung Melanoleuca. Bäume waren übrigens in ganz direkter Nähe nicht zu finden, hier stand vor anderthalb Jahren noch ein Fichtenwald, der nun nicht mehr existiert. Entfernt sind allerdings Fichten und Buchen vorhanden.
Nun zur Mikroskopie:
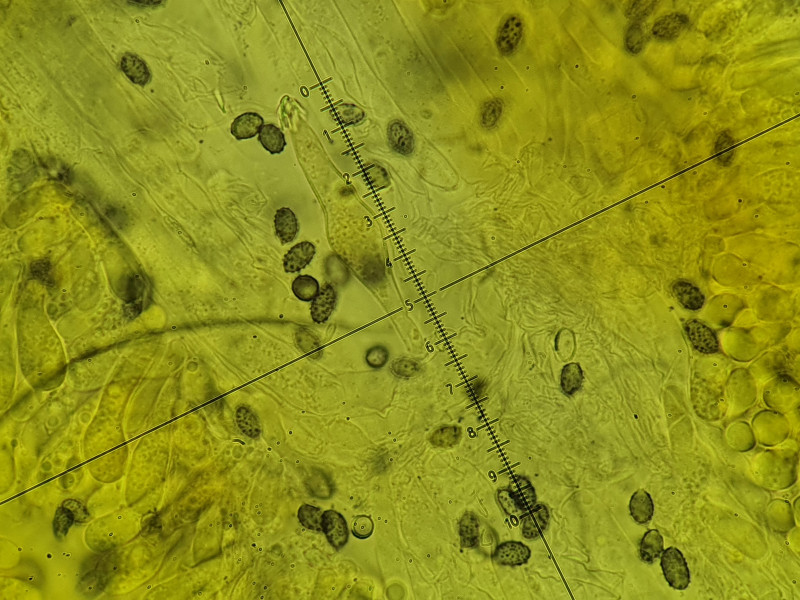
Die Sporen sind warzig und amyloid. Größe 8x5µm groß (12 Sporen gemessen, ziemlich konstant, nur sehr wenige etwas kleinere (unreife?) Sporen zu sehen).
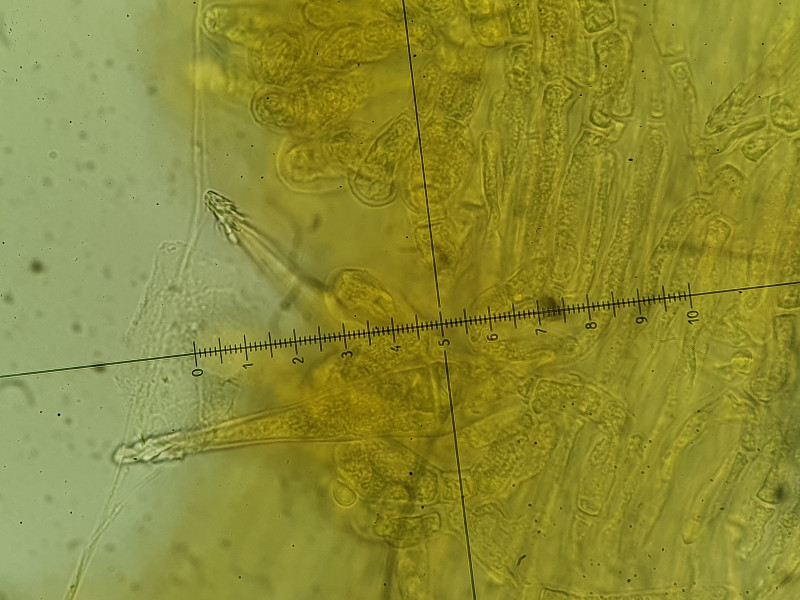
Es sind sowohl Cheilozystiden, Pleurozystiden und Kaulozystiden vorhanden. Alle mit Kristallschopf besetzt und deutlich fusiform (also spindelförmig, wobei die Cheilos "im Gewusel" nicht bis zur Basis zur beurteilen waren).
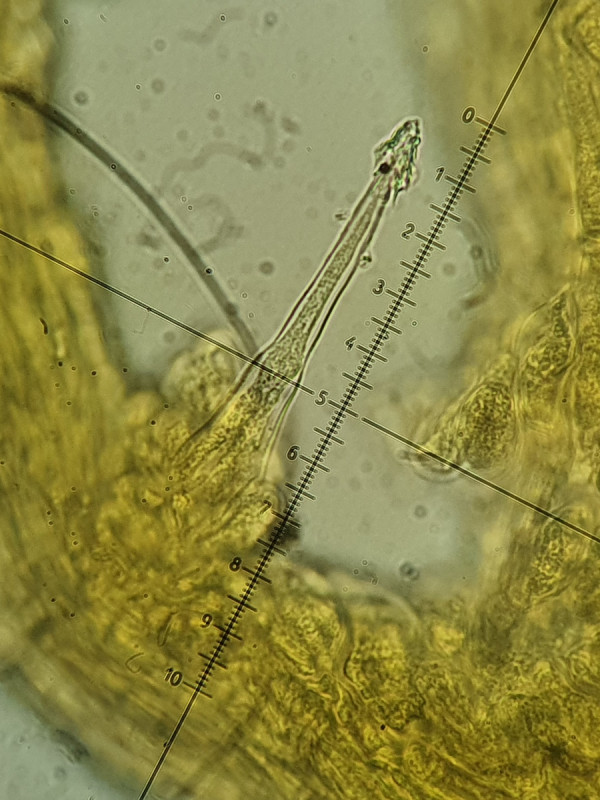
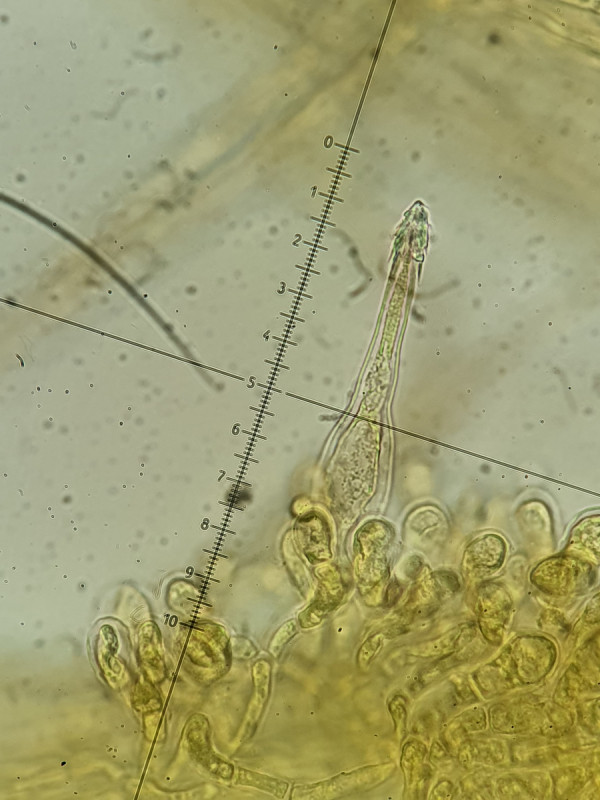
Interessant sind Unterschiede zwischen den Zellen: Die Cheilos wirken kurz (nicht bis zur Basis beurteilbar), wachsen jedoch aus so einer Art bohnenförmigen Struktur, die bei allen Cheilos zu sehen war. Weiß dazu jemand etwas? Gleichzeitig sind die Cheilos sehr dickwandig (fast bis 2µm). Dagegen sind die Pleuros deutlich fusiform und sehr dünnwandig, gleichzeitig aber länger, ziemlich gleichförmig bei etwa 60µm.
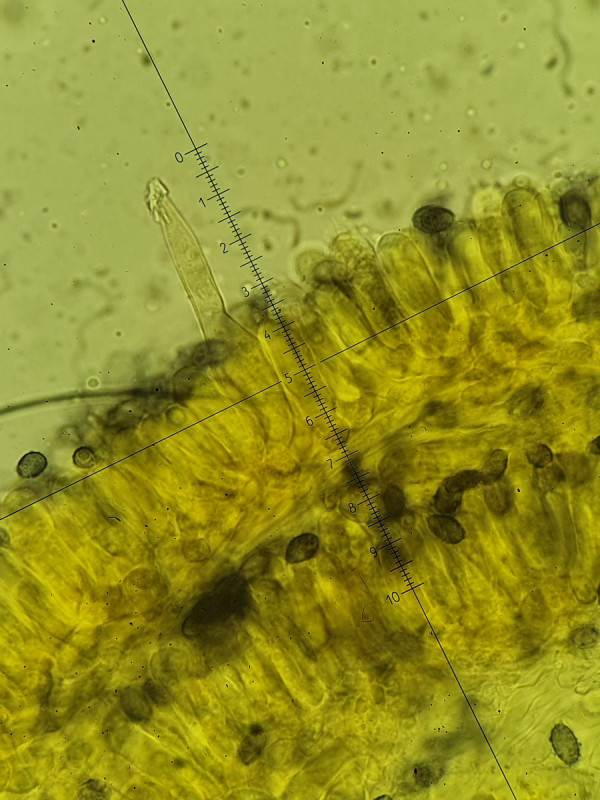
Wieder anders die Kaulos, diese wirken schlanker, fast lanzettförmig, sind jedoch auch fusiform und dabei wiederrum dickwandiger als die Pleurozystiden.
Als Literatur steht mir nur der Pareys bzw. Fungi of Northern Europe zur Verfügung. In letzterem Band komme ich bei wenigen Arten nicht weiter, am stimmigsten erscheint mir im Pareys Melanoleuca melaleuca. Hier passen Makro- und Mikromerkmale sehr gut, auch die Ökologie. Er wird als häufig und verbreitet beschrieben.
Leider scheint die Literatur sehr unzureichend in diesem Bereich. Ludwig wies in jedem seiner Bände erneut daraufhin, dass er die Gattung in der Darstellung zurückstellt, da noch nicht zur Genüge bearbeitet (vgl. Pilzkompendium Band 4, III), was "angesichts der Problematik der Materie nicht verwundert", so schrieb er dort. Daher meine Frage, was nutzt ihr für Schlüssel für die Gattung Melanoleuca, gibt es dort Entwicklungen? Weiß jemand ob diese Gattung im (hoffentlich noch erscheinenden) Band V vorkommen wird?
Kann man den Bestimmling da lassen oder gibt es nach neueren Erkenntnissen gar keinen "gemeinen" Weichritterling?
Hier die Bilder:
Makroaufnahmen:


Sporen samt Pleurozystide bei 1000-facher Vergrößerung in Melzer (60µm):
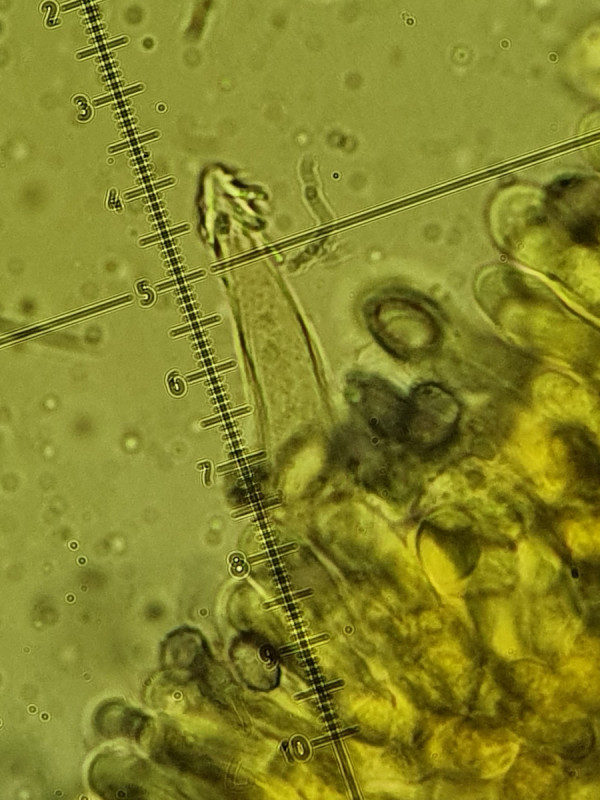
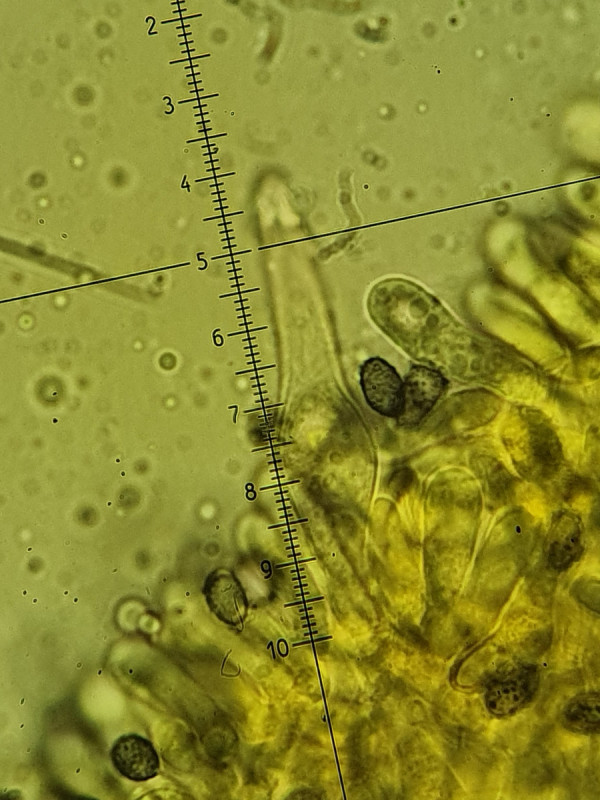
Cheilozystide bei 1000-fach (400-fach, 2tes), man beachte am "Grund/Ursprung" die rundliche, bohnenförmige Struktur (aus der die Zystide entspringt?)
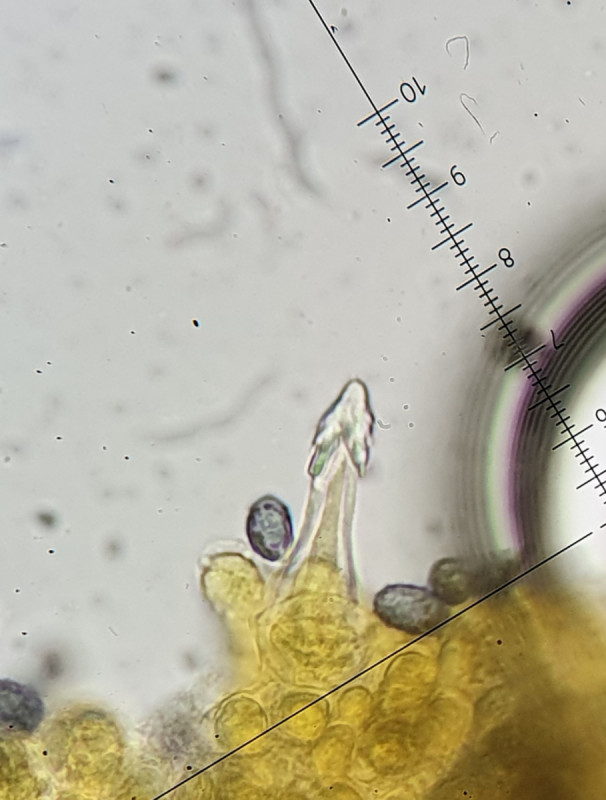
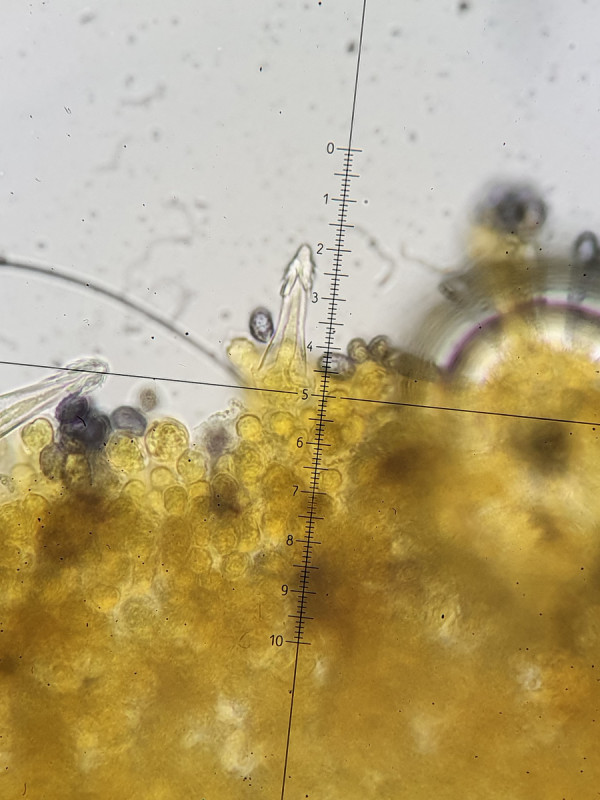
Kaulozystiden (80 µm schmal fusiform) bei 1000- und 400-facher Vergrößerung.

Beste Grüße Sebastian


